Перейти к:
Резистентность к антибиотикам экологических изолятов Vibrio cholerae nonO1/nonO139
https://doi.org/10.35627/2219-5238/2022-30-3-66-71
Аннотация
Введение. Штаммы V. cholerae non-О1/non-О139 являются этиологическими агентами острых кишечных инфекций различной степени тяжести. Мониторинг антибактериальной лекарственной устойчивости их экологических изолятов, циркулирующих в конкретных районах, имеет большое значение для локального прогнозирования и профилактики заболеваний, а также для эффективного выбора препаратов для этиотропной терапии.
Цель: изучить антибактериальную лекарственную устойчивость штаммов V. cholerae non-O1/non-O139, выделенных из проб поверхностных вод в рамках ежегодного мониторинга холеры в Референс-центре Ростовского-на-Дону противочумного НИИ в 2019–2020 гг.
Материалы и методы: мы протестировали 263 и 87 штаммов V. cholerae non-O1/non-O139, выделенных из проб поверхностных вод в 2019 и 2020 годах, соответственно, на чувствительность и/или устойчивость к антибактериальным препаратам, рекомендованным для экстренной профилактики и лечения холеры, методом серийных разведений в агаре Мюллера – Хинтона.
Результаты и обсуждение. Все изоляты представляли собой типичные нетоксигенные штаммы V. cholerae, содержащие гены hlyA и лишенные генов wbe-, wbf-, ctxA, tcpA-. При сравнении годовых долей видов Vibrio cholerae, устойчивых к разным антибиотикам, мы наблюдали статистически значимые изменения доли штаммов, резистентных к ампициллину (с 39,2 до 98,8 %), цефотаксиму (с 1,5 до 5,7 %), рифампицину (31,2 до 8,0 %). Все исследованные вибрионы оставались чувствительными к гентамицину и доксициклину. Данные за 2019–2020 годы свидетельствуют о статистическом увеличении доли штаммов с множественной лекарственной устойчивостью.
Заключение. Наши результаты подтверждают необходимость дальнейших мониторинговых исследований для понимания распространенности устойчивости к антибактериальным препаратам среди штаммов V. cholerae, отличных от O1/ отличных от O-139.
Ключевые слова
Для цитирования:
Тришина А.В., Березняк Е.А., Ежова М.И., Березняк Ю.Л., Чемисова О.С. Резистентность к антибиотикам экологических изолятов Vibrio cholerae nonO1/nonO139. Здоровье населения и среда обитания – ЗНиСО. 2022;(3):66-71. https://doi.org/10.35627/2219-5238/2022-30-3-66-71
For citation:
Trishina A.V., Bereznyak E.A., Ezhova M.I., Bereznyak Yu.L., Chemisova O.S. Antibiotic resistance of surface water Vibrio cholerae non-O1/non-O139 isolates. Public Health and Life Environment – PH&LE. 2022;(3):66-71. (In Russ.) https://doi.org/10.35627/2219-5238/2022-30-3-66-71
Введение. Vibrio cholerae nonO1/nonO139 (НАГвибрионы) обнаруживаются в различных экологических нишах – прибрежных водах, озерах, водоемах и являются их естественными обитателями. Заражение вибрионами nonO1/nonO139 серогрупп может вызывать легкие желудочно-кишечные заболевания, раневые или ушные инфекции у здоровых людей. Среди людей с ослабленным иммунитетом они могут стать причиной тяжелых раневых инфекций или сепсиса и связаны с высоким уровнем смертности [1–4]. Особое внимание привлекают случаи инфицирования желчных путей НАГ-вибрионами, что является причиной первичной септицемии, перитонита [5].
В последнее время появились сообщения об участившихся случаях заболеваний, вызванных V. cholerae nonO1/nonO139 во многих странах, возникающих при купании в морской воде [6][7] и пресноводных озерах [8–10]. Штаммы V. cholerae nonO1/nonO139 все чаще признаются в качестве потенциального этиологического агента, имеющего одинаковую нишу с патогенными штаммами [11][12].
В литературе встречаются многочисленные данные о множественной лекарственной устойчивости клинических штаммов V. cholerae O1 и O139 [13][14] и экологических изолятов, относящихся к V. cholerae nonO1/nonO139, выделяемых из внешней среды [15].
Геном холерных вибрионов nonО1/nonO139 серогрупп содержит специализированные мобильные элементы, которые несут гены антибиотикорезистентности, способные передаваться между штаммами [16][17]. Наличие мобильных генетических элементов и мегаинтегрона создает благоприятные условия для горизонтального переноса генов от штамма к штамму и не исключает дальнейшего нарастания числа резистентных микроорганизмов, поскольку водные экосистемы обеспечивают подходящую среду для распространения устойчивости к противомикробным препаратам.
Изменение водных экосистем в результате антропогенного воздействия влияет на формирование устойчивости к антибиотикам региональных водных микроорганизмов [18]. В связи с этим мониторинг устойчивости к противомикробным препаратам популяций V. cholerae nonO1/nonO139 в окружающей среде, циркулирующих на конкретных территориях, имеет большое значение для прогнозирования и предотвращения заболеваемости, а также эффективного выбора средств этиотропной терапии [11].
Цель настоящего исследования – изучение резистентности к антибактериальным препаратам изолятов V. cholerae nonO1/nonO139, полученных в процессе ежегодного мониторинга холеры Референс-центром Ростовского-на-Дону противочумного института в 2019–2020 гг.
Материалы и методы. Штаммы V. cholerae nonO1/nonO139 были изолированы из стационарных точек водоемов г. Ростова-на-Дону в рамках ежегодного мониторинга холеры в 2019–2020 гг. Выделение культур из поверхностных водоемов, изучение биохимической активности и культурально-морфологических свойств, а также постановку тестов внутривидовой дифференциации проводили в соответствии c актуальными нормативно-методическими документами: МУК 4.2.2218–071; МУК 4.2.2870–112.
Проводили масс-спектрометрический анализ для полной ускоренной идентификации микроорганизмов, используя MALDI-TOF масс-спектрометр Microflex (Bruker Daltonics). Обработку, анализ и запись масс-спектров осуществляли в соответствии с МР 4.2.0089–143 с помощью программного обеспечения фирмы Bruker Daltonics: flexControl 2.4 (Build 38) и flexAnalysis 2.4 (Build 11).
Чувствительность/устойчивость НАГ-вибрионов к антибактериальным препаратам (АБП) проводили методом серийных разведений в агаре Мюллера – Хинтона рН (7,3 ± 0,2) HiMEDIA. Интерпретацию результатов антибиотикорезистентности вибрионов к АБП проводили в соответствии с МУК 4.2.2495–094. Антибактериальные препараты для экстренной профилактики и лечения холеры подбирали в соответствии с рекомендациями.
Для контроля качества антибактериальных препаратов и питательных сред использовали референтные тест-штаммы V. cholerae non О1 КM 162 (P 9741), Escherichia coli ATCC 25922.
С помощью стандартных средств программы Microsoft Office Excel проводили статистическую обработку результатов.
По методу Уилсона оценивали доверительные интервалы для доли полирезистентных штаммов (при доверительной вероятности p ≥ 0,95). Достоверность различия выборочных долей оценивали с помощью двустороннего z-теста (при уровне значимости α ≤ 0,05).
Мониторинг контаминации объектов окружающей среды холерными вибрионами как О1, так и не О1 групп является составляющей эпидемиологического надзора за холерой. Изучение вибриофлоры в стационарных точках открытых водоемов Ростовского региона проводится ежегодно с мая по октябрь во ФКУЗ «Ростовский-на-Дону противочумный институт Роспотребнадзора».
В настоящей работе проанализированы результаты изучения чувствительности/устойчивости к АБП 350 штаммов V. cholerae nonO1/nonO139, выделенных из объектов окружающей среды в 2019 г. (263 штаммов) и 2020 г. (87 штаммов). Выделение и идентификацию культур холерных вибрионов проводили в соответствии со схемой лабораторной диагностики [19]. Видовую принадлежность проводили с помощью биохимических тестов, дополнительно используя метод MALDI-TOF MS.
Этот метод позволил успешно идентифицировать изоляты V. cholerae до видового уровня с высокой достоверностью. Для дальнейшей дифференциации было проведено серотипирование выделенных штаммов сыворотками диагностическими агглютинирующими O1, O139. Серологическую идентификацию V. cholerae nonO1/nonO139 проводили в реакции «слайд – агглютинации» c помощью набора сывороток диагностических холерных неО1/неО139 серогрупп моноспецифических кроличьих против типовых штаммов холерных вибрионов различных (О2–О84) серогрупп. Результаты. Все исследуемые штаммы были типичными представителями вида V. cholerae, не токсигенными (содержали гены hlyA, но не содержали гены wbe-, wbf-, ctxA, tcpA-).
Изучаемые культуры V. cholerae nonO1/nonO139 были протестированы на чувствительность/устойчивость к широкому спектру противомикробных препаратов (табл. 1).
Таблица 1. Чувствительность/устойчивость к АБП НАГ-вибрионов
Table 1. Antibacterial drug susceptibility/resistance of surface water Vibrio cholerae non-O1/non-O139 isolates in Rostov-on-Don, 2019–2020

Примечание: * S – чувствительные, R – резистентные; ** AMP – ампициллин, GN – гентамицин, DO – доксициклин, CIP – ципрофлоксацин, NA – налидиксовая кислота, SXT – ко-тримоксазол, CTX – цефотаксим, FUR – фуразолидон, C – хлорамфеникол (левомицетин), RIF – рифампицин, TE – тетрациклин, SТ – стрептомицин.
Notes: * S, susceptible; R, resistant; **AMP, ampicillin; GN, gentamicin; DO, doxycycline; CIP, ciprofloxacin; NA, nalidixic acid; SXT, co-trimoxazole; CTX, cefotaxime; FUR, furazolidone; C, chloramphenicol; RIF, rifampicin; TE, tetracycline; SТ, streptomycin.
Из 263 изолятов НАГ-вибрионов, выделенных в 2019 году, наибольшее число резистентных штаммов было зарегистрировано к ампициллину – 103 (39,2 %), рифампицину – 82 (31,2 %), налидиксовой кислоте – 68 (25,9 %) и фуразолидону – 53 (20,2 %). Эти штаммы были классифицированы как лекарственно устойчивые (R).
Чувствительность (S) к гентамицину и доксициклину показали все изоляты, выделенные в 2019 г. Один штамм (0,4 %) был устойчив к тетрациклину, два (0,8 %) – к ципрофлосакцину, четыре – к цефотаксиму (1,5 %). Девять изолятов показали устойчивость к ко-тримоксазолу (3,4 %), к левомицетину были устойчивы 8 штаммов (3 %), к стрептомицину – 8 (3 %).
В 2020 году доля штаммов V. cholerae nonO1/ nonO139, резистентных к ампициллину, составила 98,8 %. Устойчивость к фуразолидону зарегистрирована в 28,7 % случаев, налидиксовой кислоте – на уровне 26,4 %. Холерных вибрионов, резистентных к гентамицину, доксициклину, тетрациклину, ципрофлоксацину, в 2020 г. не было обнаружено.
При сравнении долей штаммов холерных вибрионов, устойчивых к разным классам АБП, в 2019 и 2020 гг. зарегистрированы статистически значимые изменения к ампициллину, цефотаксиму и рифампицину. Доля резистентных к ампициллину штаммов возросла с 60,8 до 98,8 %, к цефотаксиму изменилась с 1,5 до 5,7 %, к рифампицину снизилась с 31,2 до 8,0 % (при доверительной вероятности p ≥ 0,95). Все исследуемые вибрионы сохранили чувствительность к гентамицину и доксициклину. К остальным АБП зафиксированы незначительные изменения доли резистентных штаммов.
В 2019 году 29,3 % штаммов V. cholerae nonO1/ nonO139 обладали чувствительностью ко всем АБП, 38,4 % являлись монорезистентными, обнаружены фенотипы резистентности к двум АБП (16,0 %) (табл. 2). Термин «множественная лекарственная устойчивость» использовался нами для изолятов, которые устойчивы по меньшей мере к трем различным классам антимикробных препаратов [20]. Доля таких штаммов в нашем исследовании составила 27,4 %.
Таблица 2. Фенотипы резистентности к АБП НАГ-вибрионов (%)
Table 2. Phenotypes of antibacterial drug resistance of surface water Vibrio cholerae non-O1/non-O139 isolates in Rostov-on-Don, 2019–2020 (%)

Примечание: * В квадратных скобках указаны доверительные интервалы для доли полирезистентных штаммов.
Notes: * Confidence intervals for the proportion of multidrug-resistant strains are given in square brackets.
В 2020 г. чувствительных и монорезистентных штаммов V. cholerae nonO1/nonO139 обнаружено не было, резистентные к 2 АБП выделялись в 43,7 % случаев. Доля полирезистентных штаммов составила 56,3 %. Сравнение данных, полученных в 2019–2020 гг., указывает на статистически достоверное увеличение доли полирезистентных штаммов (z = 4,9; p < 0,0001).
Во многих регионах отмечается нарастание резистентности V. cholerae nonO1/nonO139 к ампициллину, ципрофлоксацину, налидиксовой кислоте и сульфаметоксазолу/триметоприму, а также числа полирезистентных штаммов [22–25].
Результаты исследований, проведенных в 2019 и 2020 гг., были внесены в пополняемую базу данных «Фенотипы антибиотикорезистентности холерных вибрионов различных серогрупп, выделенных на территории Ростовской области» (свидетельство о регистрации № 2017621303 от 14 ноября 2017 г.), которая ежегодно обновляется в рамках эпидемиологического мониторинга за холерой. Это позволяет оперативно анализировать динамику изменений регионального уровня антибиотикорезистентности.
Анализ фенотипических профилей антибиотикорезистентности штаммов V. cholerae nonO1/ nonO139, исследуемых в предыдущие годы (2016, 2017, 2020 гг.), показал, что чувствительных ко всем тестируемым антибиотикам вибрионов не выявлено. В 2018 г. таких штаммов было выделено 2,2 %, в 2019 г. – 29,3 % [21]. Доля полирезистентных штаммов колебалась с 19,8 % в 2016 г., в 2017 г. – 22,6 %, 2018 г. – 30 %, 2019 г. – 27,4 %. В 2020 г. доля таких штаммов возросла и составила 56,3 % (рисунок). Проведенный мониторинг показал достоверное увеличение доли полирезистентных штаммов V. cholerae nonO1/nonO139, выделенных из поверхностных водоемов, что показывает нарастающее влияние антропогенных факторов на окружающую среду и свидетельствует о санитарно-эпидемиологическом и экологическом неблагополучии гидроэкосистем г. Ростова-на-Дону.
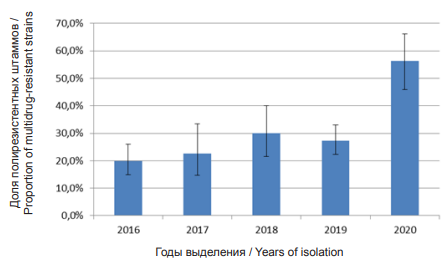
Рисунок. Доля полирезистентных штаммов V. cholerae non-O1/non-O139, выделенных в г. Ростове-на-Дону в 2016–2020 гг.
Figure. The proportion of multidrug-resistant V. cholerae non-О1/non-О139 strains isolated from surface water samples in Rostov-on-Don, 2016–2020
Обсуждение. Экологические места обитания – реки, озера и другие водоемы – являются идеальной средой для передачи маркеров устойчивости к АБП среди микроорганизмов. Взаимодействие антибиотикоустойчивых бактерий с автохтонной микрофлорой способствует селекции штаммов и преобладанию устойчивых бактерий, приводящему к глобальному нарушению экосистемы [26]. Проведенные ранее исследования видового разнообразия и структуры микробных сообществ водоемов г. Ростова-на-Дону показали, что микрофлора водоемов представлена микроорганизмами разных таксономических групп с высокой долей полирезистентных штаммов [27].
Холерные вибрионы nonO1/nonO139, являясь автохтонными представителями водоемов, обладают исключительной способностью быстро приспосабливаться к меняющимся условиям среды. Возникновение устойчивости к антибиотикам является естественным эволюционным процессом, и такие факторы, как плотность микробного сообщества, использование антибиотиков в здравоохранении и животноводстве, могут влиять на частоту появления полирезистентных штаммов [28].
Заключение. Выделение из водных объектов г. Ростова-на-Дону большого числа полирезистентных изолятов V. cholerae nonO1/nonO139 свидетельствует о необходимости дальнейших мониторинговых исследований для понимания распространения резистентности к АБП среди микроорганизмов, поскольку появление устойчивости к часто используемым и рекомендуемым для лечения препаратам может влиять на национальные стратегии борьбы с холерой в случае возникновения чрезвычайных ситуаций.
1. МУК 4.2.2218–07 «Лабораторная диагностика холеры» (утв. Главным государственным санитарным врачом РФ 31 мая 2007 г.). Доступно по: https://base.garant.ru/4185509/.
2. МУК 4.2.2870–11 «Порядок организации и проведения лабораторной диагностики холеры для лабораторий террито- риального, регионального и федерального уровней» (утв. Главным государственным санитарным врачом РФ 25.05.2011).
3. МР 4.2.0089–14 «Использование метода времяпролетной масс-спектрометрии с матрично-активированной лазерной десорбцией/ионизацией (MALDI-ToF MS) для индикации и идентификации возбудителей I–II групп патогенности» (утв. руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом Российской Федерации А.Ю. Поповой 24 апреля 2014 г.).
4. МУК 4.2.2495–09 «Определение чувствительности возбудителей опасных бактериальных инфекций (чума, сибирская язва, холера, туляремия, бруцеллез, сап, мелиоидоз) к антибактериальным препаратам». Москва: Федеральный центр гигиены и эпидемиологии Роспотребнадзора, 2010. 59 с.
Список литературы
1. Petsaris O, Nousbaum JB, Quilici ML, Le Coadou G, Payan C, Abalain ML. Non-O1, non-O139 Vibrio cholerae bacteraemia in a cirrhotic patient. J Med Microbiol. 2010;59(Pt10):1260-1262. doi: 10.1099/jmm.0.021014-0
2. Lan NP, Nga TV, Yen NT, et al. Two cases of bacteriemia caused by nontoxigenic, non-O1, non-O139 Vibrio cholerae isolates in Ho Chi Minh City, Vietnam. J Clin Microbiol. 2014;52(10):3819-3821. doi: 10.1128/JCM.01915-14
3. Монахова Е.В., Архангельская И.В. Холерные вибрионы нео1/нео139 серогрупп в этиологии острых кишечных инфекций: современная ситуация в России и в мире // Проблемы особо опасных инфекций. 2016. № 2. С. 14–23. doi: 10.21055/0370-1069-2016-2-14-23
4. Архангельская И.В., Непомнящая Н.Б., Левченко Д.А. Внекишечные заболевания, вызванные холерными вибрионами неО1/неО139 серогрупп в России // Инфекционные болезни в современном мире: эпидемиология, диагностика, лечение и профилактика: Сборник трудов XII Ежегодного Всероссийского интернет-конгресса по инфекционным болезням с международным участием, Москва, 07–09 сентября 2020 года / Под ред. В.И. Покровского. Москва: Общество с ограниченной ответственностью „Медицинское Маркетинговое Агентство”, 2020. С. 19.
5. Dutta D, Chowdhury G, Pazhani GP, et al. Vibrio cholera non-O1, non-O139 serogroups and cholera-like diarrhea, Kolkata, India. Emerg Infect Dis. 2013;19(3):464-467. doi: 10.3201/eid1903.121156
6. Baker-Austin C, Trinanes JA, Taylor NGH, Hartnell R, Siitonen A, Martinez-Urtaza J. Emerging Vibrio risk at high latitudes in response to ocean warming. Nat Clim Change. 2013;3:73-77. doi: 10.1038/nclimate1628
7. Marinello S, Marini G, Parisi G, et al. Vibrio cholerae non-O1, non-O139 bacteraemia associated with pneumonia, Italy 2016. Infection. 2017;45(2):237-240. doi: 10.1007/s15010-016-0961-4
8. Chen YT, Tang HJ, Chao CM, Lai CC. Clinical manifestations of non-O1 Vibrio cholerae infections. PLoS One. 2015;10(1):e0116904. doi: 10.1371/journal.pone.0116904
9. Dobrović K, Rudman F, Ottaviani D, Šestan Crnek S, Leoni F, Škrlin J. A rare case of necrotizing fasciitis caused by Vibrio cholerae O8 in an immunocompetent patient. Wien Klin Wochenschr. 2016;128(19-20):728-730. doi: 10.1007/s00508-016-1060-3
10. Kechker P, Senderovich Y, Ken-Dror S, Laviad-Shitrit S, Arakawa E, Halpern M. Otitis media caused by V. cholerae O100: A case report and review of the literature. Front Microbiol. 2017;8:1619. doi: 10.3389/fmicb.2017.01619
11. Chowdhury G, Joshi S, Bhattacharya S, et al. Extraintestinal infections caused by non-toxigenic Vibrio cholerae non-O1/non-O139. Front Microbiol. 2016;7:144. doi: 10.3389/fmicb.2016.00144
12. Zhu HZ, Zhang ZF, Zhou N, et al. Diversity, distribution and co-occurrence patterns of bacterial communities in a karst cave system. Front Microbiol. 2019;10:1726. doi: 10.3389/fmicb.2019.01726
13. Das B, Chaudhuri S, Srivastava R, Nair GB, Ramamurthy T. Fostering research into antimicrobial resistance in India. BMJ. 2017;358:j3535. doi: 10.1136/bmj.j3535
14. Verma J, Bag S, Saha B, et al. Genomic plasticity associated with antimicrobial resistance in Vibrio cholerae. Proc Natl Acad Sci U S A. 2019;116(13):6226-6231. doi: 10.1073/pnas.1900141116
15. Kitaoka M, Miyata ST, Unterweger D, Pukatzki S. Antibiotic resistance mechanisms of Vibrio cholerae. J Med Microbiol. 2011;60(Pt 4):397-407. doi: 10.1099/jmm.0.023051-0
16. Mala W, Faksri K, Samerpitak K, et al. Antimicrobial resistance and genetic diversity of the SXT element in Vibrio cholerae from clinical and environmental water samples in northeastern Thailand. Infect Genet Evol. 2017;52:89-95. doi: 10.1016/j.meegid.2017.04.013
17. Das B, Verma J, Kumar P, Ghosh A, Ramamurthy T. Antibiotic resistance in Vibrio cholerae: Understanding the ecology of resistance genes and mechanisms. Vaccine. 2020;38 Suppl 1:A83-A92. doi: 10.1016/j.vaccine.2019.06.031
18. Grennia P., Anconab V., Caraccioloa A.B. Ecological effects of antibiotics on natural ecosystems: A review. Microchemical Journal. 2018;136:25-39. doi: 10.1016/j.microc.2017.02.006
19. Авдеева Е.П., Мазрухо Б.Л., Ишина Е.В. и др. Оценка метода серологической идентификации Vibrio cholerae не О1 // Журнал микробиологии, эпидемиологии и иммунобиологии. 2001. № 4. С. 75–78.
20. Baquero F, Martínez JL, Cantón R. Antibiotics and antibiotic resistance in water environments. Curr Opin Biotechnol. 2008;19(3):260-265. doi: 10.1016/j.copbio.2008.05.006
21. Березняк Е.А., Тришина А.В., Архангельская И.В., Симонова И.Р., Чемисова О.С. Антибиотикочувствительность холерных вибрионов nonО1/nonО139 серогрупп, изолированных из гидроэкосистем в 2016–2018 гг. // Здоровье населения и среда обитания. 2020. № 5(326). С. 52–56. doi: 10.35627/2219-5238/2020-326-5-52-56
22. Утепова И.Б., Сагиев З.А., Алыбаев С.Д. и др. Характеристика штаммов холерных вибрионов, выделенных на территории Казахстана // Acta Biomedica Scientifica. 2017. Т. 2. № 5(1). С. 100–105. doi: 10.12737/article_59e8597494f893.97278235
23. Siriphap A, Leekitcharoenphon P, Kaas RS, et al. Characterization and genetic variation of Vibrio cholerae isolated from clinical and environmental sources in Thailand. PLoS One. 2017;12(1):e0169324. doi: 10.1371/journal.pone.0169324
24. Eibach D, Herrera-León S, Gil H, et al. Molecular epidemiology and antibiotic susceptibility of Vibrio cholerae associated with a large cholera outbreak in Ghana in 2014. PLoS Negl Trop Dis. 2016;10(5):e0004751. doi: 10.1371/journal.pntd.0004751
25. Marin MA, Thompson CC, Freitas FS, et al. Cholera outbreaks in Nigeria are associated with multidrug resistant atypical El Tor and non-O1/non-O139 Vibrio cholerae. PLoS Negl Trop Dis. 2013;7(2):e2049. doi: 10.1371/journal.pntd.0002049
26. Bassetti M, Peghin M, Pecori D. The management of multidrug-resistant Enterobacteriaceae. Curr Opin Infect Dis. 2016;29(6):583-594. doi: 10.1097/QCO.0000000000000314
27. Березняк Е.А., Тришина А.В., Веркина Л.М., Полеева М.В., Симонова И.Р., Бареева А.Е. Изучение видового разнообразия и антибиотикорезистентности микрофлоры водоемов г. Ростова-на-Дону // Гигиена и санитария. 2018. Т. 97. № 5. С. 405–410. doi: 10.18821/0016-9900-2018-97-5-405-410
28. Das B, Verma J, Kumar P, Ghosh A, Ramamurthy T. Antibiotic resistance in Vibrio cholerae: Understanding the ecology of resistance genes and mechanisms. Vaccine. 2020;38 Suppl 1:A83-A92. doi: 10.1016/j.vaccine.2019.06.031
Об авторах
А. В. ТришинаРоссия
Тришина Алёна Викторовна – к.б.н., старший научный сотрудник лаборатории биологической безопасности и лечения ООИ
ул. М. Горького, д. 117/40, г. Ростов-на-Дону, 344002
Е. А. Березняк
Россия
Березняк Елена Александровна – к.б.н., старший научный сотрудник лаборатории биологической безопасности и лечения ООИ
ул. М. Горького, д. 117/40, г. Ростов-на-Дону, 344002
М. И. Ежова
Россия
Ежова Мария Ивановна – научный сотрудник лаборатории микробиологии холеры
ул. М. Горького, д. 117/40, г. Ростов-на-Дону, 344002
Ю. Л. Березняк
Россия
Березняк Юрий Львович – к.б.н., доцент, заведующий кафедрой физики
пер. Нахичеванский, д. 29, г. Ростов-на-Дону, 344022
О. С. Чемисова
Россия
Чемисова Ольга Сергеевна – к.б.н., исполняющий обязанности заведующего музеем живых культур с ЦПВ
ул. М. Горького, д. 117/40, г. Ростов-на-Дону, 344002
Рецензия
Для цитирования:
Тришина А.В., Березняк Е.А., Ежова М.И., Березняк Ю.Л., Чемисова О.С. Резистентность к антибиотикам экологических изолятов Vibrio cholerae nonO1/nonO139. Здоровье населения и среда обитания – ЗНиСО. 2022;(3):66-71. https://doi.org/10.35627/2219-5238/2022-30-3-66-71
For citation:
Trishina A.V., Bereznyak E.A., Ezhova M.I., Bereznyak Yu.L., Chemisova O.S. Antibiotic resistance of surface water Vibrio cholerae non-O1/non-O139 isolates. Public Health and Life Environment – PH&LE. 2022;(3):66-71. (In Russ.) https://doi.org/10.35627/2219-5238/2022-30-3-66-71









.png)



























