Перейти к:
Характеристики геномов условно-патогенных бактерий зоогенных экосистем островов Западной Арктики
https://doi.org/10.35627/2219-5238/2024-32-6-81-88
Аннотация
Введение. Арктические экосистемы являются важнейшим объектом микробиологического мониторинга, позволяющего отслеживать динамично меняющуюся природную среду на фоне климатических изменений и промышленного освоения северных территорий.
Цель исследования заключалась в оценке эпидемического потенциала условно-патогенных бактерий, ассоциированных с животными арктических островов Баренцева и Карского морей.
Материалы и методы. В работе охарактеризованы четыре штамма грамотрицательных условно-патогенных бактерий (Serratia fonticola, Aeromonas salmonicida, Yersinia kristensenii, Yersinia rochesterensis), выделенные в 2021–2022 гг. при микробиологических исследованиях 46 образцов зоогенного биологического материала из природных экосистем острова Вайгач, архипелагов Новая Земля и Земля Франца-Иосифа. Геномы выделенных штаммов микроорганизмов были секвенированы с использованием технологии Illumina MiSeq и после сборки de novo при помощи геномного ассемблера SPAdes 13.0 аннотированы с использованием приложения RAST.
Результаты. Продемонстрировано, что изученные штаммы располагают рядом факторов вирулентности и генами устойчивости к антибиотикам, что позволяет рассматривать их в качестве потенциальных патогенов. В составе геномов всех изученных бактерий обнаруживаются бета-лактамазы классов A, B, C, из числа факторов патогенности – типичны опероны сидерофоров и систем секреции IV типа. Кроме того, в геномах иерсиний идентифицируется также ген энтеротоксина ytxA коклюшного типа.
Выводы. Результаты исследования свидетельствуют о возможности формирования природных очагов возбудителей актуальных инфекций на островах высокоширотной Арктики, имеющих перспективы развития туризма, хозяйственного освоения.
Ключевые слова
Для цитирования:
Асланов Б.И., Гончаров А.Е., Азаров Д.В., Трофимова А.Н., Аксенов А.С., Мизин И.А., Колоджиева В.В., Кушниренко Д.А., Краева Л.А., Панин А.Л., Крыленков В.А. Характеристики геномов условно-патогенных бактерий зоогенных экосистем островов Западной Арктики. Здоровье населения и среда обитания – ЗНиСО. 2024;32(6):81-88. https://doi.org/10.35627/2219-5238/2024-32-6-81-88
For citation:
Aslanov B.I., Goncharov A.E., Azarov D.V., Trofimova A.N., Aksenov A.S., Mizin I.A., Kolodzhieva V.V., Kushnirenko D.A., Kraeva L.A., Panin A.L., Krylenkov V.A. Characteristics of genomes of opportunistic bacteria in zoogenic ecosystems of the Russian Western Arctic Islands. Public Health and Life Environment – PH&LE. 2024;32(6):81-88. (In Russ.) https://doi.org/10.35627/2219-5238/2024-32-6-81-88
Введение. Одним из существенных результатов развития теории природной очаговости в последние десятилетия является разработка и внедрение в качестве инициативы Всемирной организации здравоохранения стратегии эпидемиологического надзора за инфекциями, общими для человека и животных, известной как подход «Единого здоровья» (One Health approach) [1–4]. Данный подход декларирует необходимость микробиологического мониторинга возбудителей инфекционных заболеваний и детерминант лекарственной устойчивости в человеческом обществе, популяциях сельскохозяйственных и домашних животных, а также в природных экосистемах. Следует указать, что спектр природно-очаговых инфекций в XXI веке существенно дополнен новыми нозологическими формами и включает в качестве возбудителей инфекций у человека, наряду с облигатными патогенами, условно-патогенные микроорганизмы [5] что существенно расширяет задачи программ микробиологического мониторинга в «дикой природе».
Экосистемы полярных регионов планеты представляют особый интерес в качестве объектов мониторинговых исследований как конечные ареалы сезонных миграций перелетных птиц и ряда млекопитающих и в качестве чувствительных индикаторов состояния природной среды, на которую воздействуют климатические изменения и хозяйственное освоение территорий.
В высокоширотной Арктике известны природные очаги опасных инфекционных заболеваний, в частности бешенства [6], зоонозного гриппа А [7], сибирской язвы [8].
Однако объем информации об эпидемическом потенциале условно-патогенных бактерий, о распространении детерминант антибиотикорезистентности явно недостаточен, что увеличивает востребованность исследований микробиоты, ассоциированной с арктическими животными.
Цель исследования: оценка эпидемического потенциала условно-патогенных бактерий, ассоциированных с животными арктических островов Баренцева и Карского морей.
Материалы и методы. В ходе экспедиций «Арктический плавучий университет» в 2021–2022 годах на островах западного сектора Арктики (остров Вайгач, остров Северный архипелага Новая Земля, острова Гукера и Белл архипелага Земля Франца-Иосифа) было отобрано 46 образцов биологического материала, ассоциированного с мигрирующими животными, в том числе птицами. География мест отбора проб представлена на рисунке.
Асептически взятые пробы (фекалии белого медведя, птиц отряда гусеобразных, субстрат из нор грызунов и из орнитогенных почв на птичьих базарах) помещали в пробирки со стерильным физиологическим раствором в соотношении 1:10, а затем культивировали на плотных питательных средах – на агаре Эндо и хромогеном UTI агаре (HiMedia, Индия), инкубируя при температуре 35–37 градусов в переносном термостате непосредственно на борту научно-экспедиционного судна «Михаил Сомов» и научно-исследовательского судна «Профессор Молчанов». В целях выделения доминирующих в материале культур микроорганизмов использовали прямой посев на плотные питательные среды, то есть метод обогащения на жидких питательных средах не применялся.
Геномы выделенных штаммов микроорганизмов были секвенированы с использованием технологии Illumina MiSeq (ресурсный центр «Биобанк», СПбГУ).
Библиотеки фрагментов ДНК готовили с использованием метода ультразвуковой фрагментации ДНК. Качество полученных библиотек оценивали с помощью анализатора Agilent Bioanalyzer 2100 (Agilent Technologies, США). Необработанные данные считывались после контроля качества, выполненного с помощью FastQC v0.11 (https://www.bioinformatics.babraham.ac.uk/projects/fastqc/) были собраны de novo при помощи геномного ассемблера SPAdes 13.0 (https://github.com/ablab/spades), функциональная аннотация геномов осуществлялась с использованием онлайн приложения RAST (https://rast.nmpdr.org/).
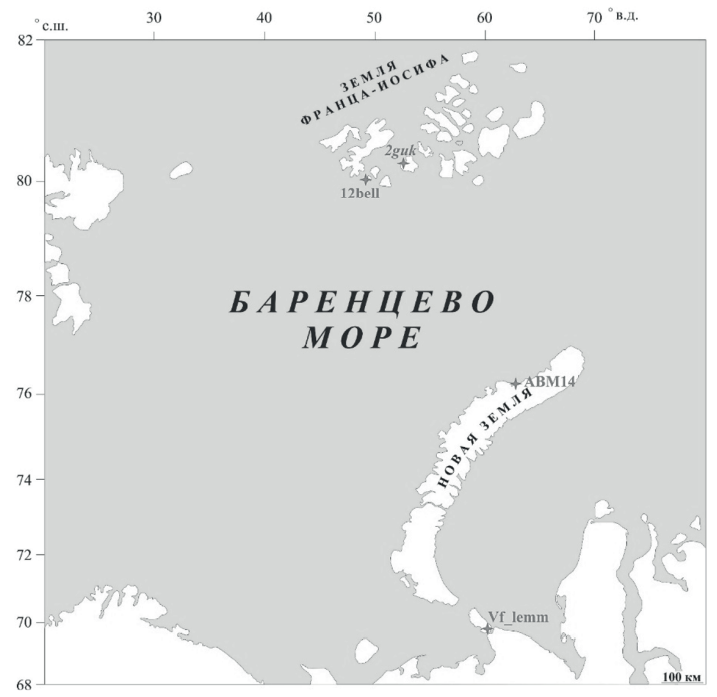
Рисунок. География мест отбора проб
Figure. Sampling geography
Результаты. В настоящем исследовании охарактеризованы геномы нескольких выделенных из биологического материала штаммов. Информация об источниках их выделения представлена в табл. 1.
Как видно из данных, представленных в табл. 1, описанные штаммы бактерий выделены из зоогенного биологического материала, собранного на островных территориях западного сектора Российской Арктики между 69° и 79° северной широты.
Основные сведения о размере геномов, и особенностях геномных последовательностей представлены в табл. 2.
Обсуждаемые штаммы располагают геномами типичных для соответствующих видов бактерий размеров и GC-содержания.
Результаты геномного аннотирования, представленные в табл. 2, свидетельствуют о наличии генов вирулентности в геномах всех изученных штаммов, что позволяет рассматривать эти бактерии в качестве потенциальных патогенов. Так, геном Aeromonas salmonicida ABM14 содержит опероны синтеза RTX-токсина и внеклеточной протеазы (вибриолизина), сходной с эластазой синегнойной палочки. В геномах иерсиний (Yersinia kristensenii 2 guk и Yersinia rochesterensis 12bell) присутствуют гены факторов патогенности – сидерофоров энтеробактинового, и аэробактинового кластеров, а также гены белков секреции 6-го типа, пили 4-го типа, гены гемолизина ShlB/FhaC/HecB семейства и фосфолипазы С. Кроме того, в геномах иерсиний идентифицируется также энтеротоксин YtxA, а в геноме Y. kristenseinii присутствует также ген инвазина inv В составе генома Serratia fonticola Vf_lemm обнаруживаются гены системы секреции T6SS, включая ген hcp.
В составе геномов всех изученных бактерий обнаруживаются гены резистентности к антибиотикам, включая бета-лактамазы классов A, B, C, гены устойчивости к хинолонам (ген QnrB10, за исключением генома Aeromonas salmonicida ABM14). Геномы Aeromonas salmonicida ABM14 и Yersinia kristensinii 2guk также располагают генами эффлюкс-помп (MFS, MacA, MacB), обеспечивающих устойчивость к антибиотикам тетрациклинового ряда.
Таблица 1. Характеристика изученных штаммов арктических бактерий
Table 1. Characteristics of the studied strains of Arctic bacteria
|
№ |
Видовая принадлежность / Species |
Обозначение штамма / Strain designation |
Источник биоматериала / Source of biologic material |
|
1 |
Serratia fonticola |
Vf_lemm |
Субстрат нор в колонии узкочерепных полевок (Lasiopodomys gregalis) на острове Вайгач вблизи поселка Варнек (N69.72846° E60.12616°) / Burrow substrate in a colony of voles (Lasiopodomys gregalis) on the Vaygach island near the village of Varnek (N69.72846° E60.12616°) |
|
2 |
Aeromonas salmonicida |
ABM14 |
Цианобактериальные маты на литорали небольшого посещаемого птицами (куликами и гусями) озера в точке с координатами N76.20635° E62.70910°, остров Северный, Новая Земля / Cyanobacterial mats on the littoral of a small lake visited by birds (waders and geese) at coordinates N76.20635° E62.70910°, Severny Island, Novaya Zemlya |
|
3 |
Yersinia kristensenii |
2guk |
Фекалии белого медведя в районе полярной станции Бухта Тихая (остров Гукера, архипелаг Земля Франца-Иосифа, N 80.20281 E 52.48093) / Polar bear feces in the area of the Tikhaya Bay polar station (Hooker Island, Franz Josef Land Archipelago, N 80.20281 E 52.48093) |
|
4 |
Yersinia rochesterensis |
12bell |
Фекалии птиц (отряд гусеобразные) в южной части острова Белл (архипелаг Земля Франца-Иосифа) в точке с координатами N79.99139° E49.23627° / Feces of goose-like birds in the southern part of Bell Island (Franz Josef Land) at the point with coordinates N79.99139° E49.23627° |
Таблица 2. Характеристики секвенированных геномов
Table 2. Characteristics of the sequenced genomes
|
Секвенированный штамм / Sequenced strain |
Размер генома (Mb) / Genome size (Mb) |
% содержание GC / GC content, % |
Факторы патогенности / Pathogenicity factors |
Детерминанты устойчивости к антибиотикам / Determinants of antibiotic resistance |
Номер доступа в GenBank / GenBank Accession number |
|
Serratia fonticola Vf_lemm |
6,3 |
53 |
Термостабильный гемолизин, гены системы секреции T6SS / Thermostable hemolysin, genes of the T6SS secretion system |
blaFONA ген бета-лактамазы класса A, ген резистентности к хинолонам QnrB10 / class A β-lactamase blaFONA gene, quinolone resistance QnrB10 gene |
JAVIGA010000000 |
|
Aeromonas salmonicida ABM14 |
4,8 |
58,5 |
Hcp (гемолизин) эффекторный протеин T6SS Оперон токсин-агглютининов RTX, кластер генов пилей IV-го типа цитолизин-гемолизин HlyA, формирующий поры цитолизин (вибриолизин), коллагеназа / Hcp (hemolysin) effector protein T6SS, RTX toxin-agglutinin operon, cluster of pileus genes of type IV, cytolysin-hemolysin HlyA, pore-forming cytolysin (vibriolysin), collagenase |
Бета-лактамазы субкласса B2 ChpA Ген эффлюкса макролидных антибиотиков MacA Бета-лактамаза класса D / Beta-lactamases of the B2 ChpA subclass Macrolide antibiotic efflux gene MacA Class D β-lactamase |
JAVCZK010000000 |
|
Yersinia kristensenii 2guk |
4,7 |
47,5 |
Гены сидерофоров энтеробактинового, петрибактинового и аэробактинового кластеров, гены белков секреции 6-го типа, пили 4-го типа, гены гемолизинов ShlB/FhaC/HecB семейства и фосфолипазы С, ген инвазина inv, ген энтеротоксина ytx, сходного с пертактином Bordetella pertussis / Enterobactin, petribactin and aerobactin cluster siderophore genes, type VI secretion protein genes, type IV pili, ShlB/FhaC/HecB family hemolysin genes and phospholipase C, invazin gene, enterotoxin ytx gene similar to Bordetella pertussis pertactin |
Гены устойчивости к хинолонам (QnrB10) и макролидам (MFS, MacA, MacB), ген сериновой бета-лактамазы класса С / Quinolone (QnrB10) and macrolide (MFS, MacA, MacB) resistance genes, class C serine β-lactamase gene |
JAVIYH010000000 |
|
Yersinia rochesterensis 12bell |
4,3 |
47 |
Гены сидерофоров энтеробактинового, и аэробактинового кластеров, гены белков секреции 6-го типа, ген энтеротоксина ytx, сходного с пертактином Bordetella pertussis / Enterobactin and aerobactin cluster siderophore genes, type VI secretion protein genes, ytx enterotoxin gene similar to Bordetella pertussis pertactin |
Ген устойчивости к хинолонам n QnrB10 ampC – подобная беталактамаза класса С / Quinolone resistance gene n QnrB10 ampC–like Class C betalactamase |
AVIYI000000000.1 |
Обсуждение. При оценке эпидемического потенциала выделенных бактерий мы исходили из понимания этого показателя как совокупности свойств микроорганизма, определяющих способность вызывать эпидемический процесс [9]. С этой точки зрения мы можем оценить изученные штаммы условно-патогенных бактерий как обладающие выраженным эпидемическим потенциалом, что подтверждается наличием в их геномах генов вирулентности и устойчивости к антибиотикам.
Так, например, в геноме Aeromonas salmonicida ABM14 обнаружен оперон синтеза RTX — токсина, экспрессия которого, судя по проведенным ранее исследованиям [10], способна индуцировать апоптоз эпителиальных клеток хозяина, что в совокупности с наличием в геноме данного штамма эластазы (фермента, способного ингибировать фагоцитоз [11]) может обеспечить инвазию патогена в ткани организма теплокровного хозяина и генерализацию инфекции.
Примечательно также обнаружение энтеротоксина YtxA, относящегося к группе токсинов коклюшного типа AB5, в геномах Yersinia kristensenii 2 guk и Yersinia rochesterensis 12bell. Представители данной группы токсинов, как было установлено ранее [9], получили распространение в популяциях патогенных энтеробактерий, в частности энтеропатогенных эшерихий и сальмонелл.
Обнаруженный в геноме Yersinia kristensenii 2 guk ген инвазина inv, известен как ген вирулентности, обеспечивающий повреждение клеток кишечного эпителия животных [13].
В геноме Serratia fonticola Vf_lemm идентифицирован ген hcp. Пептиды, продуцируемые гомологами этого гена у патогенных иерсиний, участвуют в аутоаггрегации клеток [14], а у сальмонелл его гомологи являются факторами патогенности [15].
Резистом изученных бактерий не содержит критически значимых для общественного здравоохранения детерминант множественной лекарственной устойчивости, однако наличие генов беталактамаз различных классов и эффлюксных помп может обеспечить им постепенную адаптацию к существованию в экосистемах с умеренной концентрацией антибиотиков в урбанизированных и сельскохозяйственных биогеоценозах и специфической госпитальной среде.
Несмотря на то, что выявление на арктических территориях психрофильных представителей семейства Yersiniaceae, а также обнаружение в прибрежных биотопах Aeromonas salmonicida (возбудителя заболеваний рыб [16]), является, в целом ожидаемым, по нашему мнению, важен факт обнаружения штаммов, обладающих патогенным потенциалом и детерминантами резистентности из образцов биоматериала, ассоциированного с перелетными птицами и из проб, связанных с животными – аборигенами арктических островов и побережий.
Как предполагается, появление устойчивых к антибиотикам бактерий в природной среде Арктики, является результатом как мобилизации аутохтонного резистома, так и антропогенного загрязнения [17–19]. Наряду с этим, в распространение антибиотикорезистентных бактерий существенный вклад вносят мигрирующие животные, часть которых (дальнеперелетные птицы) выполняют функцию векторов переноса детерминант антибиотикорезистентности на большие расстояния. При этом северные олени, например, могут быть использованы в качестве индикаторов распространенности антибиотикорезистентных микроорганизмов в арктических экосистемах [20].
Примечателен факт обнаружения штамма условно-патогенной бактерии Yersinia kristensenii в составе микробиома белого медведя (Ursus maritimus) в образце с острова Гукера (Земля Франца-Иосифа). Известно, что белые медведи баренцевоморской субпопуляции (из карско-баренцевоморской популяции), которые встречаются на островах Земли Франца-Иосифа, ведут оседло-кочевой образ жизни и могут заходить в восточные районы Шпицбергена [21]. Таким образом, белые медведи тоже могут участвовать в распространении патогенов на обширных арктических территориях, а природные очаги, образованные этими животными, вероятно, не имеют четких границ и ограничены диапазоном их сезонных миграций. Положение белого медведя на вершине трофической цепи в арктической экосистеме, его высокая мобильность, а также присутствие этого хищника в антропогенно-измененных биотопах вблизи полярных станций и поселений позволяет использовать его кишечный микробиом в качестве индикатора интродукции антибиотикорезистентных бактерий, включая и возбудителей зоонозов. В недавнем исследовании отмечалось, что «следы» антропогенного воздействия присутствуют в виде изменений структуры микробиома белых медведей [22].
Выделение двух представителей семейства Yersiniaceae в одинаковых и экстремальных климатогеографических условиях – Yersinia kristensenii и Yersinia rochesterensis – требует отдельного рассмотрения и осмысления. Сам род Yersinia на июнь 2021 года включают 26 видов иерсиний. Причем в последние десятилетия он прирастает новыми видами благодаря молекулярно-генетическим исследованиям ранее обнаруженных классическими бактериологическими методами видов иерсиний. Таким примером является выделение из вида Yersinia kristensenii новых видов, в том числе и описанного в данной статье Yersinia rochesterensis [23].
Учитывая психрофильные свойства семейства Yersiniaceae и многочисленные находки иерсиний в высоких широтах, целесообразен поиск этих бактерий с широким привлечением внимания научно-практических специалистов к так называемым «игнорируемым» видам Yersinia enterocolitica-like bacteria, многие из которых являются возбудителями сапрозоонозов [24][25].
Заключение. В результате проведенных исследований получены данные, подтверждающие возможность циркуляции условно-патогенных бактерий, обладающих генами вирулентности, антибиотикорезистентности и определенным эпидемическим потенциалом в природных экосистемах арктических островов, включая высокоширотные территории с суровыми природно-климатическими условиями, в частности, впервые описаны штаммы иерсиний с островов архипелага Земля Франца-Иосифа.
Активное развитие познавательного туризма и освоение природной среды Арктики с ее стратегическим экономическим потенциалом предполагает учет возможности функционирования на арктических островах специфических природных очагов зоонозных инфекций, поддерживаемых мигрирующими представителями орнитофауны и териофауны.
Список литературы
1. Alsamara I, Ogilvie L, Sudbrak R, Brand A. One Health lens for antimicrobial resistance research and funding: A systematic review. OMICS. 2023;27(12):570-580. doi: 10.1089/omi.2023.0049
2. McEwen SA, Collignon PJ. Antimicrobial Resistance: A One Health Perspective. Microbiol Spectr. 2018;6(2). doi: 10.1128/microbiolspec.ARBA-0009-2017
3. Panda S, Bhargava B, Gupte MD. One World One Health: Widening horizons. Indian J Med Res. 2021;153(3):241- 243. doi: 10.4103/ijmr.ijmr_1056_21
4. Naddeo V. One planet, one health, one future: The environmental perspective. Water Environ Res. 2021;93(9):14721475. doi: 10.1002/wer.1624
5. Коренберг Э.И. Природная очаговость инфекций: современные проблемы и перспективы исследований // Зоологический журнал. 2010. Т. 89, № 1. С. 5–17.
6. Deviatkin AA, Vakulenko YA, Dashian MA, Lukashetv AA. Evaluating the impact of anthropogenic factors on the dissemination of contemporary cosmopolitan, Arctic, and Arctic-like rabies viruses. Viruses. 2021;14(71):66. doi: 10.3390/v14010066
7. Gass JD Jr, Kellogg HK, Hill NJ, Puryear WB, Nutter FB, Runstadler JA. Epidemiology and ecology of influenza A viruses among wildlife in the Arctic. Viruses. 2022;14(7):e1531. doi: 10.3390/v14071531
8. Liskova EA, Egorova IY, Selyaninov YO, et al. Reindeer anthrax in the Russian Arctic, 2016: Climatic determinants of the outbreak and vaccination effectiveness. Front Vet Sci. 2021;8:e668420. doi: 10.3389/fvets.2021.668420
9. Bettencourt LMA, Ribeiro RM. Real time Baysian estimation of the epidemic potential of emerging infectious diseases. PloS One. 2008;3(5):e2185. doi: 10.1371/journal. pone.0002185
10. Suarez G, Khajanchi BK, Sierra JC, Erova TE, Sha J, Chopra AK. Actin cross-linking domain of Aeromonas hydrophila repeat in toxin A (RtxA) induces host cell rounding and apoptosis. Gene. 2012;506(2):369-376. doi: 10.1016/j. gene.2012.07.012
11. Faure E, Kwong K., Nguyen D. Pseudomonas aeruginosa in chronic lung infections: How to adapt within the host? Front Immunol. 2018;9:2416. doi: 10.3389/fimmu.2018.02416
12. Littler DR, Ang SY, Moriel DG, et al. Structure-function analyses of a pertussis-like toxin from pathogenic Escherichia coli reveal a distinct mechanism of inhibition of trimeric G-proteins. J Biol Chem. 2017;292(36):1514315158. doi: 10.1074/jbc.M117.796094
13. Young VB, Miller VL, Falkow S, Schoolnik GK. Sequence, localization and function of the invasion protein of Yersinia enterocolitica. Mol Microbiol. 1990;4(7):1119-1128. doi: 10.1111/j.1365-2958.1990.tb00686.x
14. Podladchikova O, Antonenka U, Heesemann J, Rakin A. Yersinia pestis autoagglutination factor is a component of the type six secretion system. Int J Med Microbiol. 2011;301(7):562-569. doi: 10.1016/j.ijmm.2011.03.004
15. Wang P, Dong JF, Li RQ, Li L, Zou QH. Roles of the Hcp family proteins in the pathogenicity of Salmonella typhimurium 14028s. Virulence. 2020; 11(1):1716-1726. doi: 10.1080/21505594.2020.1854538
16. Dallaire-Dufresne S, Tanaka KH, Trudel MV, Lafaille A, Charette SJ. Virulence, genomic features, and plasticity of Aeromonas salmonicida subsp. salmonicida, the causative agent of fish furunculosis. Vet Microbiol. 2014;169(1-2):1- 7. doi: 10.1016/j.vetmic.2013.06.025
17. Hernández J, González-Acuña D. Anthropogenic antibiotic resistance genes mobilization to the polar regions. Infect Ecol Epidemiol. 2016;6:e32112. doi: 10.3402/iee.v6.32112
18. Tan L, Li L, Ashbolt N, Wang X. et al. Arctic antibiotic resistance gene contamination, a result of anthropogenic activities and natural origin. Sci Total Environ. 2018 Apr 15;621:1176-1184. doi: 10.1016/j.scitotenv.2017.10.110
19. Haan TJ, Drown DM. Unearthing Antibiotic Resistance Associated with Disturbance-Induced Permafrost Thaw in Interior Alaska. Microorganisms. 2021;9(1):e116. doi: 10.3390/microorganisms9010116
20. Sunde M, Ramstad SN, Rudi K, et al. Plasmid-associated antimicrobial resistance and virulence genes in Escherichia coli in a high arctic reindeer subspecies. J Glob Antimicrob Resist. 2021; 26: 317-322. doi: 10.1016/j.jgar.2021.06.003
21. Гаврило М.В., Мартынова Д.М. Сохранение редких видов морской фауны и флоры, занесенных в Красную книгу Российской Федерации и Красный список МСОП, в национальном парке «Русская Арктика» // Nature Conservation Research. Заповедная наука. 2017. Т. 2 (S1). С. 10–42. doi: 10.24189/ncr.2017.017
22. Vecherskii MV, Kuznetsova TA, Khayrullin DR, et al. Anthropogenic neighborhood impact on bacterial and fungal communities in polar bear feces. Animals (Basel). 2023;13(13):2067. doi: 10.3390/ani13132067
23. Nguyen SV, Cunningham SA, Jeraldo P, Tran A, Patel R. Yersinia occitanica is a later heterotypic synonym of Yersinia kristensenii subsp. rochesterensis and elevation of Yersinia kristensenii subsp. rochesterensis to species status. International Journal of Systematic Evol Microbiol Bacteriology. 2021;71(2):004626. doi: 10.1099/ijsem.0.004626
24. Панин А.Л. Микробиологический мониторинг возбудителей сапрозоонозов в полярных регионах: дис. ... канд. мед. наук. Москва, 2023. Доступно по: https://www.rudn.ru/storage/media/science_dissertation/9fb83289-26d1-4a 4b-a31a-3a4bf616380a/panin-dissertaciya-100423.pdf. Ссылка активна на 28.06.2024.
25. Virdi JS, Sachdeva P. Molecular heterogeneity in Yersinia enterocolitica and Y. enterocolitica-like' species – Implications for epidemiology, typing and taxonomy. FEMS Immunol Med Microbiol. 2005;45(1):1-10. doi: 10.1016/j. femsim.2005.03.006
Об авторах
Б. И. АслановРоссия
Асланов Батырбек Исмелович - д.м.н., заведующий кафедрой эпидемиологии, паразитологии и дезинфектологии; заведующий НИЛ
молекулярной эпидемиологии и исследований бактериофагов
г. Санкт-Петербург, ул. Кирочная, д. 41, 191015
А. Е. Гончаров
Россия
Гончаров Артемий Евгеньевич - д.м.н., заведующий лабораторией функциональной геномики и протеомики микроорганизмов
г. Санкт-Петербург, ул. Кирочная, д. 41, 191015; ул. Академика Павлова, д. 12, Санкт-Петербург, 197022
Д. В. Азаров
Россия
Азаров Даниил Валерьевич - к.м.н., с.н.с. НИЛ молекулярной эпидемиологии и исследований бактериофагов; , н.с. лаборатории
функциональной геномики и протеомики микроорганизмов
г. Санкт-Петербург, ул. Кирочная, д. 41, 191015; ул. Академика Павлова, д. 12, Санкт-Петербург, 197022
А. Н. Трофимова
Россия
Трофимова Анна Николаевна - заместитель начальника экспедиционного отряда по научной работе экспедиции «Арктический плавучий университет»
набережная Северной Двины, д. 17, г. Архангельск, 163002
А. С. Аксенов
Россия
Аксенов Андрей Сергеевич - к.т.н., профессор кафедры биологии, экологии и биотехнологии, зав. сектором лаборатории арктического биомониторинга
набережная Северной Двины, д. 17, г. Архангельск, 163002
И. А. Мизин
Россия
Мизин Иван Андреевич - к.б.н., старший научный сотрудник лаборатории биоресурсов и этнографии
просп. Никольский, д. 20, г. Архангельск, 163020
В. В. Колоджиева
Россия
Колоджиева Виктория Васильевна - к.м.н., доцент кафедры эпидемиологии, паразитологии и дезинфектологии
г. Санкт-Петербург, ул. Кирочная, д. 41, 191015
Д. А. Кушниренко
Россия
Кушниренко Дарья Александровна - лаборант лаборатории инновационных методов микробиологического мониторинга научно-образовательного центра научного центра мирового уровня Центр персонализированной медицины
ул. Академика Павлова, д. 12, Санкт-Петербург, 197022,
Л. А. Краева
Россия
Краева Людмила Александровна - д.м.н., заведующая лабораторией медицинской бактериологии
Санкт-Петербург, ул. Мира, д. 14, 197101
А. Л. Панин
Россия
Панин Александр Леонидович - к.м.н., главный специалист по медицинской логистике Логистического центра Российской
антарктической экспедиции
ул. Беринга, д. 38, 199397, г. Санкт-Петербург
В. А. Крыленков
Россия
Крыленков Вячеслав Александрович - д.б.н., руководитель центра мониторинга полярных регионов
Университетская наб., д. 5, г. Санкт-Петербург, 199034
Дополнительные файлы
Рецензия
Для цитирования:
Асланов Б.И., Гончаров А.Е., Азаров Д.В., Трофимова А.Н., Аксенов А.С., Мизин И.А., Колоджиева В.В., Кушниренко Д.А., Краева Л.А., Панин А.Л., Крыленков В.А. Характеристики геномов условно-патогенных бактерий зоогенных экосистем островов Западной Арктики. Здоровье населения и среда обитания – ЗНиСО. 2024;32(6):81-88. https://doi.org/10.35627/2219-5238/2024-32-6-81-88
For citation:
Aslanov B.I., Goncharov A.E., Azarov D.V., Trofimova A.N., Aksenov A.S., Mizin I.A., Kolodzhieva V.V., Kushnirenko D.A., Kraeva L.A., Panin A.L., Krylenkov V.A. Characteristics of genomes of opportunistic bacteria in zoogenic ecosystems of the Russian Western Arctic Islands. Public Health and Life Environment – PH&LE. 2024;32(6):81-88. (In Russ.) https://doi.org/10.35627/2219-5238/2024-32-6-81-88









.png)



























