Перейти к:
Влияние гиперлипидемического рациона питания на метаболом крови у крыс: результаты пилотного эксперимента
https://doi.org/10.35627/2219-5238/2024-32-1-58-66
Аннотация
Введение. Нарушение сбалансированности питания и преобладание в нем липидных и углеводных компонентов приводит к поражению сосудов и, как следствие, сердечно-сосудистым заболеваниям, которые являются ведущей причиной смерти людей во всем мире. Метаболомный скрининг может предсказать наличие заболевания на ранних стадиях и помочь в отслеживании эффективности лечения.
Цель: проведение предварительного исследования в рамках моделирования гиперлипидемии и гиперхолестеринемии in vivo для изучения изменений метаболома крови крыс и поиск новых биомаркеров атеросклеротического поражения сосудов.
Материалы и методы. В исследовании принимали участие 30 самцов белых крыс, разделенных на две группы: опытная группа (n = 15) и контроль (n = 15). Моделирование атеросклероза приводилось посредством рациона с избытком простых сахаров, жира и холестерина вкупе с фармакологическим воздействием, которое заключалось в индукции гипотиреоза в сочетании с токсической дозой витамина D. Метаболомное профилирование крови проводилось с помощью жидкостной тандемной хроматомасс-спектрометрии.
Результаты. В результате эксперимента с комплексным in vivo моделированием гиперлипидемии в опытной группе было обнаружено снижение уровня от 1,3 до 1,8 раза для ацилкарнитинов, производных индола в 1,4 и 2 раза и жирных кислот в 3,5 и 3,9 раза, повышение наблюдалось для офтальмата в 1,8 раза, стерола в 2,2 раза и гликохолевой кислоты в 5,6 раза, тогда как для глицерофосфолипидов были характерны разнонаправленные изменения с кратностью от 1,2 до 1,9.
Заключение. В результате поставленного эксперимента были получены данные, относящиеся к различным аспектам заболевания: гиперлипидемии, воспаления, окислительного стресса, реологии крови и массы тела животных. В результате метаболомного профилирования найдены потенциальные молекулярные биомаркеры патологических процессов.
Ключевые слова
Для цитирования:
Унесихина М.С., Чемезов А.И., Бушуева Т.В., Сутункова М.П. Влияние гиперлипидемического рациона питания на метаболом крови у крыс: результаты пилотного эксперимента. Здоровье населения и среда обитания – ЗНиСО. 2024;32(1):58-66. https://doi.org/10.35627/2219-5238/2024-32-1-58-66
For citation:
Unesikhina M.S., Chemezov A.I., Bushueva T.V., Sutunkova M.P. Effects of the hyperlipidemic diet on the rat blood metabolome: Pilot study results. Public Health and Life Environment – PH&LE. 2024;32(1):58-66. (In Russ.) https://doi.org/10.35627/2219-5238/2024-32-1-58-66
Введение. Трудно переоценить актуальность работ, связанных с изучением сердечно-сосудистых заболеваний (ССЗ), которые занимают первое место среди причин смертности населения во всем мире уже долгие годы [1]. Изменение образа жизни людей за последнее время привело к увеличению заболеваемости ожирением, гипертонией и диабетом, что повышает риск сердечно-сосудистых заболеваний (ССЗ) [2]. В осложнении большинства уже имеющихся ССЗ играет роль наличие в организме атеросклеротического поражения сосудов, результатом которого является инфильтрация эндотелия сосудов липидами, воспаление, образование пенистых клеток и некротического ядра, повышенное тромбообразование, что впоследствии может закончиться разрывом фиброзной оболочки бляшки и закупоркой сосудов.
В период ранней стадии образования атеросклеротического поражения, которая происходит бессимптомно, сложно обнаружить патологические изменения, однако изучение метаболомного профиля крови, который отражает даже незначительные изменения в обмене веществ во время протекающих патологических процессов, может помочь в предсказании наличия заболевания на ранних стадиях и предотвратить возможные последствия и осложнения.
Авторами работы ранее был проведен литературный обзор, в котором изучался вопрос молекулярных механизмов атеросклероза и был описан предполагаемый перечень метаболитов-биомаркеров заболевания, который охватывает многие процессы обмена веществ, потенциально сигнализирующих о развитии поражения сосудов [3].
Цель: проведение предварительного исследования в рамках моделирования гиперлипидемии и гиперхолестеринемии in vivo для изучения изменений метаболома крови крыс и поиск новых биомаркеров атеросклеротического поражения сосудов.
Материалы и методы
Животные, индуцирование атеросклероза и сбор образцов. В эксперименте были использованы аутбредные крысы, рожденные в марте 2022 года. Исследование проводилось с мая по август 2022 года, для него было отобрано 30 самцов белых крыс в возрасте 6–7 недель с массой тела 240–250 г, из которых составили две группы: опытную (n = 15) и контрольную (n = 15). Моделирование атеросклероза у крыс опытной группы проводилось посредством гиперлипидемического рациона питания, состоящего из 72,95 % стандартного корма, 12 % свиного жира, 5 % сахара и 10 % яичного порошка с фармакологическим воздействием 0,05 % Тиамазола, на 15-й день эксперимента животным в течение 2 дней с кормом вводилось по 90 000 МЕ витамина D3. Крыс из контрольной группы на протяжении всего эксперимента кормили стандартным рационом. Через 7 недель с забором крови из эксперимента была выведена часть животных опытной (n = 8) и контрольной (n = 10) групп, после 11 недель оставшиеся животные были выведены из эксперимента. Цельная кровь хранилась при –80 °С до анализа.
Дизайн эксперимента на животных составлен с учетом современных требований биоэтики и был одобрен Локальным этическим комитетом ФБУН ЕМНЦ ПОЗРПП Роспотребнадзора (Протокол № 1/1 от 09.06.2022).
Пробоподготовка. Перед анализом образцы крови размораживали при комнатной температуре. Депротеинизация проводилась добавлением 600 мкл метанола к 200 мкл плазмы с последующим перемешиванием в течение 30 секунд. Далее пробы инкубировали в течение 15 минут при 4 °С и центрифугировали 15 минут на 14 000 об/мин при 4 °С. 50 мкл супернатанта отбирали для УВЭЖХ-МС анализа. Анализ проб с концентрированием проводили с использованием 200 мкл супернатанта, которые упаривали при комнатной температуре в течение 3 часов в вакуумном концентраторе, после чего сухой остаток перерастворили в 50 мкл смеси ацетонитрил/вода (3:1) c 0,1 % муравьиной кислотой при перемешивании и воздействии ультразвука. Далее проводили центрифугирование 15 минут на 14 000 об./мин при 4 °С, супернатант отбирали для УВЭЖХ-МС анализа.
Анализ сыворотки на холестерин липопротеинов низкой плотности (ХС-ЛПНП), ХС липопротеинов высокой плотности (ХС-ЛПВП), триглицериды (ТГ) и общий ХС проводили на автоматическом анализаторе с использованием коммерческих наборов.
Хроматографическое разделение. Для хроматографирования использовали систему ультравысокоэффективной жидкостной хроматографии (УВЭЖХ) Agilent 1290 Infinity II с масс-спектрометрическим детектором Agilent 6545XT AdvanceBio Q-TOF. Разделение проводилось на колонке InfinityLab Poroshell 120 EC-C18 2,1 × 100 мм зернением 1,9 мкм со скоростью потока 0,4 мл/мин при температуре колонки 35 °С. Подвижная фаза состояла из воды с 0,1 % муравьиной кислотой (фаза А) и ацетонитрила с 0,1 % муравьиной кислотой (фаза Б) со следующими параметрами элюирования: 0–5 мин – 5 % (Б), 5–23 мин – от 5 до 100 % (Б), 23–29 мин – 100 % (Б), 29–30 мин – от 100 до 5 % (Б), 30–35 мин – 5 % (Б). Объем пробы – 5 мкл.
Масс-спектрометрия. Масс-спектрометрическое детектирование осуществлялось в положительном режиме ионизации на тандемном квадруполь-времяпролетном масс-спектрометре с электрораспылением. Диапазон сканирования составлял 20–1000 m/z с частотой съемки 1 спектр в секунду. Данные собирали с помощью программного обеспечения (ПО) Agilent MassHunter Data Acquisition. С целью аннотации соединений проводили МС/МС эксперимент для получения фрагментных спектров с энергией столкновения 0, 10 и 20 V. Обработку полученных данных проводили в ПО Agilent MassHunter Workflow и Agilent MassHunter Navigator.
Аннотацию метаболитов проводили по точной моноизотопной массе (ppm ˂ 10), изотопному распределению пиков и подтверждению спектра фрагментации по библиотекам спектров Human Metabolome Database (HMDB)1 и LIPID MAPS2 в ручном режиме.
Статистический анализ. Метаболомные данные анализировались в ПО Mass Profiler Professional c помощью t-критерия Стьюдента, значимыми принимали изменения с p ˂ 0,05 и кратностью изменения сигнала FC ˃ 1. Статистическая обработка остального материала проводилась с помощью ПО IBM SPSS Statistics 23 по непараметрическому критерию Манна – Уитни с уровнем значимости p ˂ 0,05.
Результаты
Метаболомное профилирование крови. Среди метаболитов, которые изменили содержание в течение эксперимента, фигурируют глицерофосфолипиды, жирные кислоты, ацилкарнитины, желчная кислота, стерол, олигопептид и производные идола. На 7-й неделе эксперимента удалось зафиксировать изменения в уровне содержания 16 метаболитов, на 11-й неделе эксперимента снизилось содержание еще двух ацилкарнитинов и двух окисленных фосфатидилхолинов (РС) (см. табл. 1).
Таблица 1. Метаболиты, изменившие свое содержание в крови во время эксперимента
Table 1. Metabolites, the blood level of which changed during the experiment
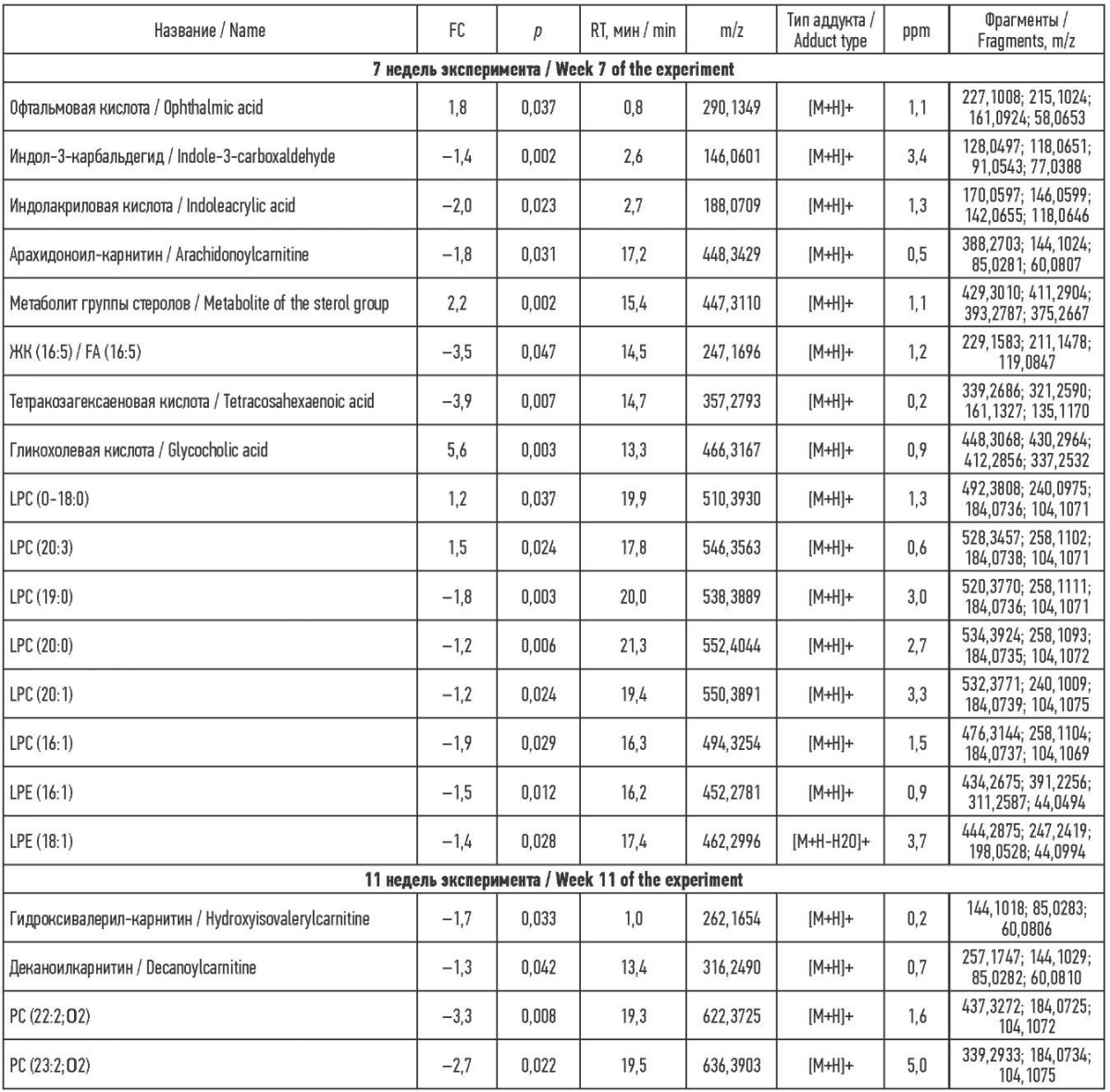
Примечания и сокращения: FC (fold change) – кратность изменения
сигнала метаболита относительно контрольной группы;
p – значение рассчитано с помощью t-критерия с уровнем значимости p ˂ 0,05;
RT (retention time) – время удерживания молекулы на колонке;
m/z – отношение массы к заряду молекулы;
ppm – ошибка измерения массы молекулы;
ЖК – жирная кислота; LPC – лизофосфатидилхолин;
LPE – лизофосфатидилэтаноламин; PC – фосфатидилхолин.
Notes and abbreviations: FC, a fold change
in the metabolite signal relative to the control group;
p – value calculated using a t-criterion with a significance level at p ˂ 0.05;
RT, retention time of the molecule on the column;
m/z, mass to charge ratio of the molecule;
ppm, the error of measuring the mass of the molecule;
FA, fatty acid; LPC, lysophosphatidylcholine;
LPE, lysophosphatidylethanolamine; PC, phosphatidylcholine.
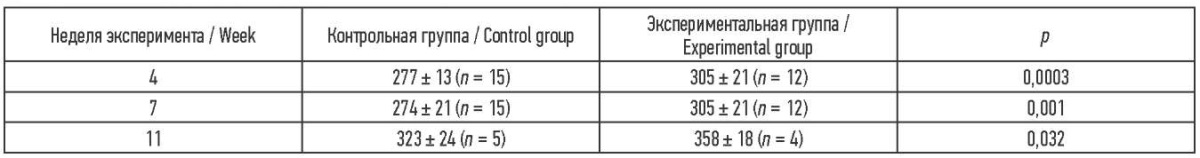
Масса животных. По мере увеличения длительности эксперимента вес животных опытной группы увеличивался (табл. 2) и статистически значимо отличался от веса животных контрольной группы (p ˂ 0,05).
Таблица 2. Масса тела животных на разных сроках эксперимента
Table 2. Table 2. Body weight of animals at different weeks of the experiment
Исследование липидного спектра сыворотки крови. У животных на выбранном рационе питания наблюдали повышение показателей липидного профиля относительно животных контрольной группы (см. рис.) с уровнем значимости p ˂ 0,05.
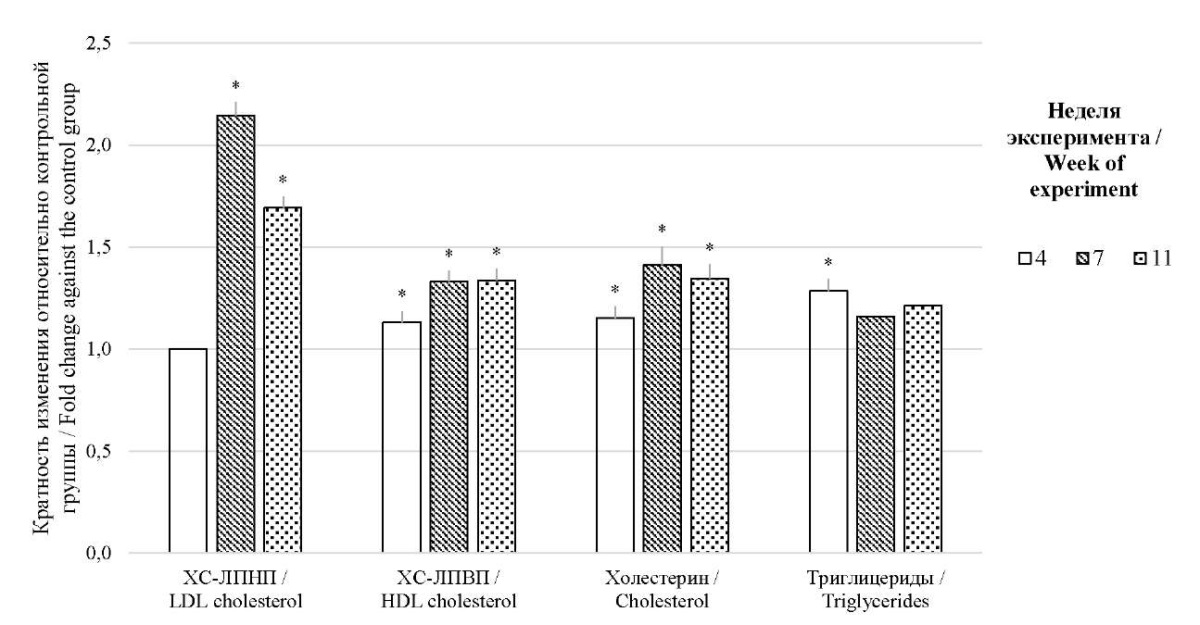
Рисунок. Липидный спектр сыворотки животных на разных сроках эксперимента
Figure. Lipid spectrum of the animal blood serum at different weeks of the experiment
Исследование липидного спектра сыворотки крови. У животных на выбранном рационе питания наблюдали повышение показателей липидного профиля относительно животных контрольной группы (см. рис.) с уровнем значимости p ˂ 0,05.
Общий анализ крови. В эксперименте имело место изменение 15 из 20 измеряемых показателей крови (см. табл. 3), данные приведены для показателей, имеющих статистически достоверные различия между группами с уровнем значимости p ˂ 0,05. После 11 недель опытная группа отличалась от контрольной лишь по увеличению индекса распределения эритроцитов (RDW-SD) с р = 0,016 (данные не представлены).
Таблица 3. Масса тела животных на разных сроках эксперимента
Table 3. Complete blood count results in the rats at different weeks of the experiment
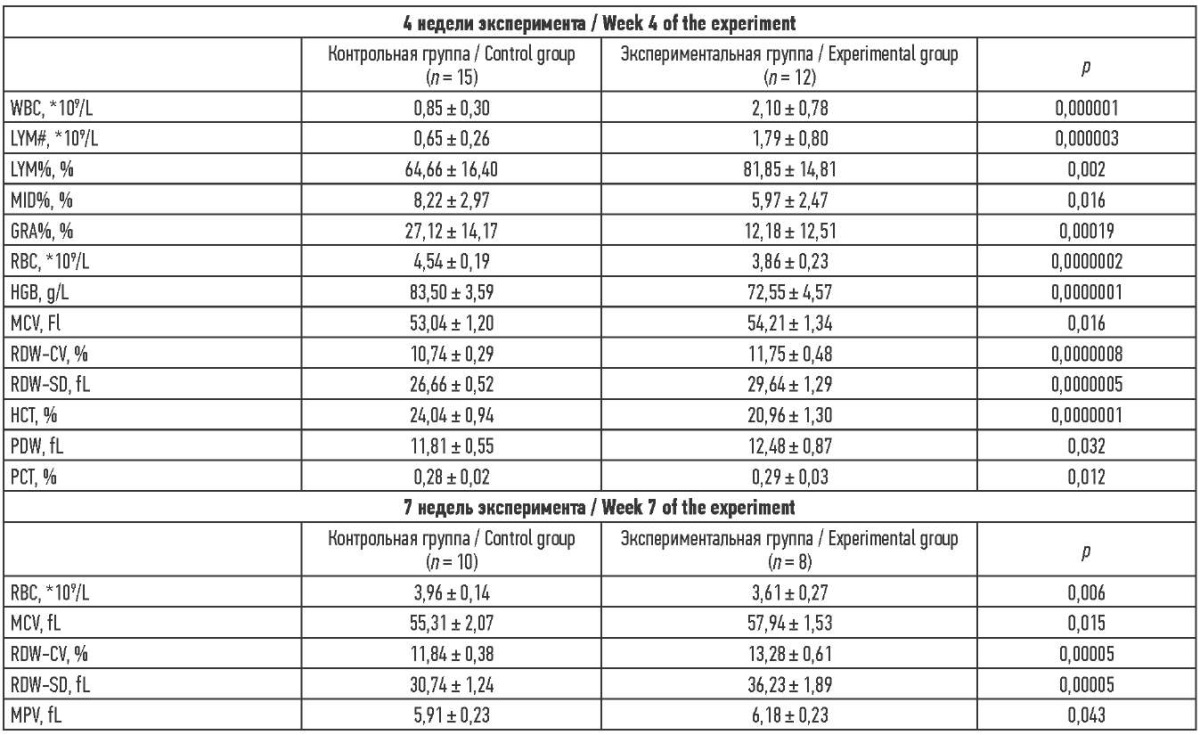
Примечания и сокращения: WBC – лейкоциты; LYM – лимфоциты;
MID – моноциты, эозинофилы, базофилы и их предшественники;
GRA – гранулоциты; RBC – эритроциты; HGB – гемоглобин;
MCV – средний объем эритроцитов;
RDW – индекс распределения эритроцитов; HCT – гематокрит;
PDW – индекс распределения тромбоцитов; PCT – тромбокрит;
MPV – средний объем тромбоцитов; fL – фемтолитр; g/L – г/л.
Notes and abbreviations: WBC, white blood cells; LYM, lymphocytes;
MID, monocytes, eosinophils, basophils and their precursors;
GRA, granulocytes; RBC, erythrocytes; HGB, hemoglobin;
MCV, mean corpuscular volume; RDW, red blood cell distribution width;
HCT, hematocrit; PDW, platelet distribution width; PCT, thrombocrit;
MPV, mean platelet volume; fL, femtoliter.
Обсуждение. В связи с тем что у крыс отсутствует белок переноса холестеринового эфира (CETP), ЛПВП являются основными переносчиками холестерина (ХС) в плазме, в результате чего крысы устойчивы к атеросклерозу как вид и, как правило, гипочувствительны к чистому диетическому ХС. Поэтому гиперлипидемию и атерогенез у крыс можно индуцировать рационом с высоким содержанием ХС, жиров, холевой кислоты и гипотиреоидными лекарственными препаратами. В качестве антитиреоидного препарата был выбран Тиамазол, который снижает содержание тиреоидных гормонов в крови: в норме данные вещества стимулируют экспрессию рецепторов ЛПНП в печени за счет белков, связывающих стерол-регулирующие элементы (SREBP-2), либо напрямую. Гипотиреоз же приводит к снижению количества рецепторов ЛПНП и, как следствие, снижению их захвата, а значит, увеличению содержания в крови общего ХС и ХС-ЛПНП [4][5].
Также для индуцирования атеросклероза у крыс рацион дополняется перорально вводимыми избыточными дозами витамина D, гипервитаминоз которого, совместно с гиперхолестеринемическим рационом, является артериотоксичным и может вызывать кальцификацию сосудов [6]. У всех животных присутствовали симптомы гипервитаминоза, среди которых были вялость, апатичность, потеря аппетита. Три крысы были выведены из эксперимента на третий день после приема витамина D, остальные восстановились в течение нескольких суток.
Гипергликемия может ускорить формирование атеросклеротического поражения [7]. Эндотелий особенно чувствителен к изменениям концентрации глюкозы. Гликозилирование белков и липидов нарушает их конформацию и нормальную функцию, как упоминалось нами ранее [3]. Воздействие гипергликемии наиболее выражено в присутствии воспалительной среды и гиперлипидемии.
Представленные результаты свидетельствуют о том, что кормление крыс выбранным рационом с повышенным содержанием жиров и углеводов вызывает изменение биохимических и гематологических показателей, массы тела животных, а также метаболомного профиля крови.
Именно на основании полученных результатов эксперимента мы полагаем, что к моменту завершения эксперимента животные находились в состоянии начальной стадии атеросклероза, когда еще не все системы гемо- и гомеостаза подверглись изменениям, а эндотелий, вероятно, еще не подвергся инфильтрации макрофагами. В связи с этим мы считаем, что обнаруженные нами метаболиты можно отнести к ранним маркерами атеросклеротического поражения сосудов. Содержание некоторых метаболитов противоречит литературным данным и предполагаемым в нашем литературном обзоре изменениям [3]. Возможно, это связано именно с тем, что они являются биомаркерами начальной метаболической перестройки в ответ на развивающуюся гиперлипидемию.
Офтальмовая кислота (офтальмат) является аналогом глутатиона, в котором тиольная цистеинового остатка заменена на метильную. Офтальмат образуется из 2-аминобутирата путем последовательных реакций с гамма-глутамилцистеинсинтетазой (GCS) и глутатионсинтетазой (GS) как побочный продукт реакции образования глутатиона (GSH). В эксперименте по индуцированию окисления тиоловых групп и перекисного окисления липидов (ПОЛ) было показано, что данные процессы приводят к активации GCS, что, в свою очередь, индуцирует синтез GSH и офтальмата [8]. Однако последний не подвергается дальнейшему метаболизму из-за отсутствия тиоловой группы и, тем самым, накапливается в организме. В связи с этим повышенное содержание офтальмовой кислоты может свидетельствовать о наличии в организме окислительного стресса, что согласуется с механизмами атеросклеротического поражения сосудов.
Мы наблюдаем снижение в экспериментальной группе животных двух производных индола, который является метаболитами триптофана, индолакриловой кислоты и индол-3-карбоксальдегида. Предположительно, это связано с тем, что при воспалении повышается секреция индоламин-2,3-диоксигеназы (IDO), которая ответственна за катаболизм триптофана по кинурениновому пути, тогда как на индольный путь триптофана расходуется меньше [3]. Ранее уже было показано, что пациенты с атеросклерозом имеют более низкие уровни производных индола в плазме [9].
Ранее мы описывали накопление ацилкарнитинов и свободных жирных кислот при атеросклерозе, связанное с нарушением β-окисления из-за нарастающей гипоксии и энергетического дисбаланса, что, вероятно, проявляется уже при глубоких поражениях эндотелия [3], тогда как в некоторых литературных данных встречается информация о снижении ацилкарнитинов. Полученные в эксперименте изменения показывают обратную тенденцию – ацилкарнитины и жирные кислоты, независимо от длины ацильной цепи, имели пониженное содержание у животных на гиперлипидемическом рационе питания. Такое расхождение с теоретическими данными может объясняться тем, что эндотелий еще не подвергся глубоким изменениям и липидной инфильтрации, а снижение связано с поступлением большого количества углеводов в виде сахарозы. При этом обе найденные жирные кислоты являются полиненасыщенными, оттого представляются легкими мишенями для ПОЛ, что может служить еще одной причиной их снижения и вносить их вклад в усугубление окислительного стресса.
Увеличение уровня желчной кислоты и стерола происходит из-за избыточного поступления ХС, т. е. элиминация ХС из организма происходит в виде желчных кислот и стеролов для компенсаторного его снижения. Направление изменения согласуется с другими исследованиями [10].
В большой доле исследований, связанных с изучением метаболома при атеросклерозе, сообщается об изменении в содержании глицерофосфолипидов, но изменения эти часто неоднозначны, и ведутся дискуссии по поводу того, обладают эти сигнальные молекулы атерогенными или антиатерогенными свойствами. Мы также обнаружили изменения разной направленности в содержании этих молекул в крови животных из экспериментальной группы. Положительная связь с гиперлипидемическим рационом питания была установлена для двух лизофосфатидилхолинов (LPC): LPC (O-18:0/0:0) и LPC (20:3); снижение уровня было обнаружено для четырех других LPC: LPC 1(9:0), LPC (20:0), LPC (20:1) и LPC (16:1); уменьшилось содержание двух окисленных фосфатидилхолинов (PC): PC (22:2;O2) и PC (23:2;O2) и двух молекул лизофосфатидилэтаноламинов (LPE): LPE (16:1) и LPE (18:1). LPC (O-18:0/0:0), так называемый lyso-PAF, является предшественником фактора, активирующего тромбоциты (PAF), и продуктом его катаболизма. Сам PAF экспрессируется тромбоцитами, эндотелиальными клетками, моноцитами и макрофагами. PAF является провоспалительным фактором, приводит к синтезу и высвобождению цитокинов, факторов роста, активных форм кислорода и активных форм азота, экспрессии интегринов и селектинов, что способствует активации и агрегации тромбоцитов и лейкоцитов, активации эндотелиальных клеток, повышению адгезии, инвазии и миграции воспалительных клеток, что впоследствии и приводит к эндотелиальной дисфункции и усугублению атеросклеротического поражения. В результате для предотвращения нарастающего окислительного и воспалительного коллапса организм, возможно, на начальных стадиях развития атеросклероза подавляет образование такого мощного провоспалительного метаболита, как PAF, посредством его гидролиза до lyso-PAF.
Различия в результатах исследований связывают с различной биологической активностью LPC в зависимости от длины ацильной цепи и ее насыщенности. Более того, было показано, что множество зарегистрированных провоспалительных эффектов, приписываемых LPC, на самом деле возникают из-за PAF-подобной активности примесей в некоторых коммерческих препаратах LPC: когда эти препараты подвергались воздействию PAF-ацетилгидролазы или омылению по остатку sn-2, провоспалительная активность препаратов LPC нивелировалась [11]. В последнее время появляется все больше публикаций, сообщающих о связи низкого уровня LPC с неблагоприятными исходами ССЗ. В нашем же исследовании наблюдается общая черта в снижении LPC и LPE – все они содержат в своем составе насыщенные жирные кислоты (НЖК) и мононенасыщенные жирные кислоты (МНЖК), тогда как LPC с полиненасыщенной жирной кислотой (ПНЖК) показал тенденцию к увеличению содержания в крови животных опытной группы. Нет четкой тенденции в изменении уровня глицерофосфолипидов при атеросклеротических поражениях, в исследованиях одни и те же LPC имеют изменения разной направленности [12][13]. Снижение же уровня LPC подтверждает гипотезу о том, что данные вещества являются субстратом для производства лизофосфатидной кислоты (LPA) за счет быстрого превращения в биологических жидкостях, тканях и живых клетках под действием аутотаксина. LPA способна передавать сигналы через рецепторы, связанные с G-белком, и участвовать в хроническом воспалении, фиброзных заболеваниях и тромбозе [14]. Возможно, именно LPA, а не LPC ответственен за сообщаемые атерогенные эффекты LPC [15]. Пониженные уровни LPC также можно объяснить снижением их синтеза в печени по отрицательной обратной связи из-за повышенной липидной нагрузки.
LPE же на данный момент мало изучены, и их функции в организме точно пока не установлены, что затрудняет интерпретацию полученных нами результатов по их вкладу в атерогенез, однако ранее уже наблюдалось их снижение [16].
При классической картине атеросклероза присутствует выраженная гиперлипидемия, которая проявляется в повышении уровня ХС-ЛПНП, общего ХС и ТГ на фоне снижения ХС-ЛПВП и чаще всего наряду с малоподвижным образом жизни и избыточным весом. Масса тела животных опытной группы была выше в сравнении с контрольной группой, а после 4 недель наблюдалось и биохимическое подтверждение нарастающей гиперлипидемии – повышение уровня общего ХС, ХС-ЛПВП и ТГ. Уровень же ХС-ЛПНП изменился лишь через 7 недель эксперимента, что можно объяснить тем фактом, что главным переносчиком ХС у крыс является ЛПВП, чье увеличение было заметно сразу же, тогда как эффект Тиамазола на снижение количества рецепторов ЛПНП в печени был выражен через некоторое время вкупе с нарастающей гиперлипидемией. С этим также связано отсутствие характерного для атеросклероза снижения уровня «антиатерогенных» ЛП.
Результаты общего анализа крови также показали признаки формирования атеросклеротического поражения. Повышение уровня лейкоцитов в опытной группе свидетельствует о в оспалительной реакции, которая является одним из ведущих механизмов развития атеросклеротического поражения сосудов. Увеличение уровня лейкоцитов на 4-й неделе объясняется повышенным содержанием лимфоцитов, при этом абсолютное содержание других лейкоцитов, к которым относятся эозинофилы, базофилы и моноциты, не изменяется. Роль лимфоцитов в атерогенезе доказана, однако можно предположить, что именно лимфоциты ответственны за иммунный ответ на начальных стадиях, что также соответствует другим исследованиям [17]. В дальнейшем же лимфоциты могут ограничивать и приглушать воспалительный ответ, тогда как гранулоциты и моноциты будут способствовать увеличению поражения сосудов. Об отсутствии существенных патологических изменений можно судить по сопоставимому с контрольной группой содержанию моноцитов, которые дифференцируются в макрофаги для захвата липопротеинов в месте липидной инфильтрации эндотелия [18]. Однако после 11 недель эксперимента в опытной группе замечено 1,5-кратное увеличение показателя MID % относительно контрольной группы (данные не представлены), но без статистической значимости (p = 0,063). Эта информация также служит основанием полагать, что формирование очага поражения началось лишь к 3 месяцам питания гиперлипидемическим рационом, тогда как мы наблюдаем проявления начальной стадии атерогенеза еще до поражения сосудов.
Среди полученных результатов есть и те, что подтверждают изменение реологии крови. К таким маркерам относятся тромбоцитарные и эритроцитарные индексы. Так, присутствуют изменения структуры популяции тромбоцитов, которые появляются после 7 недель эксперимента, выражающиеся в увеличении индекса среднего объема клеток (MPV) и индекса распределения (PDW), которые связывают с функциональной активностью тромбоцитов. В результате активации дисковидная форма тромбоцитов меняется на сферическую, появляются псевдоподии, что ведет к увеличению их размеров и степени анизоцитоза. Считается, что большие тромбоциты метаболически и ферментативно более активны и поэтому имеют больший протромботический потенциал. PDW отражает гетерогенность популяции по размерам. Увеличение MPV связывают с дисфункцией эндотелия и коронарным атеросклерозом [19]. Повышение тромбокрита же в свою очередь сигнализирует об увеличении тромбоцитарной массы и повышенной свертываемости крови.
Параллельно этому, эритроцитарные индексы, такие как средний объем (MCV) и индекс распределения (RDW), увеличены в опытной группе, что объясняется анизоцитозом. Содержание же эритроцитов как в абсолютном, так и в относительном количестве снижено в опытной группе животных. Можно предположить, что наблюдается нарушение синтеза и созревание эритроцитов и гемоглобина из-за воспаления, что объясняет разброс в размерах эритроцитов и говорит о нарушении в системе гемостаза [20].
Ограничения исследования. Для более детального понимания того, в каком состоянии находился эндотелий сосудов, необходимо проведение гистологического исследования аорты и печени животных, а также анализ крови на уровень содержания глюкозы для представления общей картины состояния здоровья животных и исключения отягощающей патологии. Помимо этого, в числе ограничений исследования стоит упомянуть малое количество особей, включенных в исследование, – с учетом полученных данных, эксперимент с большим количеством животных покажет более достоверный результат.
Заключение. В результате поставленного эксперимента по индуцированию атеросклероза у крыс были получены данные, характеризующие различные аспекты заболевания, которые касаются гиперлипидемии, воспаления, окислительного стресса, реологии крови и массы тела животных. В ходе исследования были обнаружены метаболиты, которые могут служить потенциальными биомаркерами протекающих патологических изменений: офтальмат сигнализирует о повышенной окислительной нагрузке на организм; производные индола – о воспалении; изменение уровня жирных кислот и ацилкарнитинов может быть как реакцией на избыточное поступление диетических жиров, так и свидетельствовать о неизвестных пока молекулярных механизмах; глицерофосфолипиды говорят о возможном воспалении и изменении состояния мембран некоторых клеток. Полученные сведения дополняют и расширяют предыдущие работы, описывающие протекание атеросклеротического поражения сосудов, однако точная интерпретация результатов требует дополнительных исследований.
1. HMBD (База данных метаболомов человека). [Электронный ресурс] Режим доступа: https://hmdb.ca/ (дата обращения: 11.07.2023).
2. Липидные карты. [Электронный ресурс] Режим доступа: https://www.lipidmaps.org/ (дата обращения: 11.07.2023).
Список литературы
1. WHO. Cardiovascular diseases (CVDs). Published June 11, 2021. Accessed October 12, 2023. https://www.who.int/en/news-room/fact-sheets/detail/cardiovascular-diseases-(cvds)
2. Sun J, Qiao Y, Zhao M, Magnussen CG, Xi B. Global, regional, and national burden of cardiovascular diseases in youths and young adults aged 15–39 years in 204 countries/territories, 1990–2019: A systematic analysis of Global Burden of Disease Study 2019. BMC Med. 2023;21(1):222. doi: 10.1186/s12916-023-02925-4
3. Унесихина М.С., Чемезов А.И., Сутункова М.П. Метаболомное профилирование при атеросклеротическом поражении сосудов и влияние тяжелых металлов на протекание заболевания (обзор литературы) // Здоровье населения и среда обитания. 2022. Т. 30. № 9. С. 35–42. doi: 10.35627/2219-5238/2022-30-9-35-42
4. Ершова А.И., Аль Раши Д.О., Иванова А.А., Аксенова Ю.О., Мешков А.Н. Вторичные гиперлипидемии: этиология и патогенез // Российский кардиологический журнал. 2019. Т. 24. № 5. С. 74–81
5. Вербовой А.Ф., Долгих Ю.А., Каторжанская Т.Ю., Каторжанский В.К. Гипотиреоз: найти и обезвредить // Медицинский совет. 2021. № 12. С. 266–274. doi: 10.21518/2079-701X-2021-12-266-274
6. Fraser DR. Vitamin D toxicity related to its physiological and unphysiological supply. Trends Endocrinol Metab. 2021;32(11):929-940. doi: 10.1016/j.tem.2021.08.006
7. Beverly JK, Budoff MJ. Atherosclerosis: Pathophysiology of insulin resistance, hyperglycemia, hyperlipidemia, and inflammation. J Diabetes. 2020;12(2):102-104. doi: 10.1111/1753-0407.12970
8. Servillo L, Castaldo D, Giovane A, et al. Ophthalmic acid is a marker of oxidative stress in plants as in animals. Biochim Biophys Acta Gen Subj. 2018;1862(4):991-998. doi: 10.1016/j.bbagen.2018.01.015
9. Cason CA, Dolan KT, Sharma G, et al. Plasma microbiome-modulated indole- and phenyl-derived metabolites associate with advanced atherosclerosis and postoperative outcomes. J Vasc Surg. 2018;68(5):1552-1562. e7. doi: 10.1016/j.jvs.2017.09.029
10. Izidoro MA, Cecconi A, Panadero MI, et al. Plasma metabolic signature of atherosclerosis progression and colchicine treatment in rabbits. Sci Rep. 2020;10(1):7072. doi: 10.1038/s41598-020-63306-y
11. Knuplez E, Marsche G. An updated review of pro- and anti-inflammatory properties of plasma lysophosphatidylcholines in the vascular system. Int J Mol Sci. 2020;21(12):4501. doi: 10.3390/ijms21124501
12. Tanaka H, Zaima N, Sasaki T, et al. Lysophosphatidylcholine acyltransferase-3 expression is associated with atherosclerosis progression. J Vasc Res. 2017;54(4):200-208. doi: 10.1159/000473879
13. Paapstel K, Kals J, Eha J, et al. Inverse relations of serum phosphatidylcholines and lysophosphatidylcholines with vascular damage and heart rate in patients with atherosclerosis. Nutr Metab Cardiovasc Dis. 2018;28(1):44-52. doi: 10.1016/j.numecd.2017.07.011
14. Shen X, Zou J, Li F, Zhang T, Guo T. Lysophosphatidic acid enhances neointimal hyperplasia following vascular injury through modulating proliferation, autophagy, inflammation and oxidative stress. Mol Med Rep. 2018;18(1):87-96. doi: 10.3892/mmr.2018.8937
15. Smyth SS, Kraemer M, Yang L, Van Hoose P, Morris AJ. Roles for lysophosphatidic acid signaling in vascular development and disease. Biochim Biophys Acta Mol Cell Biol Lipids. 2020;1865(8):158734. doi: 10.1016/j.bbalip.2020.158734
16. Gao X, Ke C, Liu H, et al. Large-scale metabolomic analysis reveals potential biomarkers for early stage coronary atherosclerosis. Sci Rep. 2017;7(1):11817. doi: 10.1038/s41598-017-12254-1
17. Abdolmaleki F, Gheibi Hayat SM, Bianconi V, Johnston TP, Sahebkar A. Atherosclerosis and immunity: A perspective. Trends Cardiovasc Med. 2019;29(6):363-371. doi: 10.1016/j.tcm.2018.09.017
18. Борисова Л.В., Пушкин А.С., Ким С.В., Арутюнян А.В., Козина Л.С. Роль гематологических индексов в прогнозировании исходов у больных с острым коронарным синдромом // Лабораторная служба. 2018. Т. 7. № 2. С. 49–55. doi:10.17116/labs20187249-55
19. Korniluk A, Koper-Lenkiewicz OM, Kamińska J, Kemona H, Dymicka-Piekarska V. Mean platelet volume (MPV): New perspectives for an old marker in the course and prognosis of inflammatory conditions. Mediators Inflamm. 2019;2019:9213074. doi: 10.1155/2019/9213074
20. Kuhn V, Diederich L, Keller TCS 4th, et al. Red blood cell function and dysfunction: Redox regulation, nitric oxide metabolism, anemia. Antioxid Redox Signal. 2017;26(13):718-742. doi: 10.1089/ars.2016.6954
Об авторах
М. С. УнесихинаРоссия
Унесихина Мария Сергеевна – младший научный сотрудник отдела молекулярной биологии и электронной микроскопии,
ул. Попова, д. 30, г. Екатеринбург, 620014.
А. И. Чемезов
Россия
Чемезов Алексей Игоревич – научный сотрудник отдела молекулярной биологии и электронной микроскопии,
ул. Попова, д. 30, г. Екатеринбург, 620014.
Т. В. Бушуева
Россия
Бушуева Татьяна Викторовна – к.м.н., заведующая научно-производственным отделом лабораторно-диагностических технологий, старший научный сотрудник,
ул. Попова, д. 30, г. Екатеринбург, 620014.
М. П. Сутункова
Россия
Сутункова Марина Петровна – д.м.н., директор,
ул. Попова, д. 30, г. Екатеринбург, 620014.
Рецензия
Для цитирования:
Унесихина М.С., Чемезов А.И., Бушуева Т.В., Сутункова М.П. Влияние гиперлипидемического рациона питания на метаболом крови у крыс: результаты пилотного эксперимента. Здоровье населения и среда обитания – ЗНиСО. 2024;32(1):58-66. https://doi.org/10.35627/2219-5238/2024-32-1-58-66
For citation:
Unesikhina M.S., Chemezov A.I., Bushueva T.V., Sutunkova M.P. Effects of the hyperlipidemic diet on the rat blood metabolome: Pilot study results. Public Health and Life Environment – PH&LE. 2024;32(1):58-66. (In Russ.) https://doi.org/10.35627/2219-5238/2024-32-1-58-66









.png)



























