Перейти к:
Сравнительный анализ методов отбора проб смывов с объектов внешней среды для оценки вирусно-бактериальной контаминации
https://doi.org/10.35627/2219-5238/2023-31-4-77-84
Аннотация
Введение. Одним их ключевых элементов системы эпидемиологического надзора за инфекционными заболеваниями является микробиологический мониторинг контаминации объектов окружающей среды и рук персонала. В условиях пандемии COVID-19 сложилась особая необходимость проведения вирусологических исследований смывов с объектов окружающей среды и средств индивидуальной защиты персонала в инфекционных госпиталях для больных COVID-19. Однако, согласно действующим нормативным документам, приоритет микробиологического мониторинга смещен в сторону определения и идентификации, прежде всего, патогенов бактериальной природы. Создается необходимость в разработке и внедрении современного метода, позволяющего проводить одномоментную оценку вирусно-бактериальной контаминации.
Цель исследования: провести сравнительный анализ методов отбора проб смывов с объектов внешней среды для оценки вирусно-бактериальной контаминации.
Материалы и методы. Отбор проб смывов проводили в соответствии с запатентованной авторами «Схемой отбора проб смывов с объектов внешней среды для одновременной оценки вирусно-бактериальной контаминации» (патент на промышленный образец № 132971 от 05.09.2022). В исследовании применяли бактериологический, молекулярно-генетический и статистический методы.
Результаты. Исследованы 343 пробы смывов, из которых 68 были нестандартными (по 38 или 11,1 % содержали РНК SARS-CoV-2 и условно-патогенные микроорганизмы). Среди условно-патогенных микроорганизмов было идентифицировано 42 штамма бактерий, в том числе Enterococcus faecalis 16 штаммов (38,1 %), Klebsiella pneumoniaе 9 штаммов (21,4 %), Escherichia coli 7 штаммов (16,7 %), Enterococcus faecium 3 штамма (7,1 %), Staphylococcus aureus 3 штамма (7,1 %), Pseudomonas aeruginosa 2 штамма (4,9 %) и Pantoea agglomerans 2 штамма (4,9 %). Было выявлено 11 вариантов вирусно-бактериальных ассоциаций. Сопоставление результатов исследования смывов, отобранных исследуемым методом, с результатами отбора регламентированным методом указывало на существенное различие в доле нестандартных находок SARS-CoV-2 – в 11,1, условно-патогенной микрофлоры – 12,3 раза.
Выводы. Таким образом, исследуемый метод отбора смывов с объектов окружающей среды отвечает современным требованиям и обеспечивает возможность проведения объективной оценки уровня вирусно-бактериальной контаминации исследуемых объектов. Данный подход может быть применен при проведении лабораторных исследований в рамках государственного и производственного контроля в учреждениях различных профилей (медицинских, пищевых, детских и пр.).
Ключевые слова
Для цитирования:
Смирнова С.С., Жуйков Н.Н., Егоров И.А., Пушкарева Н.А., Семенов А.В. Сравнительный анализ методов отбора проб смывов с объектов внешней среды для оценки вирусно-бактериальной контаминации. Здоровье населения и среда обитания – ЗНиСО. 2023;31(4):77-84. https://doi.org/10.35627/2219-5238/2023-31-4-77-84
For citation:
Smirnova S.S., Zhuikov N.N., Egorov I.A., Pushkareva N.A., Semenov A.V. Comparative Analysis of Methods of Environmental Surface Sampling for Assessment of Viral and Bacterial Contamination. Public Health and Life Environment – PH&LE. 2023;31(4):77-84. (In Russ.) https://doi.org/10.35627/2219-5238/2023-31-4-77-84
Введение. Одним их ключевых элементов системы эпидемиологического надзора за инфекционными заболеваниями является микробиологический мониторинг контаминации объектов окружающей среды (ООС) и рук персонала, в том числе медицинских организаций, как факторов распространения возбудителей инфекционных болезней. Согласно действующим нормативным документам основными направлениями микробиологического мониторинга являются санитарно-бактериологические исследования микробной обсемененности ООС1 2 и санитарно-вирусологические исследования3.
Несмотря на это, приоритет микробиологического мониторинга смещен в сторону определения и идентификации, прежде всего, патогенов бактериальной природы. Такой подход не учитывает современную тенденцию эпидемического процесса, характеризующуюся сменой ведущих возбудителей, со значительным увеличением этиологической роли агентов вирусов природы и не позволяет в полной мере установить причинно-следственные связи при расследовании вспышек инфекционных заболеваний [1].
Так, в частности, оценка вспышечной заболеваемости острыми кишечными инфекциями (ОКИ) свидетельствует о значительной роли в этиологии рота- и норовирусов [2]. В Государственном докладе «О состоянии санитарно-эпидемиологического благополучия населения Российской Федерации в 2021 году» отмечено, что в медицинских организациях в 2021 году помимо SARS-CoV-2 формировались вспышки, связанные с рота-, норо- и энетровирусами4.
В условиях пандемии COVID-19 сложилась особая необходимость проведения вирусологических исследований смывов с ООС и средств индивидуальной защиты (СИЗ) персонала в специализированных медицинских организациях (МО) стационарного типа – инфекционных госпиталях для лечения больных COVID-19. В учреждения данного типа формируется искусственно созданная закрытая экосистема, в которой отмечается одновременная циркуляция вирусов и бактерий с антимикробной резистентностью [3–6]. Это требует расширения номенклатуры исследований обсемененности ООС дополнительными вирусологическими исследованиями.
Регламентированная раздельность процедур отбора проб смывов с ОСС на бактериологические и вирусологические исследования не позволяет проводить совместную оценку вирусно-бактериальной контаминации в рамках микробиологического мониторинга. Страдает объективность оценки микробной контаминации за счет невозможности сопоставления результатов бактериологических и вирусологических исследований разных наблюдений [7–9]. Также не учитывается специфика взаимодействия вирусных и бактериальных популяций при их смешанной циркуляции, сопровождающаяся более длительным сохранением вирусов в бактериальных биопленках [10].
Создается необходимость в разработке и внедрении современного метода по одномоментной оценке, вирусно-бактериальной контаминации с целью установления роли ООС в эпидемиологической цепочке передачи возбудителей инфекционных болезней и разработке целенаправленных профилактических и противоэпидемических мероприятий.
Цель исследования: провести сравнительный анализ методов отбора проб смывов с объектов внешней среды для оценки вирусно-бактериальной контаминации.
Материалы и методы. Исследование проведено в 2022 году на базе Екатеринбургского научно-исследовательского института вирусных инфекций Федерального бюджетного учреждения науки «Государственный научный центр вирусологии и биотехнологии “Вектор”» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (в настоящее время – Федеральное бюджетное учреждение науки «Федеральный научно-исследовательский институт вирусных инфекций “Виром”» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, приказ Роспотребнадзора № 599 от 11.11.2022), Федерального бюджетного учреждения здравоохранения «Центр гигиены и эпидемиологии в Свердловской области» и одного из учреждений здравоохранения Свердловской области, где был развернут инфекционный госпиталь для лечения больных COVID-19.
Отбор проб смывов с ООС и СИЗ персонала на наличие генетического материала SARS-CoV-2 и условно-патогенной микрофлоры (УПМ) проводили в соответствии с запатентованной авторами «Схемой отбора проб смывов с объектов внешней среды для одновременной оценки вирусно-бактериальной контаминации» (патент на промышленный образец № 132971 от 05.09.2022).
Смывы отбирали одновременно двумя стерильными тампонами в течение 3 суток через каждые 4 часа по 20 унифицированным точкам отбора (рисунок). Точки отбора были сгруппированы в 3 блока: СИЗ персонала (наружная поверхность перчаток врача, медицинской сестры, уборщика служебных помещений; наружная поверхность комбинезона врача, медицинской сестры, уборщика служебных помещений), пациенты (манипуляционный столик у постели больного, поручни и рычаги реанимационной кровати, наружная поверхность шприцевого дозатора, наружная поверхность аппарата ИВЛ), общебольничные точки (наружная поверхность электроотсоса, винты кислородной разводки, выключатели электроосвещения, ручки дверей, дозаторы для жидкого мыла/кожного антисептика, рабочее место врача). Всего было отобрано 343 пробы смывов, по 17–18 проб с каждой точки отбора.

Рисунок. Схема отбора смывов с объектов внешней среды для оценки вирусно-бактериальной контаминации
Figure. Scheme for sampling environmental swabs for simultaneous assessment of viral and bacterial contamination
Перед началом отбора проводилась подготовка пробирки с зонд-тампоном и средой для вирусов (СТ) и пробирки с зонд-тампоном и пептонной водой (ЗТ). Процедура взятия смыва осуществлялась в соответствии с запатентованной «Схемой отбора проб смывов с объектов внешней среды для одновременной оценки вирусно-бактериальной контаминации». После окончания отбора смывов зонд-тампоны опускали обратно в пробирки, которые устанавливали в штатив. В дальнейшем проба направлялась на микробиологические исследования для выделения УПМ. При выделении УПМ выделенные штаммы исследовались фенотипически и генотипически. Генетический материал вирусов в пробах определялся методом полимеразной цепной реакции. При обнаружении генетического материала вирусов проводили генотипирование.
Смывы брались одновременно с запланированных поверхностей путем легкого надавливания тампонами по поверхности. Перемещение тампонов по поверхности осуществлялось в двух перпендикулярных направлениях. При контроле мелких предметов смывы забирались с поверхности всего предмета, при контроле предметов с большей поверхности – из нескольких мест с общей площадью не менее 100 см². Смывы с рук брали в следующем порядке: протирали тампонами поверхности перчаток обеих рук, проводя не менее 5 раз по каждой тыльной, ладонной поверхностей кистей, больших пальцев и межпальцевых промежутков.
В настоящем исследовании после процедуры взятия смыва для обнаружения РНК SARS-CoV-2 тампон погружали в стерильные одноразовые пробирки, наполненные 2 мл транспортной среды для вирусов (ООО «Полигем»), для определения условно-патогенных бактерий – стерильные стеклянные пробирки с пептонной водой.
Хранение, подготовка проб к транспортированию, транспортировка и выявление РНК SARS-CoV-2 в пробах проводились в соответствии с МР 3.1.0196–205, МУ 4.2.2942–116 и инструкцией к тест-системам методом ПЦР в реальном времени с применением тест-системы АмплиСенс® Cov-Bat-FL. Для выделения нуклеиновых кислот из исследуемых проб использовали набор «РИБО-преп», проведения обратной транскрипции применяли набор «Реверта-L» (ФБУН «ЦНИИ эпидемиологии» Роспотребнадзора, Москва).
Изучение фенотипических свойств циркулирующей микрофлоры проводилось бактериологическим методом с подтверждением чистоты культуры, постановкой биохимических рядов. Оценка антибиотикорезистентности выделенных штаммов проводилась с помощью автоматического бактериологического анализатора VITEK® 2 Compact (bioMerieux SA, Франция) и классическим полуколичественным диско-диффузионным методом.
Объектом сравнения частоты выделения УПМ и генетического материала вируса SARS-CoV-2 при использовании стандартных (раздельных) методов отбора материала с объектов внешней среды послужили данные еженедельного отчета № 1364 «Мониторинг нарушения санитарного законодательства в медицинских организациях», представленного Управлениями Роспотребнадзора по субъектам Уральского Федерального округа (УФО) за 43 неделю 2021 года в системе оперативного обмена данных report.gsen.ru, что по времени соответствовало периоду проведения исследования.
Патентный поиск осуществлялся путем введения поисковых запросов по ключевым словам: смывы, отбор смывов, контаминация объектов, вирусно-бактериальная контаминация в базах данных «Патентные документы РФ» и «Российские промышленные образцы» Федерального государственного бюджетного учреждения «Федеральный институт промышленной собственности» (https://fips.ru/iiss/). Глубина поиска составила 22 года (2000–2022 гг.).
В исследовании применяли молекулярно-генетические, бактериологический и статистический методы. Для анализа полученных данных применяли общепринятые статистические приемы. Данные представлены в виде абсолютных и относительных величин (%).
Статистическую значимость различий оценивали по точечному критерию Фишера (φ). Различия считали достоверными при p ≤ 0,05. Статистическую обработку данных проводили с использованием пакета прикладных программ Microsoft Office 2010, онлайн-ресурса https://medstatistic.ru/, ПС Statistica 10.
Результаты. В ранее проведенном авторами исследовании была изучена вирусно-бактериальная контаминация объектов больничной среды инфекционного госпиталя для лечения больных, инфицированных SARS-CoV-2, и практически отработан метод отбора проб смывов с объектов внешней среды для одновременной оценки вирусно-бактериальной контаминации (патент на промышленный образец № 132971 от 05.09.2022 «Схема отбора проб смывов с объектов внешней среды для одновременной оценки вирусно-бактериальной контаминации») [11]. Настоящее исследование является логическим продолжением исследования по возможности совместной оценки вирусно-бактериальной контаминации в рамках микробиологического мониторинга.
Всего отобрано и исследовано 343 пробы смывов с ООС и СИЗ персонала, из них 68 нестандартных, в том числе 38 – РНК SARS-CoV-2 (11,1 %), 38 – УПМ (11,1 %).
Выделенный с поверхностей SARS-CoV-2 относился к геноварианту B.1.617.1 DELTA, который имел наибольшее распространение в период проведения исследования.
В процессе исследования нестандартных проб УПМ выделено 42 штамма бактерий: Enterococcus faecalis (16 штаммов, 38,1 %), Klebsiella pneumoniaе (9 штаммов, 21,4 %), Escherichia coli (7 штаммов, 16,7 %, Enterococcus faecium (3 штамма, 7,1 %), Staphylococcus aureus (3 штамма, 7,1 %), Pseudomonas aeruginosa (2 штамма, 4,9 %) и Pantoea agglomerans (2 штамма, 4,9 %).
Установлено 11 вариантов вирусно-бактериальных ассоциаций, спектр сочетания которых был крайне разнообразен: SARS-CoV-2 + E. faecalis (27,3 %), SARS-CoV-2 + K. pneumoniaе (18,2 %), SARSCoV-2 + E. coli (9,1 %), SARS-CoV-2 + P. aeruginosa (9,1 %), P. agglomerans + E. faecalis (9,1 %), E. coli + E. faecalis (9,1 %), K. pneumoniaе + E. faecalis (9,1 %), K. pneumoniaе + E. coli (9,1 %). В роли ассоцианта в большинстве случаев (63,6 %) выступал SARS-CoV-2, среди бактериальной микрофлоры лидировали E. faecalis (54,5 %) и K. pneumoniaе (36,4 %).
Профиль антибиотикорезистентности всех выделенных штаммов УПМ характеризовался устойчивостью к пенициллинам (40,5 %), фторхинолонам и тетрациклинам (по 33,3 %) и цефалоспоринам (26,2 %).
Штаммы E. faecalis были резистентны к макролидам (100,0 %) и тетрациклинам (75,0 %), в меньшей степени к фторхинолонам – 18,8 %. Все штаммы E. faecium были устойчивы к макролидам, треть была резистентна к нитрофурантоину.
Треть штаммов S. aureus была устойчива к пенициллинам и макролидам (по 33,3 %). Один выделенный штамм S. aureus имел фенотип MLSB, обуславливающий перекрестную устойчивость ко всем макролидам, линкозамидам и стрептограминам В.
Все выделенные штаммы K. pneumoniaе (100 %) были устойчивы к пенициллинам, цефалоспоринам, макролидам и сульфаметоксазол/триметоприму, в 66,7 % – к фторхинолонам, аминогликозидам, нитрофурантоинам, в 22,2 % – к карбапенемам, тетрациклинам, фосфомицину. Бета-лактамазу расширенного спектра действия (ESBL) продуцировали 7 (77,8 %) из 9 выделенных штаммов K. pneumoniaе.
Все выделенные штаммы E. coli проявили резистентность к пенициллинам (100,0 %), 71,4 % – к фторхинолонам. В меньшей степени устойчивость E. coli проявлялась к цефалоспоринам – 28,6 %, аминогликозидам и фосфомицину – по 14,3 %. Бета-лактамазу расширенного спектра действия (ESBL) продуцировали 2 (28,6 %) из 7 выделенных штаммов E. coli.
Штаммы P. aeruginosa были резистентны к фосфомицину (100,0 %) и пенициллинам (50,0 %), штаммы P. agglomerans – к тетрациклинам (100,0 %) и карбапенемам (50,0 %).
Нами проведено сопоставление результатов, полученных в ходе исследуемого отбора смывов для определения вирусно-бактериальной контаминации с результатами регламентированного отбора проб, который проводился в рамках еженедельного мониторинга вирусно-бактериальной контаминации ООС инфекционный госпиталей субъектов Уральского федерального округа (УФО) в период, соответствующий периоду проведения исследования (43 неделя 2021 г.).
Всего в инфекционных госпиталях УФО было отобрано и исследовано 709 пробы смывов на SARS-CoV-2 (нестандартных не выявлено) и 1021 проб на УПМ (из них 9 нестандартных, 0,9 %). Всего было выделено 10 штаммов бактерий, из них: Staphylococcus spp. (3 штамма, 30,0 %), E. coli (3 штаммов, 30,0 %), Klebsiella spp. (1 штамм, 10,0 %), Acinetobacter spp. (1 штамма, 10,0 %), P. aeruginosa (2 штамма, 20,0 %).
Сопоставление результатов исследования смывов, отобранных исследуемым методом, с результатами отбора регламентированным методом указывало на существенное различие в доле нестандартных находок SARS-CoV-2 – в 11,1, УПМ – 12,3 раза (табл. 1).
Таблица 1. Частота обнаружения нестандартных находок смывов с объектов внешней среды инфекционных госпиталей исследуемым и регламентированным методом отбора проб смывов (абсолютное число, %)
Table 1. Frequency of atypical findings in wipe samples of environmental objects in infectious disease hospitals collected using the proprietary and standard methods (n, %)
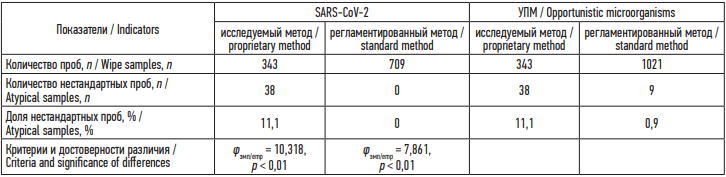
Примечание: р – уровень статистической значимости; φэмп – точечный критерий Фишера.
Notes: p – level of statistical significance; φemp – Fisher’s exact test.
Спектр выделенных штаммов УПМ существенно не различался в зависимости от метода отбора и был представлен Enterobacter spp., Klebsiella spp., Escherichia coli, Staphylococcus spp., Pseudomonas aeruginosa, Acinetobacter spp. (табл. 2). Однако частота выделения имела различия. Так, при регламентированном методе отбора в структуре находок преобладали Staphylococcus spp. и Escherichia coli (по 30,0 %), Pseudomonas aeruginosa (20,0 %), в том время как при одномоментном методе отбора лидировали Enterobacter spp. (45,2 %), Klebsiella spp. (21,4 %) и Escherichia coli (16,7 %).
Таблица 2. Частота выделения штаммов условно-патогенных бактерий с объектов больничной среды инфекционных госпиталей исследуемым и регламентированным методом отбора проб смывов (абсолютное число, %)
Table 2. Frequency of isolating strains of opportunistic bacteria from wipe samples of environmental objects in infectious disease hospitals collected using the proprietary and standard methods (n, %)
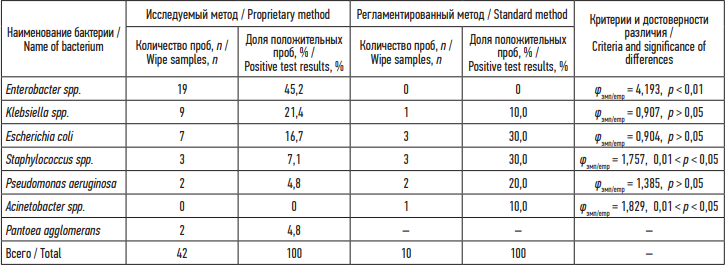
Примечание: р – уровень статистической значимости; φэмп – точечный критерий Фишера.
Notes: p – level of statistical significance; φemp – Fisher’s exact test.
Обсуждение. Необходимость совместной оценки уровня вирусной и бактериальной нагрузки в учреждениях различного типа приобрела особое значение в условиях пандемии COVID-19. Проведен широкий спектр исследований по изолированной оценке контаминации объектов больничной среды вирусом SARS-CoV-2 и представителями УПМ [12–15]. В Китае доля смывов с ОСС, отобранных в помещениях «красной зоны» инфекционных госпиталей для лечения больных COVID-19, содержащих РНК SARS-CoV-2, достигала 56,7 % [16–18]. В медицинских организациях г. Хабаровска уровень бактериальной контаминации ООС составил 4,7 %, были выделены P. aeruginosa, P. stutzeri, Acinetobacter baumannii, K. pneumoniae, K. oxytoca, Enterobacter cloacae, Pantoea, Enterococcus faecium, Staphylococcus haemolyticus, однако обнаружение вирусов (в т. ч. SARS-CoV-2) не проводилось [19].
Опубликованы результаты исследований и по совместной оценке вирусно-бактериальной контаминации. Так, в Испании отбор проб на SARS-CoV-2 осуществлялся методом смывов, а бактериальная нагрузка оценивалась путем прижатия чашек Петри с питательной средой к исследуемым поверхностям [20]. В США для совместной оценки вирусной (SARSCoV-2) и бактериальной нагрузки поверхностей инфекционного госпиталя для лечения больных и подозрительных на COVID-19 использовали синтетические тампоны с двойным наконечником, которые погружали в пробирку с этиловым спиртом. Однако применение этилового спирта вместо транспортной среды существенно ограничивало использование данного метода отбора совместно с классическими бактериологическими методами [21]. Исследование, проведенное в Англии, совмещало в себе изучение контаминации объектов больничной среды РНК SARS-CoV-2 с бактериями, однако в ходе него не проводили секвенирование и родовидовую характеристику выделенных бактерий [5]. Опубликованы данные и о применении двойных зондов для взятия смывов с рук для изучения влияния техники гигиены рук на микробном кожи [22].
В результате патентного поиска в базах данных «Патентные документы РФ» и «Российские промышленные образцы» Федерального государственного бюджетного учреждения «Федеральный институт промышленной собственности» документов на методику одномоментного использования двух тупферов для отбора смывов с объектов внешней среды для совместной оценки контаминации объектов вирусами и бактериями нами не найдено.
Заключение. Таким образом, при сравнительном анализе исследуемого и регламентированного методов отбора проб установлено:
1. Отбор смывов с объектов внешней среды для одновременной оценки вирусно-бактериальной контаминации показал высокую эффективность в обнаружении нестандартных находок SARS-CoV-2 и УПМ (до 12,3 раза).
2. Исследуемый метод отвечает современным требования и обеспечивает возможность проведения объективной оценки уровня вирусно-бактериальной контаминации ООС и рук персонала, что позволяет оптимизировать проведение микробиологического мониторинга с учетом текущей эпидемиологической ситуации, проводить одновременную оценку контаминации объектов внешней среды бактериями и вирусами, целенаправленно проводить дезинфекционные мероприятия.
3. Данный подход может быть применен при проведении лабораторных исследований в рамках государственного и производственного контроля в учреждениях различных профилей (медицинских, пищевых, детских и пр.).
1. МУ 4.2.2942–11 «Методы санитарно-бактериологических исследований объектов окружающей среды, воздуха и контроля стерильности в лечебных организациях». [Электронный ресурс.] Режим доступа: https://docs.cntd.ru/document/1200087214 (дата обращения: 02.02.2022).
2. МР 4.2.0220–20 «Методы санитарно-бактериологического исследования микробной обсемененности объектов внешней среды». [Электронный ресурс.] Режим доступа: https://docs.cntd.ru/document/573595605 (дата обращения: 02.02.2022).
3. МУК 4.2.3591–19 «Методы санитарно-вирусологических исследований пищевых продуктов и смывов с объектов окружающей среды на предприятиях пищевой промышленности, общественного питания и торговли. Подготовка образцов для исследований с применением методов амплификации нуклеиновых кислот (МАНК)». [Электронный ресурс.] Режим доступа: https://docs.cntd.ru/document/564952849 (дата обращения: 02.02.2022).
4. О состоянии санитарно-эпидемиологического благополучия населения в Российской Федерации в 2021 году: Государственный доклад. М.: Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека, 2022. 340 с.
5. МР 3.1.0196–20 «Профилактика инфекционных болезней. Выявление возбудителя COVID-19 в образцах внешней среды». [Электронный ресурс.] Режим доступа: https://docs.cntd.ru/document/565310373 (дата обращения: 02.02.2022).
6. МУ 4.2.2942–11 «Методы санитарно-бактериологических исследований объектов окружающей среды, воздуха и контроля стерильности в лечебных организациях». [Электронный ресурс.] Режим доступа: https://docs.cntd.ru/document/1200087214 (дата обращения: 02.02.2022).
Список литературы
1. Смирнова С.С., Южанина Т.С., Вяткина Л.Г., Голубкова А.А., Алимов А.В. Вспышки инфекционных заболеваний в медицинских организациях. Вопросы эпидемиологической диагностики. Преданалитический этап // Эпидемиология и инфекционные болезни. 2019. Т. 24. № 5-6. С. 204–212. doi: 10.17816/1560-9529-2019-24-5-6-204-212
2. Сергевнин В.И., Кузовникова Е.Ж., Трясолобова М.А., Ладейщикова Ю.И. Тенденции в многолетней динамике заболеваемости населения острыми кишечными инфекциями и эпидемиологические особенности вспышек в последние годы // Эпидемиология и инфекционные болезни. 2015. Т. 20. № 4. С. 17–21.
3. Wu S, Wang Y, Jin X, Tian J, Liu J, Mao Y. Environmental contamination by SARS-CoV-2 in a designated hospital for coronavirus disease 2019. Am J Infect Control. 2020;48(8):910-914. doi: 10.1016/j.ajic.2020.05.003
4. Coil DA, Albertson T, Banerjee S, et al. SARS-CoV-2 detection and genomic sequencing from hospital surface samples collected at UC Davis. PLoS One. 2021;16(6):e0253578. doi: 10.1371/journal.pone.0253578
5. Moore G, Rickard H, Stevenson D, et al. Detection of SARSCoV-2 within the healthcare environment: a multi-centre study conducted during the first wave of the COVID-19 outbreak in England. J Hosp Infect. 2021;108:189-196. doi: 10.1016/j.jhin.2020.11.024
6. Белобородов В.Б., Гусаров В.Г., Дехнич А.В. и др. Методические рекомендации Российской некоммерческой общественной организации «Ассоциация анестезиологов-реаниматологов«, Межрегиональной общественной организации «Альянс клинических химиотерапевтов и микробиологов», Межрегиональной ассоциации по клинической микробиологии и антимикробной химиотерапии (МАКМАХ), общественной организации «Российский Сепсис Форум» «Диагностика и антимикробная терапия инфекций, вызванных полирезистентными штаммами микроорганизмов» // Вестник анестезиологии и реаниматологии. 2020. Т. 17. № 1. С. 52-83. doi: 10.21292/2078-5658-2020-17-1-52-83
7. Onakpoya IJ, Heneghan CJ, Spencer EA, et al. SARS-CoV-2 and the role of fomite transmission: a systematic review. F1000Res. 2021;10:233. doi: 10.12688/f1000research.51590.3
8. Белова И.В., Точилина А.Г., Соловьева И.В. и др. Видовой состав микробиоты автобусов внутригородских маршрутов // Здоровье населения и среда обитания. 2021. № 4 337). С. 10–17. doi: 10.35627/2219-5238/2021-337-4-10-17
9. Послова Л.Ю., Сергеева А.В., Ковалишена О.В. Оценка контаминации больничной среды кишечными вирусами в рамках эпидемиологического надзора за острыми кишечными инфекциями вирусной этиологии // Медицинский альманах. 2018. № 4 (55). C. 42–46. doi: 10.21145/2499-9954-2018-4-42-46
10. Turnage NL, Gibson KE. Sampling methods for recovery of human enteric viruses from environmental surfaces. J Virol Methods. 2017;248:31-38. doi: 10.1016/j.jviromet.2017.06.008
11. Егоров И.А., Смирнова С.С., Мищенко В.А., Вялых И.В. и др. Особенности вирусно-бактериальной контаминации объектов больничной среды инфекционного госпиталя для лечения больных COVID-19 в период пандемии // Эпидемиология и Вакцинопрофилактика. 2022. Т. 21. № 6. С. 13–23. doi: 10.31631/2073-3046-2022-21-6-13-23
12. Cheng VC, Wong SC, Chan VW, et al. Air and environmental sampling for SARS-CoV-2 around hospitalized patients with coronavirus disease 2019 (COVID-19). Infect Control Hosp Epidemiol. 2020;41(11):1258-1265. doi: 10.1017/ice.2020.282
13. Elbadawy HM, Khattab A, Alalawi A, et al. The detection of SARS-CoV-2 in outpatient clinics and public facilities during the COVID-19 pandemic. J Med Virol. 2021;93(5):2955-2961. doi: 10.1002/jmv.26819
14. Shah MR, Jan I, Johns J, et al. SARS-CoV-2 nosocomial infection: Real-world results of environmental surface testing from a large tertiary cancer center. Cancer. 2021;127(11):1926-1932. doi: 10.1002/cncr.33453
15. Piana A, Colucci ME, Valeriani F, et al. Monitoring COVID-19 transmission risks by quantitative real-time PCR tracing of droplets in hospital and living environments. mSphere. 2021;6(1):e01070-20. doi: 10.1128/mSphere.01070-20
16. Chia PY, Coleman KK, Tan YK, et al. Detection of air and surface contamination by SARS-CoV-2 in hospital rooms of infected patients. Nat Commun. 2020;11(1):2800. doi: 10.1038/s41467-020-16670-2
17. Lv J, Yang J, Xue J, Zhu P, Liu L, Li S. Detection of SARSCoV-2 RNA residue on object surfaces in nucleic acid testing laboratory using droplet digital PCR. Sci Total Environ. 2020;742:140370. doi: 10.1016/j.scitotenv.2020.140370
18. Ong SWX, Tan YK, Chia PY, et al. Air, surface environmental, and personal protective equipment contamination by severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) from a symptomatic patient. JAMA. 2020;323(16):1610–1612. doi: 10.1001/jama.2020.3227
19. Троценко О.Е., Бондаренко А.П., Пшеничная Н.Ю. и др. Оценка потенциальной опасности внешней среды двух больничных стационаров г. Хабаровска в период новой коронавирусной инфекции (декабрь 2020 г. – март 2021 г.) // Инфекция и иммунитет. 2022. Т. 12. № 3. C. 535–542. doi: 10.15789/2220-7619-EOT-1844
20. Gavaldà-Mestre L, Ramírez-Tarruella D, Gutiérrez-Milla C, et al. Nondetection of SARS-CoV-2 on high-touch surfaces of public areas next to COVID-19 hospitalization units. Am J Infect Control. 2021;49(6):840-842. doi: 10.1016/j.ajic.2021.01.007
21. Marotz C, Belda-Ferre P, Ali F, et al. SARS-CoV-2 detection status associates with bacterial community composition in patients and the hospital environment. Microbiome. 2021;9(1):132. doi: 10.1186/s40168-021-01083-0
22. Zapka C, Leff J, Henley J, et al. Comparison of standard culture-based method to culture-independent method for evaluation of hygiene effects on the hand microbiome. mBio. 2017;8(2):e00093-17. doi: 10.1128/mBio.00093-17
Об авторах
С. С. СмирноваРоссия
Смирнова Светлана Сергеевна – кандидат медицинских наук, ведущий научный сотрудник, руководитель Урало-Сибирского научно-методического центра по профилактике инфекций, связанных с оказанием медицинской помощи, ФБУН ФНИИВИ «Виром» Роспотребнадзораж, доцент кафедры эпидемиологии, социальной гигиены и организации госсанэпидслужбы ФГБОУ ВО «Уральский государственный медицинский университет»
ул. Летняя, д. 23, г. Екатеринбург, 620030;
ул. Репина, д. 3, г. Екатеринбург, 620028
Н. Н. Жуйков
Россия
Жуйков Николай Николаевич – научный сотрудник Урало-Сибирского научно-методического центра по профилактике инфекций, связанных с оказанием медицинской помощи
ул. Летняя, д. 23, г. Екатеринбург, 620030
И. А. Егоров
Россия
Егоров Иван Андреевич – младший научный сотрудник Урало-Сибирского научно-методического центра по профилактике инфекций, связанных с оказанием медицинской помощи
ул. Летняя, д. 23, г. Екатеринбург, 620030
Н. А. Пушкарева
Россия
Пушкарева Наталия Александровна – заведующая лабораторией контроля биологических факторов филиала
, ул. Мичурина, д. 91, г. Екатеринбург, 620075
А. В. Семенов
Россия
Семенов Александр Владимирович – доктор биологических наук, директор ФБУН ФНИИВИ «Виром» Роспотребнадзора; профессор кафедры экспериментальной биологии и биотехнологии Института естественных наук и математики Уральского федерального университета имени Первого президента России Б.Н. Ельцина
ул. Летняя, д. 23, г. Екатеринбург, 620030;
, ул. Мира, д. 19, г. Екатеринбург, 620002
Рецензия
Для цитирования:
Смирнова С.С., Жуйков Н.Н., Егоров И.А., Пушкарева Н.А., Семенов А.В. Сравнительный анализ методов отбора проб смывов с объектов внешней среды для оценки вирусно-бактериальной контаминации. Здоровье населения и среда обитания – ЗНиСО. 2023;31(4):77-84. https://doi.org/10.35627/2219-5238/2023-31-4-77-84
For citation:
Smirnova S.S., Zhuikov N.N., Egorov I.A., Pushkareva N.A., Semenov A.V. Comparative Analysis of Methods of Environmental Surface Sampling for Assessment of Viral and Bacterial Contamination. Public Health and Life Environment – PH&LE. 2023;31(4):77-84. (In Russ.) https://doi.org/10.35627/2219-5238/2023-31-4-77-84









.png)



























