Перейти к:
Молекулярно-генетический мониторинг как компонент эпидемиологического надзора за гепатитом С
https://doi.org/10.35627/2219-5238/2022-30-11-76-81
Аннотация
Введение. Вирус гепатита С характеризуется высокой степенью спонтанных мутаций и генетической гетерогенностью. На территории России генотипическая структура значительно различается в зависимости от региона, что является отражением автономности эпидемического процесса гепатита С.
Цель исследования: изучение и анализ разнообразия генетических вариантов вируса гепатита С, циркулирующих в Нижнем Новгороде в современный период.
Материалы и методы. Ретроспективный эпидемиологический анализ заболеваемости гепатитом С на территории Нижегородской области проведен на основе официальных статистических данных. Из банка сывороток крови отобрано 142 254 образца от лиц, проходивших обследование на догоспитальном этапе и при поступлении в стационары неинфекционного профиля. Лабораторное исследование включало определение маркеров инфицирования вирусом гепатита С: анти-ВГС классов иммуноглобулинов M и G, антител к структурному и неструктурным белкам. Часть серопозитивных образцов исследована на наличие геномной РНК ВГС с последующим генотипированием вируса методом ОТ-ПЦР в режиме Real Time.
Результаты. В Н. Новгороде установлена тенденция к стабилизации заболеваемости острым гепатитом С и формирование выраженной тенденции к снижению заболеваемости впервые выявленного хронического гепатита С. По результатам проведенного серологического исследования превалентность анти-ВГС составила 3,1 ± 0,1 на 100 обследованных. Распространенность РНК ВГС среди взрослого населения составила 1,9 ± 0,1 %, пиковых значений показатель достигал в возрастной группе 40–49 лет. В профиле распределения генотипов с одинаковой долей доминировали субтипы 1b и 3а, минорными являлись субтип 1a и генотип 2, микст-варианты.
Заключение. Внедрение современных достижений молекулярно-генетической диагностики в систему эпидемиологического надзора за гепатитом С определяется актуальностью проведения комплексного обследования лиц с инфекцией гепатита С с целью мониторинга циркуляции генотипов/субтипов вируса гепатита С, понимания эволюции и эпидемиологических особенностей инфекции на различных территориях.
Ключевые слова
Для цитирования:
Кашникова А.Д., Быстрова Т.Н., Полянина А.В., Залесских А.А. Молекулярно-генетический мониторинг как компонент эпидемиологического надзора за гепатитом С. Здоровье населения и среда обитания – ЗНиСО. 2022;1(11):76-81. https://doi.org/10.35627/2219-5238/2022-30-11-76-81
For citation:
Kashnikova A.D., Bystrova T.N., Polyanina A.V., Zalesskikh A.A. Genetic Monitoring as a Component of Hepatitis C Surveillance. Public Health and Life Environment – PH&LE. 2022;1(11):76-81. (In Russ.) https://doi.org/10.35627/2219-5238/2022-30-11-76-81
Введение. По данным Всемирной организации здравоохранения (ВОЗ), более 170 млн человек имеют маркеры вируса гепатита С (ВГС), ключевой характеристикой которого является высокая степень спонтанных мутаций и, как следствие, генетическая гетерогенность, что влияет на частоту хронизации инфекции, тяжесть течения болезни и ее дальнейшее прогрессирование, а также затрудняет создание эффективного средства специфической профилактики [1–5]. По официальным данным, экономические затраты, связанные с гепатитом С (ГС) в РФ в 2020 году, превысили 13,6 миллиарда рублей1 . В своем послании Федеральному собранию от 21 апреля 2021 г. президент РФ после обсуждения ситуации с новой коронавирусной инфекцией обозначил приоритетность решения проблемы ГС-инфекции. Повсеместное распространение, преимущественно бессимптомное течение, исключительно высокая частота хронизации (до 75–83 %) с возможным переходом в цирроз (26–35 %) и первичный рак печени (30–40 %) определяют социально-экономическое бремя ГС [3][6–8].
В 2016 г. ВОЗ приняла «Глобальную стратегию сектора здравоохранения по вирусному гепатиту», целью которой является элиминация вирусного гепатита как проблемы общественного здравоохранения. В задачах, ориентированных на максимальное увеличение охвата населения скрининг-диагностикой на ГС-инфекцию, отражены целевые показатели «Стратегии» – охват к 2030 г. должен составить до 90 % населения. Для оценки нагрузки ГС-инфекции на популяцию рекомендуется проводить сероэпидемиологические исследования среди условно здорового населения, что позволяет определять динамические изменения в превалентности ГС и устанавливать наиболее пораженные группы населения [2]. Последние исследования показали высокую распространенность ГС среди лиц 30–49 лет в европейском регионе, что актуализирует необходимость расширения стратегий скрининга инфекции.
В современный период применяется классификация ВГС, которая основывается на области генома, кодирующей белок NS5b, и позволяет определить 8 генотипов вируса (номенклатура P. Simmonds et al.), более 89 субтипов и 9 межгенотипных рекомбинантных форм. Согласно данной классификации генотипы ВГС обозначены арабскими цифрами от 1 до 8, а субтипы – буквами латинского алфавита [1][9–12].
Накопленные к настоящему времени данные указывают на значительную роль генотипа ВГС в течении и исходах заболевания. Установлено, что ВГС 3-го генотипа является фактором, способствующим развитию стеатоза печени, ускоренному формированию и прогрессированию фиброза печени, развитию гепатоцеллюлярной карциномы в исходе заболевания достоверно чаще, чем у инфицированных ВГС 1, 2 или 4-го генотипов [13][14]. Определение генотипической принадлежности ВГС также играет важную роль при выборе тактики проводимой терапии. По данным литературы, пациенты, инфицированные ВГС субтипа 1b, хуже отвечают как на интерфероновую терапию, так и на терапию некоторыми препаратами прямого противовирусного действия (ПППД), в отличие от пациентов, инфицированных ВГС генотипов 2 и 3 [15][16].
Молекулярно-эпидемиологические исследования распространенности генотипов ВГС установили географические различия в их циркуляции. В большинстве стран доминирует 1-й генотип с превалированием 1b субтипа. Генотип 2 имеет более ограниченное распространение, но широко представлен в странах Азии, Центральной Латинской Америки, Западной Африки. Генотип 3 наиболее распространен в Таиланде, Северной Европе и Австралии. В странах Северной и Центральной Африки превалирует 4-й генотип [17–19].
Несмотря на то что действующая в России система эпидемиологического надзора (ЭН) за ГС позволяет отслеживать все параметры мониторинга для получения объективного представления эпидемиологической ситуации, информация о распределении генотипов на отдельных территориях весьма ограничена.
По материалам ЦНИИЭ Роспотребнадзора, на территории РФ циркулируют 4 субтипа вируса – 1a, 1b, 2 и 3a. Согласно данным автоматизированнойинформационной системы «Вирусные гепатиты», в 2019 г. сохраняется доминирование субтипа 1b, его доля в генотипической структуре составляет до 46,9 %. Сообщается также об увеличении доли 3-го генотипа ВГС с 40,2 до 42,1 %. Менее распространенными являются генотип 2 (8,4 %) и субтип 1a (2,6 %). Другие исследования, проведенные на территории РФ, подтверждают превалирование 1b и 3а субтипов ВГС [20–23].
Высокая генетическая вариабельность вируса и особенности распределения генотипов между территориями и социальными группами диктуют необходимость углубленного изучения закономерностей распространения ВГС среди населения РФ и установления взаимосвязи между генетической структурой вируса и различными проявлениями автономности эпидемического процесса инфекции.
Цель: изучение и проведение анализа разнообразия генетических вариантов вируса гепатита С, циркулирующих в г. Н. Новгороде в современный период.
Материалы и методы. Ретроспективный эпидемиологический анализ заболеваемости ГС проведен на основе официальных статистических данных ФБУЗ «Центр гигиены и эпидемиологии по Нижегородской области» (форма № 2). Анализ заболеваемости острым ГС (ОГС) проведен с момента регистрации (с 1994 по 2020 г.) Заболеваемость впервые выявленным хроническим ГС (ХГС) рассмотрена за период с 1997 по 2020 г., начиная с момента официальной регистрации.
Для определения объективной распространенности ВГС среди населения региона из банка сывороток крови отобрано 142 254 образца от лиц, проходивших обследование на догоспитальном этапе и при поступлении в стационары неинфекционного профиля в период с 2013 по 2020 г. В исследование были включены лица возрастных групп: дети до 1 года, 1–2, 3–6, 7–14, 15–19, 20–29, 30–39, 40–49, 50–59 и старше 60 лет. Лабораторное исследование включало определение маркеров инфицирования ВГС: анти-ВГС классов иммуноглобулинов M и G, антитела к структурному (core) и неструктурным (NS3, NS4, NS5) белкам ВГС, которые были исследованы методом ИФА с помощью коммерческих тест-систем производства АО «ВекторБест» (р.п. Кольцово, Новосибирская обл.). Для выявления активной инфекции серопозитивные образцы исследованы на наличие геномной РНК ВГС (n = 978) с последующим генотипированием вируса (n = 348) методом ОТ-ПЦР в режиме Real Time. Качественное выявление и генотипирование РНК ВГС осуществлялось наборами реагентов «АмплиСенс HCV-Мониторинг-FL» и «АмплиСенс HCV-генотип-FL, вариант FRT-g1-6» (ФБУН «ЦНИИ эпидемиологии» Роспотребнадзора, Москва) с помощью прибора Rotor Gene-6000 (Германия). Для выявления динамических изменений в генотипической структуре установлена доля различных субтипов ВГС в 2013–2020 гг. по сравнению с временными периодами 2001–2006 и 2007–2014 гг. Для статистической обработки результатов (показатель средних величин – М, стандартная ошибка средних величин – m, t-критерий Стьюдента (различия считали достоверными при 0,95 % (p < 0,05)) применялась прикладная программа Microsoft Excel 2010 и персональный компьютер.
Результаты исследования. В результате анализа многолетней динамики регистрируемой заболеваемости различными формами ГС в Нижнем Новгороде установлена тенденция к стабилизации заболеваемости ОГС (Т = –0,11) с 2002 г. и формирование выраженной тенденции к снижению заболеваемости впервые выявленного ХГС (Т = –8,8) с 2014 г. На протяжении всего периода наблюдения в Н. Новгороде, как в целом по РФ, отмечен рост соотношения между показателями острой и хронической форм инфекции (с 1 : 0,7 в 1997 г. до 1 : 33,1 в 2020 г. и с 1 : 0,5 в 1997 г. до 1 : 30,9 в 2020 г. соответственно). В современный период (2016–2020 гг.) показатель заболеваемости впервые выявленным ХГС в 28,5 раза превышает аналогичный показатель при ОГС. Предполагается, что сохранение показателей заболеваемости ХГС на высоком уровне в настоящее время является следствием инфицирования ВГС, которое произошло 10–15 лет назад и привело к развитию хронической инфекции, выявляемой сейчас [24].
В Н. Новгороде с 1997 г. зарегистрировано более 13 тысяч случаев носительства и более 21 тысячи случаев ХГС, что составляет 2,5 % от среднегодовой численности населения. В структуре пораженности ГС-инфекцией доминировали лица старше 17 лет, на долю которых приходилось 80 % случаев ОГС и 98 % случаев ХГС. Кумулятивный показатель заболеваемости ГС (ОГС, ХГС и носительство) в 2020 г. составил 2870,1 ‰oo.
Для изучения распространенности латентного компонента эпидемического процесса ГС-инфекции проведен комплексный анализ результатов лабораторного обследования населения исследуемой территории.
По результатам проведенного исследования превалентность анти-ВГС в группе условно здорового населения в среднем составила 3,1 ± 0,1 на 100 обследованных (рис. 1).
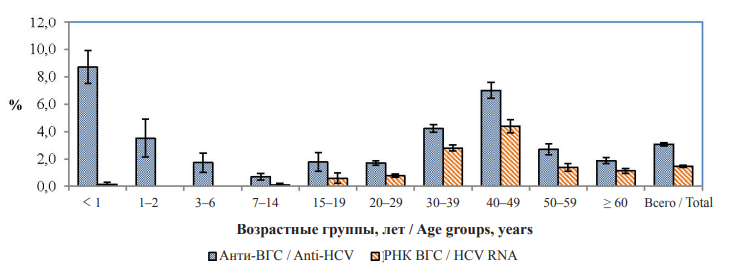
Рис. 1. Частота выявления анти-ВГС и РНК ВГС в различных возрастных группах среди совокупного населения
Н. Новгорода в 2013–2020 гг.
Fig. 1. Prevalence of anti-HCV and HCV RNA in different age groups of the general population
of Nizhny Novgorod in the years 2013–2020
Обращает на себя внимание высокая частота обнаружения анти-ВГС в группе детского населения, особенно среди детей до 1 года (8,7 ± 0,8 %), что связано с возможной реализацией вертикального пути передачи и циркуляцией трансплацентарных материнских антител до 1,5 года, что соответствует данным литературы [25]. Обнаружение анти-ВГС в старших возрастных группах при отсутствии РНК ВГС ассоциируется, как правило, с перенесенной активной инфекцией [26].
Наибольшее количество серопозитивных лиц среди взрослых выявлено в возрастных группах 30–39 и 40–49 лет (4,2 ± 0,3 и 7,0 ± 0,6 % соответственно), что демонстрирует высокую распространенность инфекции среди трудоспособного населения репродуктивного возраста.
Проведенные молекулярно-генетические исследования демонстрируют значительную частоту обнаружения РНК ВГС среди совокупного населения. Случаи активной ВГС-инфекции среди обследованных лиц выявлены во всех возрастных группах, кроме детей 2–6 лет. Рост инфицированности ВГС зарегистрирован среди детей в возрасте 7–14 лет, что подтверждалось выявлением РНК ВГС у 0,1 % обследованных. В более старших возрастных группах наблюдался достоверный рост показателей выявления маркеров текущей инфекции начиная с возрастной группы 30–39 лет (2,8 ± 0,2 %, р < 0,05). Максимальных значений показатель выявления РНК ВГС достигал в возрастной группе 40–49 лет (4,4 ± 0,5 %, p < 0,05). Распространенность среди взрослого населенияв целом составила 1,9 ± 0,1 %, что в 9,5 раза выше, чем среди детского населения (0,2 ± 0,1 %).
Частота обнаружения РНК ВГС среди взрослого анти-ВГС серопозитивного населения в среднем составила 58,5 ± 3,2 %, что соответствует полученным ранее данным [19]. Достоверной разницы по изучаемому параметру между возрастными группами не обнаружено (p < 0,05). При анализе половозрастных особенностей выявлено, что РНК ВГС у лиц в возрасте старше 50 лет несколько реже определялось среди женщин (43 % у женщин против 64 % у мужчин, p > 0,05).
Проведенное генотипирование РНК-позитивных образцов показало, что генотипическое разнообразие ВГС на территории Н. Новгорода представлено 4 геновариантами – 1, 2, 3 и 5-м, причем генотип 5 был выявлен в единичном случае. В профиле распределения генотипов ВГС с одинаковой долей доминировали субтипы 1b и 3а, частота встречаемости которых составляла 40,2 ± 3,1 и 38,1 ± 3,1 % соответственно. Минорными являлись субтип 1a (5,9 ± 2,4 %) и генотип 2 (6,7 ± 2,5 %). Образцы, содержащие одновременно два генотипа (микст-вариант) составили 3,5 ± 1,0 %. Все комбинации представляли собой различное сочетание субтипов 1-го генотипа и других геновариантов ВГС: 1а/1b – 1,3 ± 1,2 %, 1а/2 – 0,3 ± 1,5 %, 1а/3a – 0,5 ± 0,7 %, 1b/2 – 1,1 ± 1,0 %, 1b/3a – 0,3 ± 0,5 %. Комбинация 2-го и 3-го генотипов ВГС не встречалась. Негенотипируемые образцы составили 5,6 ± 1,2 %.
Сравнительная характеристика полученных результатов исследований, выполненных на территории Нижегородской области в 2001–20062 и 2007–2012 гг., свидетельствует об увеличении доли субтипа 1а и генотипа 2 в 2000-х гг., постепенном уменьшение доли субтипов 1b и 3a, что отражает изменения в структуре генотипов, циркулирующих на исследуемой территории на протяжении последних двадцати лет [27] (рис. 2).
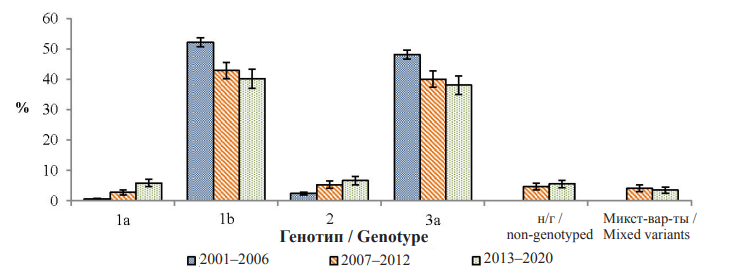
Рис. 2. Динамические изменения генотипического разнообразия ВГС на территории Н. Новгорода в 2001–2006,
2007–2012 и 2013–2020 гг.
Fig. 2. Dynamic changes in the HCV genotype structure in the city of Nizhny Novgorod in 2001–2006,
2007–2012, and 2013–2020
В генотипической структуре ВГС с 2001 г. стабильно превалируют субтипы 1b и 3a. Обращает на себя внимание значительное увеличение частоты обнаружения субтипа 1а (с 0,7 ± 0,2 % в 2001–2006 гг. до 5,9 ± 2,4 % в 2013–2020 гг.) и генотипа 2 (с 2,4 ± 0,4 % в 2001–2006 гг. до 6,7 ± 2,5 % в 2013–2020 гг.) среди РНК-положительных проб.
Разделение изучаемой группы населения по гендерному и возрастному признакам позволило выявить некоторые различия в структуре генотипов/субтипов ВГС. При анализе генотипической структуры среди различных возрастных групп установлен рост доли 1b субтипа с увеличением возраста инфицированных лиц (с 38 до 67 %) и снижение доли субтипа 3a (с 31 до 13 %). Субтип 1а в равной степени выявлялся в возрастных группах 20–29 и 30–39 лет и не был обнаружен у лиц старше 50 лет.
Среди лиц женского пола старше 30 лет достоверно чаще, чем у мужчин, детектировался субтип 3а (45,7 ± 7,7 против 28,8 ± 8,2 %, p < 0,05).
Обсуждение. Снижение заболеваемости острой и хронической формами ГС-инфекции, отмеченное в Н. Новгороде в последние годы, совпадает с общероссийской тенденцией. Однако превалирование хронической формы инфекции над острой (0,8 ‰oo при ОГС против 26,5 ‰oo при ХГС в 2020 г.) и ежегодная регистрация значительного количества случаев впервые выявленного ХГС свидетельствуют о сохранении высоких темпов накопления источников инфекции в популяции и определяют неблагоприятный прогноз развития эпидемиологической ситуации по ГС в будущем.
Результаты проведенного молекулярно-эпидемиологического исследования продемонстрировали значительную степень пораженности ВГС взрослого населения Н. Новгорода, что позволило отнести регион к территориям с высокой активностью ЭП ГС. Высокая частота обнаружения маркеров инфицирования ВГС среди лиц 30–49 лет, согласно имеющимся моделям передачи ВГС, позволяет отнести Н. Новгород к территориям, для которых характерна модель, когда доминирующим фактором риска передачи инфекции являлась инъекционная наркомания среди лиц, заразившихся 20–30 лет назад, что соответствует данным, полученным другими исследователями на территории России [28][29].
Структура генотипов/субтипов ВГС, циркулирующих среди населения Н. Новгорода, соответствовала данным отечественных исследований, согласно которым наиболее распространенными являлись субтипы ВГС 1b и 3а. Увеличение частоты обнаружения субтипа 1а и генотипа 2 на изучаемой территории, возможно, связано с многократным импортированием и дальнейшим распространением новых штаммов ВГС из Европы и стран Азии [1][30].
Заключение. Внедрение современных достижений молекулярно-генетической диагностики в систему ЭН за ГС определяется актуальностью проведения комплексного обследования лиц с ГС-инфекцией с целью мониторинга циркуляции генотипов/субтипов ВГС, понимания эволюции и эпидемиологических особенностей инфекции на различных территориях, что, в свою очередь, позволяет проводить оперативный эпидемиологический анализ, учитывать особенности распространения ВГС в различных когортах и выявлять группы риска инфицирования. Целенаправленные исследования должны быть ориентированы на изучение изменений распространенности генотипов/субтипов ВГС на фоне современного лечения, а также оценку различий в ответе субтипов на существующие схемы терапии ПППД, особенно с учетом специфических для субтипов полиморфизмов.
1. О состоянии санитарно-эпидемиологического благополучия населения в Российской Федерации в 2020 году: Государственный доклад. М.: Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека, 2021. 256 с.
2. Мазепа В. Н. Оптимизация и комплексное использование полимеразной цепной реакции в диагностике актуальных инфекционных заболеваний на модели острых кишечных, хеликобактерной, менингококковых урогенитальных инфекций и вирусных гепатитов: автореф. ... д-ра биол. наук: 03.02.03. Москва, 2010.
Список литературы
1. Николаева Л.И., Лейбман Е.А., Сапронов Г.В. Эволюция и изменчивость вируса гепатита С и особенности современной лабораторной диагностики маркеров гепатита С. Эпидемиология и Вакцинопрофилактика. 2015. Т. 14. № 3. С. 23–30. doi: 10.31631/2073-3046-2015-14-3-23-30
2. Калинина О.В. Вирус гепатита С: механизмы изменчивости, классификация, эволюция // Вопросы вирусологии. 2015. Т. 60. № 5. С. 5–10.
3. World Health Organization. Guidelines for the Screening, Care and Treatment of Persons with Chronic Hepatitis C Infection. Geneva: WHO; 2016. Accessed November 9, 2022. https://apps.who.int/iris/handle/10665/205035
4. Бедельбаева Г.Г. Внепеченочные проявления хронических заболеваний печени (обзор литературы) // Вестник Казахского Национального медицинского университета. 2012. № 1. С. 216–220.
5. Manns MP, Maasoumy B. Breakthroughs in hepatitis C research: from discovery to cure. Nat Rev Gastroenterol Hepatol. 2022;19(8):533-550. doi: 10.1038/s41575-022-00608-8
6. Макашова В.В., Понежева Ж.Б., Омарова Х.Г. и др. Исходы хронического гепатита С в зависимости от возраста больных // Инфекционные болезни. 2021. Т. 19. № 1. С. 105–109. doi: 10.20953/1729-9225-2021-1-105-109
7. Чуланов В.П., Городин В.Н., Сагалова О.И. и др. Бремя вирусного гепатита С в Российской Федерации: от реальной ситуации к стратегии // Инфекционные болезни. 2021. Т. 19. № 4. С. 52–63. doi: 10.20953/1729-9225-2021-4-52-63
8. Чурбакова О.В., Акимкин В.Г., Павлов В.В. и др. Эпидемиологическая обстановка в России и Самарской области по хроническому гепатиту С // Здоровье населения и среда обитания. 2020. № 11 (332). С. 72–77. doi: 10.35627/2219-5238/2020-332-11-72-77
9. Smith DB, Pathirana S, Davidson F, et al. The origin of hepatitis C virus genotypes. J Gen Virol. 1997;78(Pt 2):321-328. doi: 10.1099/0022-1317-78-2-321
10. Keikha M, Eslami M, Yousefi B, et al. HCV genotypes and their determinative role in hepatitis C treatment. Virusdisease. 2020;31(3):235-240. doi: 10.1007/s13337-020-00592-0
11. Borgia SM, Hedskog C, Parhy B, et al. Identification of a novel hepatitis C virus genotype from Punjab, India: Expanding classification of hepatitis C virus into 8 genotypes. J Infect Dis. 2018;218(11):1722-1729. doi: 10.1093/infdis/jiy401
12. Hedskog C, Parhy B, Chang S, et al. Identification of 19 novel hepatitis C virus subtypes – Further expanding HCV classification. Open Forum Infect Dis. 2019;6(3):ofz076. doi: 10.1093/ofid/ofz076
13. Бацких С.Н., Морозов С.В., Чуланов В.П., Покровский В.И. Вирус гепатита С 3-го генотипа: такой «простой», такой «сложный» // Терапевтический архив. 2012. Т. 84. № 11. С. 4–10.
14. Morozov VA, Lagaye S. Hepatitis C virus: Morphogenesis, infection and therapy. World J Hepatol. 2018;10(2):186-212. doi: 10.4254/wjh.v10.i2.186
15. Кравченко А.В., Куимова У.А., Ганкина Н.Ю., Канестри В.Г., Чуланов В.П. Предикторы устойчивого вирусологического ответа при терапии хронического гепатита С у больных ВИЧ-инфекцией // Инфекционные болезни. 2014. Т. 12. № 2. С. 30–35.
16. Rabaan AA, Al-Ahmed SH, Bazzi AM, et al. Overview of hepatitis C infection, molecular biology, and new treatment. J Infect Public Health. 2020;13(5):773-783. doi: 10.1016/j.jiph.2019.11.015
17. Daw MA, El-Bouzedi AA, Ahmed MO, Dau AA, Agnan MM, Drah AM. Geographic integration of hepatitis C virus: A global threat. World J Virol. 2016;5(4):170-182. doi: 10.5501/wjv.v5.i4.170
18. Messina JP, Humphreys I, Flaxman A, et al. Global distribution and prevalence of hepatitis C virus genotypes. Hepatology. 2015;61(1):77-87. doi: 10.1002/hep.27259
19. Kartashev V, Döring M, Nieto L, Coletta E, Kaiser R, Sierra S; HCV EuResist Study group. New findings in HCV genotype distribution in selected West European, Russian and Israeli regions. J Clin Virol. 2016;81:82-89. doi: 10.1016/j.jcv.2016.05.010
20. Котова В.О., Балахонцева Л.А., Базыкина Е.А., Троценко О.Е., Бельды В.Н., Кирдяшова С.Е. Генетическое разнообразие вируса гепатита С среди населения Нанайского района Хабаровского края // Инфекция и иммунитет. 2021. Т. 11. № 1. С. 148–156.
21. Богомолов П.О., Буеверов А.О., Мациевич М.В. и др. Эпидемиология гепатита C в Московской области: данные регионального регистра и скрининга на антитела к HCV // Альманах клинической медицины. 2016. Т. 44. № 6. С. 689–697. doi: 10.18786/2072-0505-2016-44-6-689-696
22. Кюрегян К.К., Исаева О.В., Кичатова В.С. и др. Распространенность маркеров гепатитов В и С среди условно здорового населения Калининградской области // Эпидемиология и Инфекционные болезни. Актуальные вопросы. 2020. Т. 10. № 4. С. 13–20. doi: 10.18565/epidem.2020.10.4.13-20
23. Соболева Н.В., Карлсен А.А., Кожанова Т.В. и др. Распространенность вируса гепатита С среди условно здорового населения Российской Федерации. Журнал инфектологии. 2017. Т. 9. № 2. С. 56–64. doi: 10.22625/2072-6732-2017-9-2-56-64
24. Михайлов М.И., Малинникова Е.Ю., Потемкин И.А. и др. Эпидемиология вирусных гепатитов // Журнал микробиологии. 2013. № 1. С. 78–85.
25. Syriopoulou V, Nikolopoulou G, Daikos GL, et al. Mother to child transmission of hepatitis C virus: Rate of infection and risk factors. Scand J Infect Dis. 2005;37(5):350-353. doi: 10.1080/00365540510032105
26. Polatti F, Viazzo F, Colleoni R, Belloni C, Zara F. Vertical transmission of hepatitis C virus and follow-up of newborns from infected mothers. Minerva Ginecol. 2000;52(3):59-62.
27. Михайлова, Ю.В., Быстрова Т.Н., Сутырина О.М. Молекулярно-эпидемиологическая характеристика гепатита С в группах высокого риска инфицирования лечебно-профилактических учреждений Нижнего Новгорода // Медицинский альманах. 2015. № 5 (40). С. 54–60.
28. Kamel MA, Miller FD, el Masry AG, et al. The epidemiology of Schistosoma mansoni, hepatitis B and hepatitis C infection in Egypt. Ann Trop Med Parasitol. 1994;88(5):501-509. doi: 10.1080/00034983.1994.11812897
29. Singh S, Kumar J, Singh R, Dwivedi SN. Hepatitis B and C viral infections in Indian Kala-Azar patients receiving injectable anti-leishmanial drugs: a community-based study. Int J Infect Dis. 2000;4(4):203-208. doi: 10.1016/s1201-9712(00)90110-3
30. Соболева Н.В. Распространенность вируса гепатита С среди условно здорового населения Российской Федерации: автореф. дис. ... канд. биол. наук. Москва; 2020. 25 с.
Об авторах
А. Д. КашниковаРоссия
Кашникова Анна Дмитриевна – младший научный сотрудник лаборатории эпидемиологии вирусных гепатитов
ул. Малая Ямская, д. 71, г. Нижний Новгород, 603950, Российская Федерация
Т. Н. Быстрова
Россия
Быстрова Татьяна Николаевна – д.м.н., профессор, ведущий научный сотрудник лаборатории эпидемиологии вирусных гепатитов
ул. Малая Ямская, д. 71, г. Нижний Новгород, 603950, Российская Федерация
А. В. Полянина
Россия
Полянина Анастасия Викторовна – к.м.н., ведущий научный сотрудник, заведующий лабораторией эпидемиологии вирусных гепатитов
ул. Малая Ямская, д. 71, г. Нижний Новгород, 603950, Российская Федерация
А. А. Залесских
Россия
Залесских Артем Александрович – к.м.н., старший научный сотрудник лаборатории эпидемиологии вирусных гепатитов
ул. Малая Ямская, д. 71, г. Нижний Новгород, 603950, Российская Федерация
Рецензия
Для цитирования:
Кашникова А.Д., Быстрова Т.Н., Полянина А.В., Залесских А.А. Молекулярно-генетический мониторинг как компонент эпидемиологического надзора за гепатитом С. Здоровье населения и среда обитания – ЗНиСО. 2022;1(11):76-81. https://doi.org/10.35627/2219-5238/2022-30-11-76-81
For citation:
Kashnikova A.D., Bystrova T.N., Polyanina A.V., Zalesskikh A.A. Genetic Monitoring as a Component of Hepatitis C Surveillance. Public Health and Life Environment – PH&LE. 2022;1(11):76-81. (In Russ.) https://doi.org/10.35627/2219-5238/2022-30-11-76-81









.png)



























