Перейти к:
Сравнительный анализ бактериальной микрофлоры, выделенной от больных пневмонией и из внешней среды в лечебных учреждениях Амурской области
https://doi.org/10.35627/10.35627/2219-5238/2022-30-7-48-56
Аннотация
Введение. Пандемия COVID-19 обострила проблему инфекций, связанных с оказанием медицинской помощи, в частности, ситуацию с распространением резистентных штаммов внутри стационаров с возможным развитием нозокомиальных инфекций.
Цели: сравнительный анализ бактериальной микрофлоры, выделенной от больных пневмонией и из внешней среды; оценка потенциальной опасности больничной среды в лечебных учреждениях Амурской области в плане риска внутрибольничного инфицирования.
Материалы и методы. В качестве госпитальных баз определены 2 лечебно-профилактических учреждения (ЛПУ): ЛПУ 1 (соматическая больница) и ЛПУ 2 («ковидный госпиталь»). В каждом учреждении проведено параллельное бактериологическое исследование клинических проб от больных и проб из внешней среды ЛПУ. Всего исследовано 519 проб мокроты от 284 больных и 486 проб из внешней среды ЛПУ при еженедельном заборе смывов в течение 12 недель наблюдения. Бактериологическое исследование выполнено классическим методом. Идентификация патогенов и определение их чувствительности к антимикробным препаратам (АМП) проводили с помощью баканализаторов AutoSCAN-4 и Vitek® 2 Compact 30.
Результаты. Наряду с выявлением в 33,8 % случаев патогенной бактериальной флоры, у больных пневмонией определен высокий уровень обнаружения патогенов из внешней среды ЛПУ 1 и ЛПУ 2 (23,3 –12,4 %). В структуре патогенов, выделенных из внешней среды, клинически значимые грамотрицательные бактерии составляют 44,9–15,4 %, соответственно ЛПУ с долей возбудителей с множественной лекарственной устойчивостью (МЛУ) 32,7–3,8 %. Выявленные различия могут быть связаны с более жестким режимом дезинфекции в ЛПУ 2. В структуре грамотрицательных изолятов с МЛУ отмечена высокая доля карбапенемустойчивых штаммов, выделенных как от больных (20,0 %), так и из внешней среды (38,9 %).
Выводы. Проведенный мониторинг позволил охарактеризовать состав и соотношение бактериальных возбудителей, выделяемых от больных пневмонией и из внешней среды. Широкий спектр возбудителей, в том числе с лекарственно-устойчивыми маркерами, выявляемых с высокой частотой в смывах с объектов больничной среды, и их накопление с течением времени свидетельствуют о потенциальной опасности больничной среды и риске внутрибольничного инфицирования.
Ключевые слова
Для цитирования:
Бондаренко А.П., Курганова О.П., Троценко О.Е., Бурдинская Е.Н., Натыкан Ю.А., Пшеничная Н.Ю., Огиенко О.Н. Сравнительный анализ бактериальной микрофлоры, выделенной от больных пневмонией и из внешней среды в лечебных учреждениях Амурской области. Здоровье населения и среда обитания – ЗНиСО. 2022;(7):48-56. https://doi.org/10.35627/10.35627/2219-5238/2022-30-7-48-56
For citation:
Bondarenko A.P., Kurganova O.P., Trotsenko O.E., Burdinskaya E.N., Natykan Yu.A., Pshenichnaya N.Yu., Ogienko O.N. Comparative Analysis of Bacterial Microflora Isolated from Adult Pneumonia Inpatients and Hospital Objects in the Amur Region. Public Health and Life Environment – PH&LE. 2022;(7):48-56. (In Russ.) https://doi.org/10.35627/10.35627/2219-5238/2022-30-7-48-56
Введение. В период пандемии новой коронавирусной инфекции (НКИ) бесконтрольное потребление антибиотиков привело к нарастанию антибиотикорезистентности бактериальных возбудителей пневмоний, быстрому их распространению в больничной среде и за ее пределами и формированию условий для нозокомиальных инфекций [1]. Массовому использованию антибиотиков способствовал тот факт, что их применение было предусмотрено первоначальными протоколами лечения COVID-19 при отсутствии критериев их назначения при этой инфекции. По данным В.Г. Акимкина и соавт. (2021 г.), 68,9 % пациентов с COVID-19 использовали антибиотики до госпитализации, при этом уровень самолечения составил 33,0 % [1]. По сообщению Э.А. Ортенберга, реальная необходимость назначения АМП отмечается лишь для 6–8 % пациентов, у которых развиваются бактериальные осложнения [2]. Неправильное использование антимикробных препаратов (АМП) в период пандемии НКИ привело к дополнительному косвенному прессингу, способствуя отбору устойчивых к антибиотикам форм бактерий за счет гибели чувствительных к АМП вариантов, что создает предпосылки для формирования лекарственной устойчивости основных видов микроорганизмов, циркулирующих в стационарах. Нерациональное применение АМП коснулось группы препаратов широкого спектра действия и также препаратов резерва (имипенема, меропенема) как в стационарах, так и в амбулаторной практике, что привело к формированию возбудителей, устойчивых к карбапенемам.
Условия пандемии COVID-19 были связаны с распространением вирусной инфекции. Тем не менее эта ситуация оказала существенное влияние на ускорение темпов селекции штаммов бактерий с множественной лекарственной устойчивостью [3]. Она также обострила проблему инфекций, связанных с оказанием медицинской помощи (ИСМП), в частности проблему распространения устойчивых штаммов внутри стационаров с возможным развитием нозокомиальных инфекций [4][5].
Больничный стационар представляет собой специфическую экологическую нишу, в которой непрерывно происходит селекция штаммов, способных конкурировать с другими микроорганизмами и формировать госпитальные клоны с высоким эпидемическим потенциалом и свойством длительно сохраняться и накапливаться в больничной среде [6].
Подавляющее большинство ИСМП развивается в результате колонизации локусов пациентов и медицинского персонала госпитальными клонами возбудителей. Основным резервуаром возбудителей является организм пациента, в котором происходит селекция и накопление эпидемических вариантов возбудителей [7].
Особенностью исследований, выполненных в период пандемии НКИ, является выделение от тяжелых больных отделений реанимации и интенсивной терапии (ОРИТ), с разнообразными формами респираторной поддержки, карбапенемустойчивых патогенных биологических агентов (ПБА) [8]. Именно эти больные впоследствии становятся «резервуаром» антибиотикорезистентных возбудителей, а в ОРИТ формируются условия для нозокомиальных инфекций [9].
В период пандемии многие лечебные учреждения, изначально не предназначенные для госпитализации инфекционных больных, были перепрофилированы в «ковидные» стационары. Как показал опыт, именно в этих учреждениях велика вероятность возникновения очагов внутрибольничных инфекций, чему способствуют экстренный характер оказания медицинской помощи, высокая загрузка отделений интенсивной терапии, привлечение к работе персонала без опыта трудовой деятельности в инфекционных стационарах [10].
В этой связи следует отметить высокий профессиональный риск заражения медицинских работников – наиболее уязвимой и активно вовлекаемой в эпидемический процесс НКИ группы населения [11][12]. Закономерности, выявленные для НКИ, являются актуальными и для бактериальных инфекций. Как следует из анализа результатов анонимного анкетирования медицинских работников, проведенного в мае – июне 2020 г. в Екатеринбурге, среди 1872 участников опроса коронавирусную инфекцию уже перенес 161 человек (8,6 %). Риск заражения был выше у среднего и младшего медицинского персонала и особенно высок при выполнении манипуляций, связанных с генерацией аэрозоля (интубация, трахеостомия). Показано, что работа с биологическим материалом пациентов повышает риск инфицирования в 2,07 раза, контакт с поверхностями в окружении больного (кровать, тумбочка, постельное белье, личные вещи пациента) увеличивает риск инфицирования в 2,58 раза [13].
В исследовании, проведенном в Великобритании, установлена высокая заболеваемость COVID-19 среди сотрудников клининговых служб больниц, а самая низкая – среди сотрудников, работающих в отделениях интенсивной терапии [14]. Это свидетельствует, с одной стороны, о загрязненности объектов больничной среды, с другой – о важности соблюдения мер инфекционной безопасности и подготовленности персонала к условиям работы с высоким риском инфицирования.
Возбудителями инфекций, связанных с оказанием помощи, чаще становятся грамотрицательные бактерии (Klebsiella pneumoniae, Acinetobacter baumannii, Pseudomonas aeruginosa, Stenotrophomonas maltophilia). Селекция антибиотикоустойчивых изолятов, обладающих различными механизмами резистентности, более выражена у грамотрицательных микроорганизмов, чем у грамположительных [15][16]. Всесторонний микробиологический мониторинг этих микроорганизмов, выявление особенностей распределения их во внутрибольничной среде и среди пациентов в каждом больничном учреждении является основанием для организации стратегии инфекционного контроля [17].
Так, известно, что одной из отличительных особенностей Acinetobacter baumannii является способность сохранять жизнеспособность в течение длительного времени на поверхностях, что способствует их распространению в лечебных учреждениях. Было показано: если в больничной палате есть больной – выделитель Acinetobacter baumannii, то в 39 % случаев палата такого пациента контаминирована этим патогеном [18]. При контакте персонала с больными, инфицированными лекарственно-устойчивыми штаммами A. baumannii, контаминация перчаток и халатов медперсонала составляла 38,7 %. Пребывание в палате больного более 5 минут является независимым фактором риска инфицирования A. baumannii [19, 20].
Все это обосновывает необходимость дальнейшего изучения условий формирования и распространения этиологически значимых лекарственно-устойчивых вариантов возбудителей пневмоний, связанных с оказанием медицинской помощи (ИСМП).
Цель исследования – провести сравнительный анализ бактериальной микрофлоры, выделенной от больных пневмонией и из внешней среды, и с помощью методов микробиологического и эпидемиологического анализа дать оценку потенциальной опасности больничной среды в плане риска присоединения инфекций, связанных с оказанием медицинской помощи, у больных пневмонией в условиях стационаров Амурской области.
Материалы и методы. Исследование проведено в Амурской области в период с 21.12.2020 по 15.03.2021 в условиях реализации научно-исследовательской программы Роспотребнадзора «Особенности эпидемиологии, клиники и этиологии внебольничных пневмоний. Формирование этиологически значимых лекарственно-устойчивых вариантов бактериальных возбудителей пневмоний, связанных с оказанием медицинской помощи в период пандемии COVID-19». Наряду с изучением значимости лекарственноустойчивых вариантов бактериальных возбудителей в этиологии пневмонии, на базе двух госпиталей – ЛПУ 1 (соматическое отделение) и ЛПУ 2 («ковидный» госпиталь) – проведен отбор проб в динамике (еженедельно) в течение 12 недель наблюдения с объектов внешней среды в палатах, где находились обследуемые пациенты. При этом исследование организовано 6 циклами длительностью по две недели каждый.
В ФБУЗ «Центр гигиены и эпидемиологии в Амурской области» параллельно с исследованием 519 проб биологического материала от 284 пациентов (в том числе 285 проб от 151 пациента из ЛПУ 1 и 234 пробы от 133 пациентов из ЛПУ 2) отобрано и исследовано 468 проб внешней среды, в том числе 210 проб смывов с объектов внешней среды и 24 пробы воздуха в ЛПУ 1, 210 и 24 пробы соответственно в ЛПУ 2.
Бактериологическое исследование выполнено классическим методом. Идентификацию патогенов и определение их чувствительности к антимикробным препаратам (АМП) проводили с помощью баканализаторов Autoskan-4 и Vitek® 2 Compact 30.
Статистическая обработка осуществлялась с помощью программы Statistica 6.0. Анализ результатов проводился с использованием непараметрических методов статистической обработки (критерий хи-квадрат, в том числе с поправкой Йейтса, и точный критерий Фишера). Для получения данных рассчитывался доверительный интервал (95 % ДИ). В случае, если уровень значимости отличий составлял менее 0,05, разница между изучаемыми показателями считалась достоверной.
Результаты
Результаты исследования в ЛПУ 1. В табл. 1 представлен сравнительный анализ структуры патогенов, выявленных у больных ЛПУ 1 и из объектов внешней среды этого же стационара. ПБА в количестве 43 изолятов были выделены от 32 из 151 больного – 21,2 % (95 % ДИ: 14,7–27,7 %) в процессе их первичного и повторного обследования. Флора представлена 9 видами ПБА. Выделен 1 изолят классического возбудителя внебольничной пневмонии (ВП) – Streptococcus pneumoniae – 2,3 % (95 % ДИ: 0,0–8,9 %). Другая грамположительная флора составила 39,5 % (95 % ДИ: 24,9–54,2 %) – S. aureus, S. epidermidis, S. saprophyticus, Enterococcus faecalis. Лекарственно-устойчивых форм в этой группе возбудителей не выявлено.
В группе грамотрицательных энтеробактерий – 2 изолята Klebsiella pneumoniae с множественной лекарственной устойчивостью (МЛУ) – 4,7 % (95 % ДИ: 0,5–12,9 %).
Неферментирующие грамотрицательные бактерии (НГОБ) в структуре патогенов составили 2,3 % (95 % ДИ: 0,0–8,9 %), в их числе 1 изолят Pseudomonas aeruginosa. Большая часть изолятов представлена грибами рода Candida.
Частота выявления ПБА в смывах оказалась высокой – 49 положительных проб из 210 смывов – 23,3 % (95 % ДИ: 17,6–29,1 %), и даже превысила частоту выделения бактериальных возбудителей от пациентов – 21,2 % (95 % ДИ: 14,7–27,7 %). Микрофлора, выделенная в смывах, представлена 12 наименованиями ПБА, в том числе грамположительная флора – 5 наименованиями, грамотрицательная – 5 наименованиями, НГОБ – 2 наименованиями. В структуре возбудителей грамположительная флора, выделенная из смывов, составила 55,1 % (95 % ДИ: 41,2–69,0 %) и представлена только чувствительными к антибиотикам вариантами.
Грамотрицательные энтеробактерии составили 38,8 % (95 % ДИ: 25,1–52,4 %) положительных проб смывов, представлены 5 наименованиями и в основном лекарственно-устойчивыми вариантами (16 из 19 изолятов – 84,2 % (95 % ДИ: 64,9–96,7 %) – Klebsiella pneumoniae, Escherichia coli, Enterobacter cloacae и Citrobacter freundii). Без маркеров лекарственной устойчивости оказался только Enterobacter agglomerans. НГОБ составили 6,1 % (95 % ДИ: 1,2–14,5 %) в структуре возбудителей, выявленных в смывах (3 штамма из 49 изолятов), в том числе 1 штамм Acinetobacter baumannii с лекарственно-устойчивыми маркерами. При этом спектр возбудителей в смывах был шире, чем в клиническом материале, доля лекарственноустойчивых ПБА (17 штаммов среди 49 изолятов) составила в смывах 34,7 % (95 % ДИ: 21,3–48,0 %).
Исследование проб смывов в динамике в 8 палатах в ЛПУ 1 показало, что в первые 3 цикла наблюдения, с 1-й по 6-ю неделю, бактериальная контаминация выявлена в 21,1 % (95 % ДИ: 12,7–29,5 %) случаев – в 19 из 90 проб смывов, эпидемиологически значимые возбудители (Acinetobacter baumannii с МЛУ, Klebsiella pneumoniae с МЛУ, E. coli с МЛУ, Enterobacter cloacae с МЛУ) выделены в 4 из 90 проб – 4,4 % (95 % ДИ: 1,2–9,6 %), остальная микрофлора представлена антибиотикочувствительными вариантами S. aureus, S. epidermidis, Enterococcus faecalis, Enterobacter agglomerans.
В последующие 3 цикла наблюдения, с 7-й по 12-ю неделю, микрофлора выявлена в 25,0 % (95 % ДИ: 17,3–32,7 %) случаев – в 30 из 120 проб смывов, при этом с маркерами лекарственной устойчивости (Klebsiella pneumoniae с МЛУ, Enterobacter cloacae c MЛУ, Citrobacter freundii с МЛУ) – в 13 из 120 проб – 10,8 % (95 % ДИ: 5,3–16,4 %).
Следовательно, при динамическом наблюдении установлены не только значительное число больных пневмонией с выделением ПБА – 21,2 % (95 % ДИ: 14,7–27,7 %) случаев, но и широкая циркуляция бактерий в больничных палатах, при этом с течением времени зафиксировано накопление во внешней среде эпидемиологически значимых возбудителей с маркерами лекарственной устойчивости.
Таким образом, источниками контаминации внешней среды являются больные пневмонией и они же подвергаются бактериальному суперинфицированию из внешней среды. Опасность внешней больничной среды при отсутствии должного дезинфекционного режима заключена в сохранении и накоплении агрессивных ПБА.
При исследовании 24 проб воздуха бактериальная флора в ЛПУ 1 не была выявлена.
Результаты исследования в ЛПУ 2. Структура патогенов у больных пневмонией в сопоставлении со структурой ПБА, выделенных из внешней среды ЛПУ 2, представлена в табл. 2.
Итак, 78 изолятов ПБА были выделены от 64 из 133 обследованных больных пневмонией – 48,1 % (95 % ДИ: 39,6–56,6 %) в процессе их первичного и повторного обследования. Флора представлена 11 видами ПБА. Классический возбудитель пневмонией S. pneumoniae выделен у 1 больного, что занимает 1,3 % (95 % ДИ: 0,0– 5,0 %) случаев в структуре возбудителей. Другая грамположительная флора составляет 24,4 % (95 % ДИ: 14,8–33,9 %) – S. epidermidis c МЛУ, S. epidermidis, S. salivarius, E. faecalis.
В группе грамотрицательных энтеробактерий – 3 штамма K. pneumoniae c МЛУ – 3,8 % (95 % ДИ: 0,7–9,1 %). НГОБ представлены только одним изолятом Pseudomonas spp. – 1,3 % (95 % ДИ: 0,0–5,0 %). Большая часть изолятов представлена грибами рода Candida – 54 изолята – 69,2 % случаев (95 % ДИ: 59,0–79,5 %).
Частота выявления ПБА в смывах из внешней среды ЛПУ 2 (26 положительных проб из 210 смывов) составила 12,4 % (95 % ДИ: 20,7– 32,6 %). Микрофлора, выделенная в смывах, представлена 7 наименованиями ПБА, в том числе грамположительной флорой (22 штамма из 26 положительных проб – 84,6 % (95 % ДИ: 68,5–95,6 %) – S. epidermidis, S. saprophyticus, E. faecalis, E. faecium), грамотрицательными энтеробактериями – 2 штамма – 7,7 % (95 % ДИ: 0,8–20,8 %) – E. cloacae с МЛУ и E. agglomerans, НГОБ – 2 штамма – 7,7 % (95 % ДИ: 0,8–20,8 %). Таким образом, лекарственно-устойчивые ПБА (E. cloacae с МЛУ) определены только в 1 случае из 26 положительных проб смывов, то есть в 3,8 % (95 % ДИ: 0,0–14,3 %).
Исследование проб смывов в динамике в 8 палатах ЛПУ 2 показало, что в первые 3 цикла (6 недель) наблюдения частота выявлений ПБА составила 14,4 % (95 % ДИ: 7,2–21,7) – из 90 смывов выделены 13 патогенов, в том числе E. cloacae с МЛУ. В последующие 3 цикла (с 4-го по 6-й цикл, 7–12-я недели) уровень выделений ПБА несколько снизился, составив 10,8 % (95 % ДИ: 5,3–16,4 %) – 13 положительных находок из 120 смывов, лекарственно-устойчивых штаммов не выделено.
Следует отметить, что нормативные документы по исследованию обсемененности объектов больничной среды не предусматривают поиски грибов р. Candida.
При исследовании 24 проб воздуха бактериальная флора в ЛПУ 2 не была выявлена. В целом, подводя итоги данному разделу исследований, следует констатировать отсутствие в ЛПУ 2 сходства между составом возбудителей, выявленных у больных и из внешней среды, хотя основными источниками инфекции для больничной среды являются больные, и уровень положительных находок ПБА в смывах довольно высокий (12,4 %; 95 % ДИ: 20,7–32,6 %). В условиях инфекционного госпиталя с усиленным дезинфекционным режимом большая часть ПБА, попадающих в больничную среду, обезвреживается, что, возможно, объясняет данную ситуацию. Но, как показали наши исследования, остается еще довольно широкий спектр микроорганизмов, выявляемых в смывах с достаточно высокой частотой, что свидетельствует о потенциальной опасности больничной среды.
Характеристика лекарственной устойчивости патогенов, выявленных от больных и из внешней среды двух стационаров – в ЛПУ 1 и ЛПУ 2
В целом по двум учреждениям в период выполнения исследований (декабрь 2020 года – март 2021 года) были выделены 24 культуры с множественной лекарственной устойчивостью (табл. 3). В том числе 6 культур – 25 % (95 % ДИ: 10,1–43,8 %) – выделены из образцов мокроты и 18 культур – 75 % (95 % ДИ: 56,2–89,9 %) – с объектов больничной среды. Обращает на себя внимание тот факт, что большая часть изолятов из внешней среды была выделена с санитарно-технического оборудования.
В смывах преобладали находки полирезистентной K. pneumoniae (8 из 18 штаммов) – 44,4 % (95 % ДИ: 22,8–67,1 %), на втором месте лекарственно-устойчивые E. cloacae (7 из 18 штаммов) – 33,3 % (95 % ДИ: 14,0–56,1 %).
В клиническом материале, аналогично смывам с объектов больничной среды, подавляющее большинство находок приходится также на полирезистентные K. pneumoniae – 83,3 % (95 % ДИ: 46,4–99,9 %) случаев.
Все 24 культуры фенотипически проявляли устойчивость к цефалоспоринам IV поколения и могли быть определены как штаммы ESBL (Extended Spectrum Beta-lactamases), и часть из них, 8 культур – 33,3 % (95 % ДИ: 16,3–53,0 %), были дополнительно устойчивы к карбапенемам (carb R) – 7 культур из внешней среды и 1 культура от больного.
Из 6 лекарственно-устойчивых культур, выделенных от больных, только 5 относятся к грамотрицательным ПБА, и только у одного из 5 штаммов – 20,0 % (95 % ДИ: 0,1–61,5 %) выявлена устойчивость к карбапенемам. При этом 4 культуры выделены от больных из ЛПУ 2, в том числе штамм с карбапенем-устойчивостью (carb R). Из 18 культур, выделенных из объектов внешней среды, в 7 случаях – 38,9 % (95 % ДИ: 18,3– 61,8 %) определена устойчивость к карбапенемам, в том числе 2 штамма K. pneumoniae, 2 штамма E. cloacae, 1 штамм E. coli, 1 штамм C. freundii и 1 штамм Acinetobacter baumannii. Большая часть carb R-штаммов (6 из 7) выделена в ЛПУ 1.
Таким образом, в двух стационарах отмечено следующее:
- в ЛПУ 1 высокая частота выделения патогенов с лекарственной устойчивостью из внешней среды (из 18 культур с МЛУ 17 выделены в ЛПУ 1 – 94,5 % (95 % ДИ: 79,7–99,9 %) и низкая частота выявления штаммов с лекарственно-устойчивыми маркерами от больных (2 штамма из 6);
- в ЛПУ 2 только 1 штамм из 18 лекарственно-устойчивых, выделенных в смывах, относился к этому стационару – 5,5 % (95 % ДИ: 0,0–20,3 %); но чаще, чем в ЛПУ 1, выявляли лекарственноустойчивые штаммы от больных (4 штамма из 6) – 66,7 % (95 % ДИ: 27,8–95,4 %).
Таблица 1. Сравнительный анализ видового разнообразия бактериальных культур, выделенных в мокроте больных пневмонией и в пробах внешней среды (в смывах с поверхностей) в ЛПУ 1 Амурской области
Table 1. Comparative analysis of bacteria isolated from sputum samples of adult pneumonia inpatients and wipe samples collected in Hospital 1 of the Amur Region
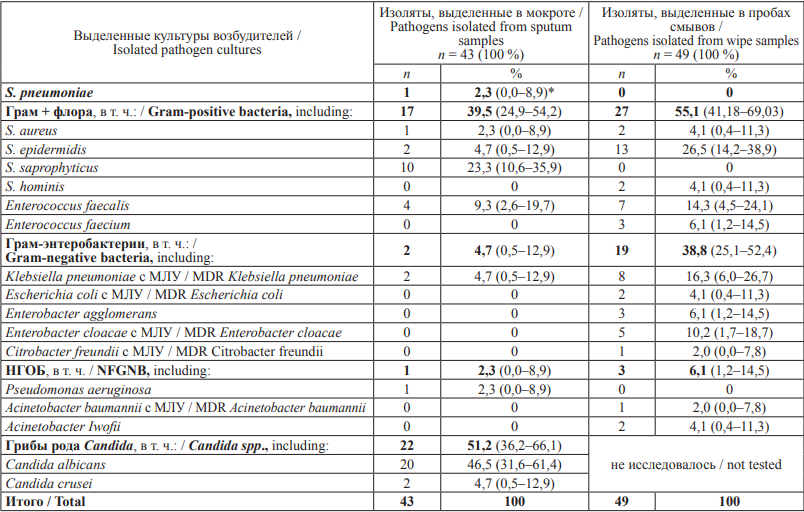
Примечание: НГОБ – неферментирующие грамотрицательные бактерии; МЛУ – множественная лекарственная устойчивость; * В скобках указан 95 % доверительный интервал.
Note: NFGNB, Non-fermenting Gram-negative bacilli; MDR, multidrug-resistant; * A 95 % confidence interval is shown in brackets.
Таблица 2. Сравнительный анализ видового разнообразия бактериальных культур, выделенных в мокроте больных пневмонией и в пробах внешней среды (в смывах с поверхностей) в ЛПУ 2 Амурской области
Table 2. Comparative analysis of bacteria isolated from sputum samples of adult pneumonia inpatients and wipe samples collected in Hospital 2 of the Amur Region
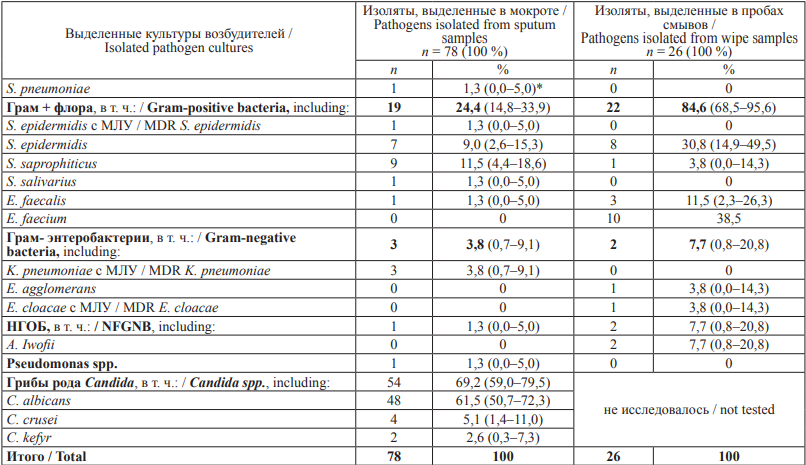
Примечание: НГОБ – неферментирующие грамотрицательные бактерии; МЛУ – множественная лекарственная устойчивость; * В скобках указан 95 % доверительный интервал.
Note: NFGNB, Non-fermenting Gram-negative bacilli; MDR, multidrug-resistant; * A 95 % confidence interval is shown in brackets.
Таблица 3. Характеристика 24 культур с множественной лекарственной устойчивостью, выделенных в клиническом материале (n = 6) и с объектов внешней среды (n = 18) в ЛПУ 1 и ЛПУ 2
Table 3. Characteristics of 24 multi-drug resistant pathogens isolated from six sputum samples of inpatients and 18 wipe samples of environmental objects in Hospitals 1 and 2
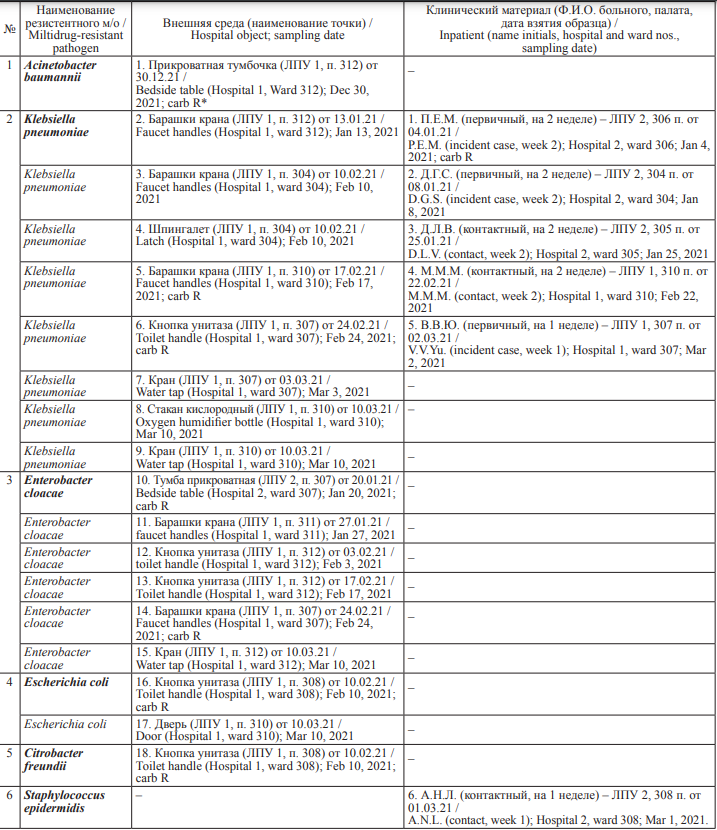
Примечание: *carb R – устойчивость к карбапенемам.
Note: *carb R, carbapenem resistant.
Обсуждение. Таким образом, при сравнительном анализе бактериальной микрофлоры, выделенной от больных пневмонией и из внешней среды в лечебных учреждениях Амурской области, установлено следующее.
В ЛПУ 1 (соматический стационар) уровни выделения ПБА от больных и из внешней среды были сходными: 21,2 % (95 % ДИ: 14,7–27,7 %) и 23,3 % (95 % ДИ: 17,6–29,1 %).
В ЛПУ 2 («ковидный» госпиталь) уровень выделения патогенов из мокроты больных был высоким – 48,1 % (95 % ДИ: 39,6–56,6 %). Уровень выделения ПБА из объектов внешней среды ЛПУ 2 был более низким по сравнению с ЛПУ 1 и составил 12,4 % (95 % ДИ: 20,7–32,6 %) случаев. Такая ситуация могла быть вызвана усиленным режимом дезинфекции в «ковидном» госпитале, а именно: увеличением кратности дезинфекции объектов окружающей среды стационара (через каждые 4 часа), ротацией дезинфицирующих препаратов (каждые три месяца), установлением строгого контроля за концентрацией активного вещества в рабочих растворах дезинфицирующих средств.
С одной стороны, положительные находки ПБА во внешней среде и в клиническом материале подтверждают факт возможного формирования и циркуляции резистентной микрофлоры как госпитального штамма в больничной среде. С другой стороны, нахождение пациентов на лечении в соматическом стационаре ЛПУ 1 и последующий их перевод (при установлении диагноза «Внебольничная пневмония», обусловленная SARS-CoV-2) в инфекционный госпиталь ЛПУ 2, вероятно, обеспечивает «кумуляцию» мультирезистентных штаммов в популяции пациентов ЛПУ 2.
В целом при обследовании внешней среды двух стационаров из 420 смывов было выделено 75 изолятов возбудителей – 17,9 % (95 % ДИ: 14,2–21,5 %).
При динамическом наблюдении за циркуляцией патогенов во внешней среде (с 1-й по 6-ю и с 7-й по 12-ю неделю) установлены не только широкая циркуляция патогенов в больничных палатах, но и накопление во внешней среде эпидемиологически значимых возбудителей.
Широкий спектр возбудителей, выявленных в смывах с объектов больничной среды с достаточно высокой частотой, свидетельствует о потенциальной опасности больничной среды и риске внутрибольничного инфицирования. Следует отметить значительную долю карбапенемрезистентных штаммов в составе возбудителей, выявляемых как от больных (20 %; 95 % ДИ: 0,1–61,5 % случаев), так и из смывов с объектов больничной среды (38,9; 95 % ДИ: 18,3–61,8 %).
Результаты выполненного исследования обосновывают роль следующих факторов формирования агрессивной госпитальной среды: низкий уровень этиологической расшифровки заболеваний; эмпирическая нерациональная антимикробная терапия; продолжительное нахождение больных в стационаре; непрерывное функционирование госпитальных баз (отсутствие систематической заключительной дезинфекции); неэффективный санитарно-бактериологический контроль больничных стационаров; формальный подход к выбору точек для отбора материала с объектов внешней среды и, как следствие, отсутствие контроля за проведением дезинфекционных мероприятий; отсутствие в должном объеме микробиологической диагностики каждого случая нозокомиальной пневмонии (исследование биологического материала из дыхательных путей, крови, при наличии плеврита – плевральной жидкости) с определением чувствительности возбудителя к антибактериальным препаратам [21].
Подтверждена необходимость проведения частого и регулярного микробиологического мониторинга в многопрофильных стационарах, а также в разных отделениях одного и того же стационара. Как показывает опыт работы в условиях пандемии COVID-19, территории госпиталей неоднородны по структуре выделенных микроорганизмов и уровню их чувствительности к АМП.
Тактика противодействия должна основываться на характеристике «локальных» микроорганизмов. Результаты микробиологического мониторирования станут еще более важными инструментами предотвращения роста резистентности к АМП внутри клиник и отделений [4].
Выводы
1. Преобладание в пробах из внешней среды и в клиническом материале Klebsiella pneumoniae с МЛУ свидетельствует о возможном формировании госпитальных штаммов и риске внутрибольничного инфицирования.
2. Установлено накопление в больничной среде резистентной микрофлоры в процессе длительного пребывания больного в стационаре.
3. Определена значительная доля карбапенемрезистентных штаммов с МЛУ, выявленных как от больных (20 %; 95 % ДИ: 0,1–61,5 % случаев), так и из смывов с объектов больничной среды (38,9; 95 % ДИ: 18,3–61,8 %).
4. Широкий спектр возбудителей, выявленный в смывах с объектов больничной среды с достаточно высокой частотой (23,3 и 12,3 % случаев соответственно ЛПУ 1 и ЛПУ 2), свидетельствует о потенциальной опасности больничной среды и риске внутрибольничного инфицирования.
Список литературы
1. Акимкин В. Г. Пандемия COVID-19: новый виток нарастания антибиотикорезистентности / В. Г. Акимкин [и др.] // Инфекционные болезни. – 2021. – Т. 19. – № 3. – С. 133–138. doi: 10.20953/1729-9225-2021-3-133-138
2. Ортенберг Э. А. Почти два года с COVID-19: некоторые аспекты использования антибиотиков / Э. А. Ортенберг // Клиническая микробиология и антимикробная химиотерапия. – 2021. – Т. 23. – № 3. – С. 248–253. doi: 10.36488/cmac.2021.3.248-253
3. Li J., Wang J., Yang Y., et al. Etiology and antimicrobial resistance of secondary bacterial infections in patients hospitalized with COVID-19 in Wuhan, China: A retrospective analysis. Antimicrob Resist Infect Control. 2020; 9 (1): 153. doi: 10.1186/s13756-020-00819-1
4. Ромашов О. М. Оценка резистентности микроорганизмов многопрофильного стационара и модернизация схем антимикробной терапии в условиях пандемии COVID-19 / О. М. Ромашов [и др.] // Клиническая микробиология и антимикробная химиотерапия. – 2021. – Т. 23. – № 3. – С. 293–303. doi: 10.36488/cmac.2021.3.293-303
5. Головерова Ю. А. Уровень заболеваемости инфекциями, связанными с оказанием медицинской помощи, в отделениях высокого эпидемиологического риска инфицирования / Ю. А. Головерова [и др.] // Инфекционные болезни. – 2019. – Т. 17. – № 3. – С. 69–73. doi: 10.20953/1729-9225-2019-3-69-73
6. Брико Н. И. Госпитальный штамм – непознанная реальность / Н. И. Брико [и др.] // Эпидемиология и вакцинопрофилактика. – 2013. – № 1 (68). – С. 30–35.
7. Чезганова Е. А. Дополнительный резервуар госпитальных микроорганизмов в медицинских организациях / Е. А, Чезганова [и др.] // Журнал микробиологии, эпидемиологии и иммунобиологии. – 2021. – Т. 98. – № 3. – С. 266–275. doi: 10.36233/0372-9311-120
8. Орлова О. А. Организация эпидемиологической диагностики вентилятор-ассоциированных инфекций дыхательных путей / О. А. Орлова, В. Г. Акимкин // Медицинский алфавит. – 2017. – Т. 3. – № 30 (327). – С. 5–19.
9. Руднов В. А. Современный портрет вентилятор-ассоциированной инфекции нижних дыхательных путей: этиология и проблемы диагностики / В. А. Руднов [и др.] // Клиническая микробиология и антимикробная химиотерапия. – 2021. – Т. 23. – № 1. – С. 17-25.
10. Гончаров А. Е. Распространение мультиантибиотикорезистентных возбудителей инфекций, связанных с оказанием медицинской помощи, в стационарах для лечения пациентов с COVID-19 / А. Е. Гончаров [и др.] // Эпидемиология и вакцинопрофилактика. – 2021. – Т. 20. – № 2. – С. 68–73. doi: 10.31631/2073-3046-2021-20-2-68-73
11. Hughes M. M., Groenewold M. R., Lessem S. E., et al. Update: Characteristics of health care personnel with COVID-19 – United States, February 12–July 16, 2020. MMWR Morb Mortal Wkly Rep. 2020; 69 (38): 1364-1368. doi: 10.15585/mmwr.mm6938a3
12. Treibel T. A., Manisty C., Burton M., et al. COVID-19: PCR screening of asymptomatic health-care workers at London hospital. Lancet. 2020; 395 (10237): 1608-1610. doi: 10.1016/S0140-6736(20)31100-4
13. Платонова Т. А. Заболеваемость COVID-19 медицинских работников. Вопросы биобезопасности и факторы профессионального риска // Т. А. Платонова [и др.] // Эпидемиология и вакцинопрофилактика. – 2021. – Т. 20. – № 2. – С. 4–11. doi: 10.31631/2073-3046-2021-20-2-4-11
14. Shields A., Faustini S. E., Perez-Toledo M., et al. SARS-CoV-2 seroprevalence and asymptomatic viral carriage in healthcare workers: A cross-sectional study. Thorax. 2020; 75 (12): 1089-1094. doi: 10.1136/thoraxjnl-2020-215414
15. Mehrad B., Clark N. M., Zhanel G. G., Lynch J. P. 3rd. Antimicrobial resistance in hospital-acquired gram-negative bacterial infections. Chest. 2015; 147 (5): 1413-1421. doi: 10.1378/chest.14-2171
16. Cerceo E., Deitelzweig S. B., Sherman B. M., Amin A. N. Multidrug-resistant gram-negative bacterial infections in the hospital setting: Overview, implications for clinical practice, and emerging treatment options. Microb Drug Resist. 2016; 22 (5): 412-431. doi: 10.1089/mdr.2015.0220
17. Маркелова Н. Н. Мониторинг возбудителей инфекций, связанных с оказанием медицинской помощи (pseudomonas aeruginosa, klebsiella pneumoniae, acinetobacter baumannii, stenotrophomonas maltophilia), в стационаре / Н. Н. Маркелова, Е. Ф. Семенова, А. В. Тутельян //Эпидемиология и инфекционные болезни. Актуальные вопросы. – 2019. – Т. 9. – № 2. – С. 68–74. doi: 10.18565/epidem.2019.9.2.68-74
18. Munoz-Price L. S., Namias N., Cleary T., et al. Acinetobacter baumannii: Association between environmental contamination of patient rooms and occupant status. Infect Control Hosp Epidemiol. 2013; 34 (5): 517-520. doi: 10.1086/670209
19. Morgan D. J., Liang S. Y., Smith C. L., et al. Frequent multidrug-resistant Acinetobacter baumannii contamination of gloves, gowns, and hands of healthcare workers. Infect Control Hosp Epidemiol. 2010; 31 (7): 716-721. doi: 10.1086/653201
20. Хрульнова С. А. Молекулярно-генетическое типирование Acinetobacter baumannii, выделенных из гемокультуры больных опухолями системы крови, методом ПЦР случайных полиморфных фрагментов ДНК / С. А. Хрульнова [и др.] // Эпидемиология и вакцинопрофилактика. – 2020. – Т. 19. – № 4. – С. 38–47. doi: 10.31631/2073-3046-2020-19-4-38-47
21. Попова А. Ю. Этиология внебольничных пневмоний в период эпидемического распространения COVID-19 и оценка риска возникновения пневмоний, связанных с оказанием медицинской помощи / А. Ю. Попова [и др.] // Здоровье населения и среда обитания. – 2021. – Т. 29. – № 7. – C. 67–75. doi: 10.35627/2219-5238/2021-29-7-67-75
Об авторах
А. П. БондаренкоРоссия
Альбина Павловна Бондаренко, к. м. н., ведущий научный сотрудник, зав. лабораторией
ФБУН «Хабаровский НИИ эпидемиологии и микробиологии»
лаборатория бактериальных инфекций
680610
ул. Шевченко, д. 2
Хабаровск
О. П. Курганова
Россия
Ольга Петровна Курганова, к. м. н., руководитель
Управление Роспотребнадзора по Амурской области
675002
ул. Первомайская, д. 30
Благовещенск
О. Е. Троценко
Россия
ФБУН «Хабаровский НИИ эпидемиологии и микробиологии»
680610
ул. Шевченко, д. 2
Хабаровск
Е. Н. Бурдинская
Россия
Екатерина Николаевна Бурдинская, заместитель главного врача
675002
ул. Первомайская, д. 30
Благовещенск
Ю. А. Натыкан
Россия
Юлия Александровна Натыкан, заведующая отделом
отдел обеспечения эпидемиологического надзора
675002
ул. Первомайская, д. 30
Благовещенск
Н. Ю. Пшеничная
Россия
Наталья Юрьевна Пшеничная, д. м. н., профессор, заместитель директора по клинико-аналитической работе
ФБУН «Центральный НИИ эпидемиологии»
111123
ул. Новогиреевская, д. 3а
Москва
О. Н. Огиенко
Россия
Ольга Николаевна Огиенко, младший научный сотрудник
ФБУН «Хабаровский НИИ эпидемиологии и микробиологии»
лаборатория бактериальных инфекций
680610
ул. Шевченко, д. 2
Хабаровск
Дополнительные файлы
Рецензия
Для цитирования:
Бондаренко А.П., Курганова О.П., Троценко О.Е., Бурдинская Е.Н., Натыкан Ю.А., Пшеничная Н.Ю., Огиенко О.Н. Сравнительный анализ бактериальной микрофлоры, выделенной от больных пневмонией и из внешней среды в лечебных учреждениях Амурской области. Здоровье населения и среда обитания – ЗНиСО. 2022;(7):48-56. https://doi.org/10.35627/10.35627/2219-5238/2022-30-7-48-56
For citation:
Bondarenko A.P., Kurganova O.P., Trotsenko O.E., Burdinskaya E.N., Natykan Yu.A., Pshenichnaya N.Yu., Ogienko O.N. Comparative Analysis of Bacterial Microflora Isolated from Adult Pneumonia Inpatients and Hospital Objects in the Amur Region. Public Health and Life Environment – PH&LE. 2022;(7):48-56. (In Russ.) https://doi.org/10.35627/10.35627/2219-5238/2022-30-7-48-56









.png)



























