Перейти к:
Результаты исследований генотоксических эффектов диоксинов в зависимости от полиморфизмов генов детоксикации ксенобиотиков и стажа работы пожарных
https://doi.org/10.35627/2219-5238/2022-30-5-65-75
Аннотация
Введение. Трудовая деятельность пожарных связана с высоким риском для здоровья и жизни. Во время пожаротушения пожарные подвергаются влиянию комплекса факторов различной природы, ведущее место среди которых занимает химический фактор. Среди токсичных продуктов горения наибольшую опасность представляют вещества, обладающие генотоксичностью, с высоким кумулятивным эффектом и очень длительным периодом выведения, в число которых входят диоксины и диоксиноподобные полихлорированные бифенилы, образующиеся при низкотемпературном горении хлорсодержащих органических соединений.
Цель исследования – изучение кариопатологических проявлений генотоксических эффектов диоксинов у пожарных в зависимости от стажа профессиональной деятельности и различных полиморфных вариантов генов детоксикации ксенобиотиков.
Материалы и методы. Оценку цитогенетического статуса пожарных проводили с помощью расширенного микроядерного теста буккального эпителия. В исследовании принимали участие 252 пожарных и 86 спасателей и лиц других профессий с 2019 по 2022 г. Оценку риска возникновения цитогенетических аномалий в эпителиоцитах определяли с помощью расчетных методик и выражали в виде индекса накопления цитогенетических нарушений. На каждого обследуемого готовили два мазка буккального эпителия и анализировали две тысячи неповрежденных клеток.
Результаты. В сравнении с контрольной группой отмечено увеличение частоты кариопатологических аномалий в клетках буккального эпителия пожарных в зависимости от стажа работы и концентрации диоксинов в липидах крови. Анализ взаимосвязи различных полиморфных вариантов генов детоксикации ксенобиотиков, диоксинов в липидах крови пожарных и индекса накопления цитогенетических нарушений показал, что лица с сочетанием 6 генотипов (EPHX1 Tyr/Tyr, CYP1A1 A/A, GSTT1 I/I, GSTM1 I/I, GSTP1 A/A, GSTP1 C/C) характеризовались наличием ферментов детоксикации ксенобиотиков с высокой активностью и большей устойчивостью к возникновению кариопатологических изменений под воздействием генотоксикантов.
Заключение. Выявленные в представленном исследовании уровни цитогенетических нарушений свидетельствуют о неблагоприятном воздействии токсичных продуктов горения, которым подвергаются сотрудники ГПС МЧС России при выполнении задач по пожаротушению.
Ключевые слова
Для цитирования:
Крийт В.Е., Сладкова Ю.Н., Мельнов С.Б., Рейнюк В.Л., Пятибрат А.О. Результаты исследований генотоксических эффектов диоксинов в зависимости от полиморфизмов генов детоксикации ксенобиотиков и стажа работы пожарных. Здоровье населения и среда обитания – ЗНиСО. 2022;(5):65-75. https://doi.org/10.35627/2219-5238/2022-30-5-65-75
For citation:
Kriyt V.E., Sladkova Yu.N., Melnov S.B., Reiniuk V.L., Pyatibrat A.O. Results of Studying Genotoxic Effects of Dioxins Depending on Polymorphisms of Xenobiotic Detoxification Genes and the Length of Service of Firefighters. Public Health and Life Environment – PH&LE. 2022;(5):65-75. (In Russ.) https://doi.org/10.35627/2219-5238/2022-30-5-65-75
Введение. Трудовая деятельность пожарных связана с высоким риском для здоровья и жизни, что требует для этого контингента особенного правового статуса, более широких льгот и высоких социальных гарантий, чем в отношении работников, не подвергающихся угрозе жизни при выполнении профессиональных задач.
Нормативные акты, регулирующие контроль за состоянием здоровья пожарных, закреплены в ст. 4 Федерального закона от 28 марта 1998 г. № 52-ФЗ1и не отражают влияние профессиональных вредных факторов пожаротушения.
Несовершенство правовой базы по охране здоровья пожарных приводит к тому, что профилактические осмотры не дают возможности мониторинга по выявлению хронических интоксикаций токсичными продуктами горения. Их оценивают только при госпитализации по поводу острых отравлений, которые регистрируются как несчастные случаи на производстве. В настоящее время в системе МЧС России гигиенические исследования по оценке условий труда пожарных при выполнении профессиональных задач проводятся редко, а длительное воздействие токсичных продуктов горения на организм пожарных не регистрируется2.
Во время пожаротушения пожарные подвергаются влиянию комплекса факторов различной природы, ведущее место среди которых занимает химический фактор. Это объясняется непрогнозируемым токсическим эффектом от воздействия широкого спектра продуктов горения, качественные и количественные характеристики которых трудно определимы и, в первую очередь, зависят от используемых при строительстве полимерных и полимерсодержащих материалов. Согласно литературным данным, при качественном анализе продуктов горения на пожаре выделяется более 100 химических соединений, часть которых обладает эффектом суммации [1][2]. Необходимо отметить, что существенную опасность представляют низкотемпературные пожары, что обусловлено образованием в продуктах горения диоксинов и диоксиноподобных соединений.
Данные соединения обладают высокой химической устойчивостью и выраженным кумулятивным эффектом, длительное время сохраняются в организме человека и вызывают отсроченные эффекты [3–7]. Самым опасным, по отношению к которому и применяется термин «диоксин», является 2,3,7,8-тетрахлордибензо-пара-диоксин (ТХДД) [8]. Период полувыведения для ТХДД составляет примерно 7 лет [9–11].
Понятие «диоксины» включает в себя две большие группы полихлорированных дибензодиоксинов (ПХДД) и полихлорированных дибензофуранов (ПХДФ) с различным числом и расположением атомов хлора. ПХДД и ПХДФ обычно встречаются в смесях и представляют собой группу из 210 трициклических, хлорсодержащих ароматических химических веществ (75 конгенеров ПХДД и 135 конгенеров ПХДФ). Мониторингу подлежат только 17 из них, которые отличает 2,3,7,8-положение атомов хлора и очень высокая токсичность [12–15].
Образование диоксинов связано с низкотемпературными процессами горения полимерных и полимерсодержащих хлорированных соединений в диапазоне температур от 200 до 900 °C, а также с побочными технологическими процессами различных отраслей промышленности. Основным отличием от других профессий является то, что пожарные подвергаются воздействию диоксинов в составе сложного комплекса токсичных веществ [16]. Существует много путей поступления диоксинов в организм человека, одним из которых является поступление через органы дыхания, характерное для профессиональной деятельности пожарных [17][18]. Наибольший вклад в поступление диоксинов в организм людей связан с потреблением продуктов питания (более 90 % содержания диоксинов в организме), прямое вдыхание составляет незначительную долю совокупного воздействия диоксинов и составляет менее 5 % поступления с пищей. Однако в некоторых чрезвычайных ситуациях (например, на территориях, расположенных вблизи источников загрязнения) доля воздействия диоксинов за счет вдыхания может приближаться к значениям, соответствующим поглощению их с пищей3. Поступление с питьевой водой является незначительным. По-видимому, это можно объяснить молекулярной структурой диоксинов и устойчивостью их к разложению, а также способностью к аккумуляции в жиросодержащих тканях живых организмов и перемещению по пищевой цепи [12][19].
По результатам ранее проведенного исследования [7][20] нами были сделаны предположения, что высокие концентрации диоксинов в воздухе на всех этапах ликвидации пожаров и высокие концентрации диоксинов в липидах крови пожарных в зависимости от стажа работы позволяют говорить об ингаляционном пути поступления диоксинов как одном из основных для данной профессиональной группы. Кроме того, в зависимости от полиморфных вариантов генов детоксикации ксенобиотиков и концентрации диоксинов в липидах крови, были выделены генотипы 6 кандидатных генов, при которых у пожарных были выявлены статистически значимые изменения концентрации диоксинов в крови.
Дальнейшее исследование было связано с изучением кариопатологических проявлений генотоксических эффектов диоксинов. В последние годы внимание исследователей привлекает проблема медицинской значимости генотоксических поражений генома, что особенно актуально для пожарных, подвергающихся ежедневному воздействию генотоксикантов с высокими кумуляционными свойствами.
Цель исследования – изучение кариопатологических проявлений генотоксических эффектов диоксинов у пожарных в зависимости от стажа профессиональной деятельности и различных полиморфных вариантов генов детоксикации ксенобиотиков.
Материалы и методы. Оценку цитогенетического статуса пожарных проводили с помощью расширенного микроядерного теста буккального эпителия. У 252 пожарных (основная группа) и 86 спасателей и лиц других профессий (контрольная группа) после тщательного прополаскивания полости рта с внутренней поверхности щеки собирали клетки слизистой оболочки и наносили их на предварительно обезжиренное предметное стекло. На каждого обследуемого готовили 2 мазка буккального эпителия и анализировали две тысячи (2000) неповрежденных клеток [21]. Препараты фиксировали с помощью стандартной методики Карнуа (этанол и ледяная уксусная кислота в соотношении 3:1). Окраску хроматина проводили с помощью ацетоорсеина, а цитоплазму контрастировали с помощью светлого зеленого. Анализ показателей кариопатологических изменений проводили микроскопированием готовых препаратов с применением микроскопа Bresser Advance ICD (Германия), оснащенного видеокамерой с увеличением ×400–600, определяли частоту встречаемости клеток с микроядрами, протрузиями, ядерными мостами, атипичных клеток, патологических митозов и других кариопатологических изменений. Пролиферативные нарушения оценивали по частоте дву- и многоядерных клеток. Показатели ранней деструкции ядер определяли по частоте встречаемости клеток с вакуолизированными ядрами, конденсацией хроматина и началом кариолизиса. Маркерами поздней деструкции ядра являлись наличие в клетках выраженного кариорексиса, кариопикноза и полного кариолизиса. Оценку риска возникновения цитогенетических аномалий в эпителиоцитах проводили в соответствии с методическими рекомендациями «Оценка цитологического и цитогенетического статуса слизистых оболочек полости носа и рта у человека»4 и выражали в виде индекса накопления цитогенетических нарушений (Iac – index of accumulation of cytogenetic damage), представленного произведением интегрального показателя цитогенетических нарушений (Ic – cytogenetic index) и интегрального показателя пролиферации (Ip – index of proliferation), деленным на апоптотический индекс (Iapop – apoptotic index):
Iac = (Ic × Ip/Iapop) × 100, где
Ic – сумма клеток с микроядрами и протрузиями; Ip – сумма многоядерных клеток; Iapop – апоптотический индекс, представленный суммой клеток с кариорексисом, кариопикнозом и кариолизисом.
Рассчитанный Iac позволяет отнести обследованных к какой-либо из групп риска в зависимости от величины показателей. Считается, что при Iac < 2 – низкий риск. Умеренный риск характеризуется значениями Iac от 2 до 4. Для Iac более 4 характерен высокий уровень риска накопления цитогенетических нарушений [22][23].
Для оценки взаимосвязи степени кариопатологических изменений и активности ферментов детоксикации ксенобиотиков из 120 вариантов комбинаций генотипов 6 генов-кандидатов выбрали 2 крайних варианта сочетания генов, при которых у сотрудников ФПС МЧС России были выявлены статистически значимые цитогенетические изменения в клетках буккального эпителия. В первой обобщенной группе пожарных – (22,1 ± 1,4) % оказалось сочетание 6 генотипов (EPHX1 Tyr/ Tyr, CYP1A1 A/A, GSTT1 I/I, GSTM1 I/I, GSTP1 A/A, GSTP1 C/C), ассоциированных с высокой активностью ферментов детоксикации ксенобиотиков 1-й и 2-й фазы биотрансформации. Вторую обобщенную группу пожарных – (14,5 ± 1,2) % составили лица, имеющие сочетание других 6 генотипов (EPHX1 Tyr/His, CYP1A1 A/G, GSTT1 I/D, GSTM1 I/D, GSTP1 A/G, GSTP1 T/T).
Исследование одобрено на заседании Локального этического комитета (протокол № 2018/2.2 от 21.12.2018). От участников исследования получено добровольное информированное согласие. Исследования проводились в период с 2019 по 2022 г.
Результаты. Для оценки генотоксического эффекта диоксинов провели анализ клеток буккального эпителия. Определяли цитогенетические показатели, представленные микроядрами, протрузиями ядер, атипичными формами ядер, а также межъядерными мостами; оценивали показатели пролиферации клеток, представленные дву- и многоядерными клетками, клетками со сдвоенными ядрами, отмечали раннюю стадию деструкции ядер по интерпретации конденсации хроматина, перинуклеарных вакуолей, вакуолизации ядер, а также выявляли признаки поздней стадии деструкции ядер, характеризующиеся кариорексисом, кариопикнозом, полным кариолизисом. Результаты исследований показателей кариопатологических изменений в зависимости от стажа работы и концентрации диоксинов в липидах крови представлены в табл. 1 и 2.
Далее была проанализирована частота кариопатологических изменений у пожарных, участвующих в пожаротушении, в зависимости от полиморфизма генов детоксикации ксенобиотиков первой и второй фазы биотрансформации (табл. 3–7).
По результатам оценки полиморфизма генов, ассоциированных с высокой активностью ферментов детоксикации ксенобиотиков 1-й и 2-й фазы биотрансформации, обследуемые были разделены на две группы: первую группу составили лица с сочетанием 6 генотипов (EPHX1 Tyr/Tyr, CYP1A1 A/A, GSTT1 I/I, GSTM1 I/I, GSTP1 A/A, GSTP1 C/C), ассоциированных с высокой активностью ферментов (22,1 ± 1,4 %); во вторую группу вошли обследуемые (14,5 ± 1,2 %) c сочетанием других 6 генотипов (EPHX1 Tyr/His, CYP1A1 A/G, GSTT1 I/D, GSTM1 I/D, GSTP1 A/G, GSTP1 T/T), отличающихся достоверно более высокой концентрацией диоксинов в крови. В группах сравнения рассчитан индекс накопления цитогенетических нарушений. Результаты представлены в табл. 8.
Таблица 1. Показатели кариопатологических изменений у пожарных в зависимости от стажа работы в условиях пожаротушения (‰), M ± σ
Table 1. Indicators of karyotype aberrations in firefighters depending on the years of employment (‰), M ± σ
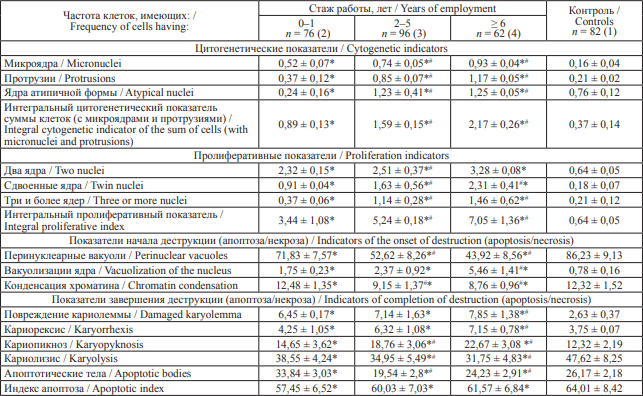
Примечание: * – к контрольной группе, p < 0,001; # – к группе пожарных со стажем до 1 года, p < 0,001.
Notes: * statistically different from the control group, p < 0.001; # statistically different from the group of firefighters with less than 1 year of employment, p < 0.001.
Таблица 2. Показатели кариопатологических изменений (‰) у пожарных в зависимости от концентрации диоксинов в липидах крови, M ± σ
Table 2. Indicators of karyotype aberrations (‰) in firefighters depending on the concentration of dioxins in blood lipids, M ± σ
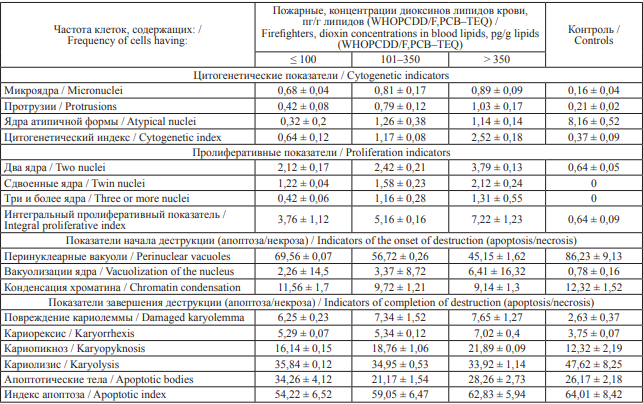
Примечание: * – к контрольной группе, p < 0,001; # – к группе пожарных со стажем до 1 года, p < 0,001.
Notes: * statistically different from the control group, p < 0.001; # statistically different from the group of firefighters with less than 1 year of employment, p < 0.001.
Таблица 3. Показатели кариопатологических изменений у сотрудников ФПС МЧС России в зависимости от полиморфных вариантов гена EPHX1, ‰
Table 3. Indicators of karyotype aberrations in firefighters of the State Fire Service of the Russian Ministry of Emergency Situations depending on polymorphic variants of the EPHX1 gene, ‰

Примечание: * – относительно группы пожарных с генотипом His/His, p < 0,001. Notes: * statistically different from the group of firefighters with the His/His genotype, p < 0.001.
Таблица 4. Показатели кариопатологических изменений у сотрудников ФПС МЧС России в зависимости от полиморфных вариантов гена CYP1A1, ‰
Table 4. Indicators of karyotype aberrations in firefighters of the State Fire Service of the Russian Ministry of Emergency Situations depending on polymorphic variants of the CYP1A1 gene, ‰
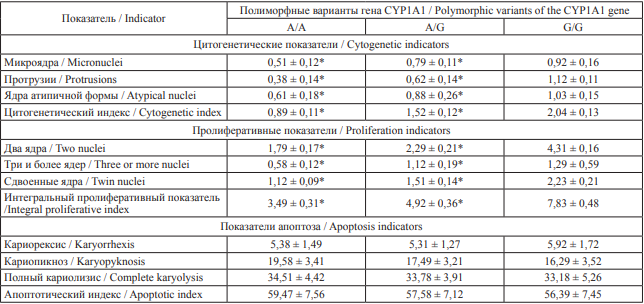
Примечание: * – относительно группы пожарных с генотипом G/G, p < 0,001.
Notes: * statistically different from the group of firefighters with the D/D genotype, p < 0.001.
Таблица 5. Показатели кариопатологических изменений у сотрудников ФПС МЧС России в зависимости от полиморфных вариантов гена GSTM1, ‰
Table 5. Indicators of karyotype aberrations in firefighters of the State Fire Service of the Russian Ministry of Emergency Situations depending on polymorphic variants of the GSTM1 gene, ‰
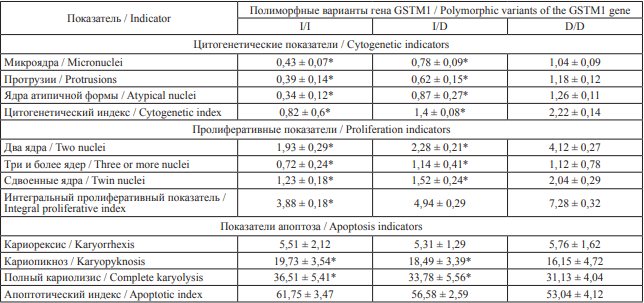
Примечание: * – относительно группы с генотипом D/D, p < 0,001.
Notes: * statistically different from the group of firefighters with the D/D genotype, p < 0.001.
Таблица 6. Показатели кариопатологических изменений у сотрудников ФПС МЧС России в зависимости от полиморфных вариантов гена GSTT1, ‰
Table 6. Indicators of karyotype aberrations in firefighters of the State Fire Service of the Russian Ministry of Emergency Situations depending on polymorphic variants of the GSTT1 gene, ‰
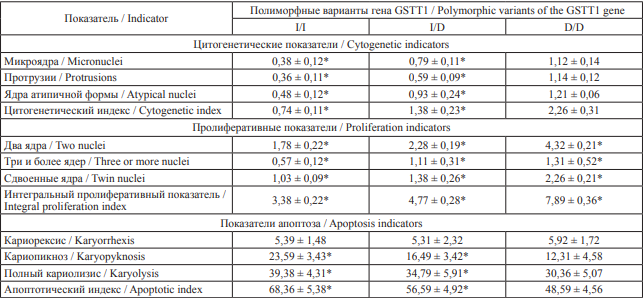
Примечание: * – относительно группы пожарных с генотипом D/D, p < 0,001.
Notes: * statistically different from the group of firefighters with the D/D genotype, p < 0.001
Таблица 7. Показатели кариопатологических изменений у сотрудников ФПС МЧС России в зависимости от полиморфных вариантов гена GSTP1, ‰
Table 7. Indicators of karyotype aberrations in firefighters of the State Fire Service of the Russian Ministry of Emergency Situations depending on polymorphic variants of the GSTP1 gene, ‰
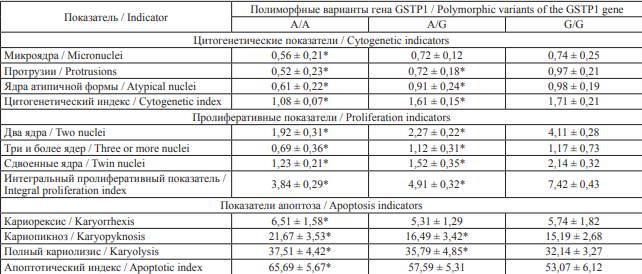
Примечание: * – относительно группы с генотипом G/G, p < 0,001.
Notes: * statistically different from the group of firefighters with the G/G genotype, p < 0.001.
Таблица 8. Индексы цитогенетических нарушений, пролиферации, апоптоза и накопления цитогенетических нарушений в клетках буккального эпителия у пожарных с различными генотипами генов детоксикации ксенобиотиков
Table 8. Indices of cytogenetic damage, proliferation, apoptosis, and accumulation of cytogenetic abnormalities in buccal epithelial cells of firefighters with different genotypes of xenobiotic detoxification genes
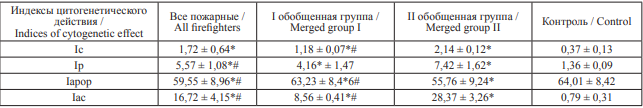
Примечание: * – относительно контрольной группы, p < 0,001; # – относительно II группы пожарных обобщенной группы, p < 0,001.
Notes: * statistically different from the control group, p < 0.001; # statistically different from firefighters of merged group II, p < 0.001.
Обсуждение. В настоящее время большое количество работ, раскрывающих влияние токсичных продуктов горения на организм человека, посвящено профессиональной деятельности пожарных как категории лиц, наиболее часто сталкивающихся с этими продуктами в процессе выполнения профессиональных задач по пожаротушению. Однако в данных работах анализ генотоксических эффектов токсичных продуктов горения с помощью цитогенетических методик не проводился [1][3][4][9–11][15–18]. В работах, посвященных цитогенетическому мониторингу, оценивается цитогенетический статус разных групп населения в связи с загрязнением окружающей среды, который может служить биомаркером уровня загрязнения среды генотоксикантами, дает возможность выявления зон риска, позволяет определять неблагоприятные факторы, воздействующие на человека, а также высокий уровень клеток с цитогенетическими повреждениями на ранних стадиях патологии [6][21][22][24].
Полученные нами результаты определяют зависимость кариопатологических изменений от стажа профессиональной деятельности, связанной с пожаротушением. Показатели, представленные в табл. 1, свидетельствуют, что у пожарных, подвергающихся воздействию комплекса генотоксических факторов, поступающих в окружающую среду в виде токсичных продуктов горения при пожарах, отмечается увеличение частоты кариопатологических аномалий в клетках буккального эпителия по сравнению с контрольной группой. В зависимости от стажа частота встречаемости клеток с микроядрами и с протрузиями в 2–3 раза выше, чем в контрольной группе. Ядра с атипичной формой, причина возникновения которых заключается в нарушениях строения генома (в частности, дупликаций его участков) [22], также чаще определяются в группах пожарных со стажем более года. Также у пожарных достоверно чаще (p < 0,001) регистрировались признаки патологической пролиферации клеток, характеризующиеся увеличением частоты встречаемости двуядерных и трехъядерных клеток, клеток, содержащих сдвоенные ядра, что, в свою очередь, свидетельствует об усилении процессов компенсаторной пролиферации новых клеток [21]. Показатели ранней деструкции ядер, представленные образованием перинуклеарных вакуолей, в 4 раза выше у пожарных со стажем больше 5 лет в сравнении с группой контроля. В этой группе в 4 раза чаще наблюдались и случаи кариорексиса. В то же время у пожарных увеличено количество клеток с кариопикнозом и кариорексисом по сравнению с контрольной группой. При этом частота встречаемости этих клеток уменьшается с увеличением стажа. В группе пожарных с большим стажем отмечались более низкие значения конденсации хроматина, что связано с увеличением пластичности буккального эпителия – повреждение генома связано с репарационными процессами, что требует активизации считывания генетической информации [8].
В работах, посвященных воздействию диоксинов на организм пожарных, основное внимание уделяется концентрациям диоксинов в липидах крови и коррелирующими с ними изменениями системы биотрансформации ксенобиотиков, но проводимый анализ касается в основном одной уникальной высокоэкспонированной диоксинами когорты (пожарные, участвовавшие в ликвидации пожара в 1992 году на кабельном заводе в городе Шелехове), и не оценивается цитогенетический статус пожарных [11][15–18]. В представленном нами исследовании определена зависимость генотоксических эффектов диоксинов от их концентрации в организме. Данные, представленные в табл. 2, свидетельствуют о том, что у пожарных отмечается увеличение частоты кариопатологических аномалий в клетках буккального эпителия в зависимости от концентрации диоксинов в липидах крови и по сравнению с контрольной группой. У пожарных с высокой концентрацией диоксинов в липидах крови частота встречаемости клеток с микроядрами и с протрузиями в 2–3 раза выше, чем частота этих цитогенетических нарушений в контрольной группе (р ≤ 0,001). Частота встречаемости атипичных ядер выше в группах пожарных с высокой концентрацией диоксинов липидов крови, что демонстрирует увеличение генетических аномалий. В то же время у пожарных с большей концентрацией диоксинов в липидах крови с высокой достоверностью чаще определялись признаки пролиферативных нарушений. Показатели ранней деструкции ядер, представленные образованием перинуклеарных вакуолей, в 4 раза выше у пожарных с концентрацией диоксинов выше 350 пг/г липидов, чем у лиц группы контроля. Также в этой группе в 4 раза чаще наблюдался и кариорексис. Повышение частоты образования перинуклеарных вакуолей и вакуолизация ядер у пожарных с высокой концентрацией диоксинов в липидах крови свидетельствует о наличии признаков некроза. В то же время у пожарных увеличено количество клеток с кариопикнозом и кариорексисом, что свидетельствует о нарастании апоптоза. Вероятно, что при воздействии токсичных продуктов горения, в том числе диоксинов, происходит повышение случаев апоптоза, что приводит к повышению уровня некротических процессов в клетках буккального эпителия [6].
Анализ зависимости концентраций диоксинов в липидах крови пожарных от различных полиморфных вариантов генов детоксикации ксенобиотиков был представлен в наших предыдущих статьях [7][20]. Также подавляющее большинство работ, посвященных хроническому воздействию диоксинов, направлено на изучение взаимосвязи уровня диоксинов в организме человека с различными полиморфными вариантами генов детоксикации ксенобиотиков [10][11][19]. В то же время в этих работах не рассматривается взаимосвязь активности ферментов детоксикации ксенобиотиков и кариопатологических изменений. Вместе с тем в исследовании по изучению начальных проявлений интоксикации у клинически здорового населения загрязненных диоксинами территорий Вьетнама анализ реакций клеточных и субклеточных структур в организме человека на равные по дозовой экспозиции воздействия диоксинами свидетельствует, что их разнообразие определяется вариабельностью индивидуальной чувствительности, обусловленной спецификой генотипа, пола и возраста [24].
Проведенный в представленном исследовании анализ кариопатологических изменений в клетках буккального эпителия сотрудников ФПС МЧС России в зависимости от различных полиморфных вариантов гена, кодирующего эпоксидгидролазу, важнейшего фермента биотрансформации, преобразующего эпоксиды из деградированных ароматических соединений в трансдигидродиолы, показал, что носители генотипа Tyr/Tyr, ассоциированного с высокой активностью фермента, отличаются достоверно более низкой частотой встречаемости кариопатологических изменений (табл. 3). Статистически достоверно повышенные уровни цитогенетических нарушений в группах с полиморфизмами гена EPHX1 с низкой активностью эпоксидгидролазы свидетельствуют о недостаточности детоксикационной функции фермента, кодируемого при этом полиморфизме, что способствует кумуляции диоксинов и увеличению их генотоксического эффекта на клеточные структуры организма сотрудников ФПС МЧС России при выполнении задач по пожаротушению. Также у пожарных, носителей полиморфных вариантов Tyr/Tyr, частота встречаемости клеток с пролиферативными нарушениями статистически значимо ниже, чем у носителей полиморфизмов, ассоциированных с низкой детоксикационной способностью фермента. Апоптотический индекс, наоборот, выше в группе носителей полиморфизма, связанного с высокой активностью фермента.
Анализ особенностей цитогенетических нарушений в клетках буккального эпителия сотрудников ФПС МЧС России при различных вариантах гена, кодирующего цитохром Р450 1A1, монооксигеназу печени, важнейшего фермента первой фазы детоксикации ксенобиотиков, показал, что носители генотипа A/A, ассоциированного с высокой активностью фермента, отличаются достоверно более низкой частотой встречаемости кариопатологических изменений (табл. 4). Статистически достоверно повышенные уровни цитогенетических нарушений в группах с полиморфизмами, ассоциированными с низкой активностью монооксигеназы, свидетельствуют о недостатке детоксикационной функции фермента при данном полиморфизме и увеличении генотоксического эффекта диоксинов на организм пожарных. Также у пожарных, носителей полиморфных вариантов A/A, частота встречаемости клеток с пролиферативными нарушениями статистически значимо ниже, чем у носителей полиморфизмов, ассоциированных с низкой детоксикационной способностью фермента. В то же время по оценке апоптотического индекса в группах с различными полиморфизмами гена CYP1A1 статистически достоверных различий выявлено не было.
Результаты оценки связи активности ферментов детоксикации ксенобиотиков второй фазы биотрансформации с уровнем цитогенетических нарушений при воздействии токсичных продуктов горения на организм пожарных при пожаротушении свидетельствуют, что при полиморфизмах, ассоциированных с высокой активностью фермента, определяется достоверно более низкая частота встречаемости кариопатологических изменений.
У носителей генотипа D/D гена GSTM1, кодирующего аминокислотную последовательность фермента мю-1 глутатион-S-трансферазы, отмечается более высокая частота цитогенетических и пролиферативных изменений клеток буккального эпителия, а также более низкий показатель индекса апоптоза (табл. 5).
Носители делеционного генотипа D/D гена GSTТ1, кодирующего аминокислотную последовательность фермента тета-1 глутатион-S-трансферазы, характеризовались достоверно белее высокими показателями частоты встречаемости цитогенетических и пролиферативных нарушений (табл. 6). При этом частота апоптотических изменений, наоборот, среди носителей гомозиготного генотипа D/D была ниже. В литературных источниках представлены сведения о частоте носителей генотипа D/D: в европеоидной популяции их определяется 15–30 %, в негроидной – около 25 %, а в монголоидной – до 58 %. В русской популяции европейской части России частота делеционного генотипа определяется примерно в 18 % случаев [25].
Носители аллеля А гена GSTP1, кодирующего аминокислотную последовательность фермента пи-1 глутатион-S-трансферазы, демонстрировали более низкую частоту встречаемости клеток с цитогенетическими и пролиферативными изменениями в сравнении с носителями гомозиготного генотипа G/G (табл. 7). У носителей аллеля А глутатион-S-трансфераза ассоциирована с большей детоксикационной активностью ксенобиотиков за счет связывания глутатиона с субстратами. Полиморфизм гена GSTP1 определяется заменой нуклеотида аденина (А) на гуанин (G), приводящей к замене аминокислоты в пептидной цепи молекулы фермента, и связана со снижением его активности, что приводит к повышению кумуляции токсикантов в организме и, в свою очередь, увеличению частоты встречаемости клеток с кариопатологией.
Вышеизложенные результаты подтверждаются данными, представленными в табл. 8, свидетельствующими, что у лиц первой обобщенной группы индекс накопления цитогенетических нарушений Iac достоверно ниже, чем у лиц второй обобщенной группы, генотипы генов которых ассоциированы с низкой детоксикационной активностью.
Заключение. Таким образом, у пожарных в зависимости от стажа работы и концентрации диоксинов в липидах крови отмечено увеличение частоты кариопатологических аномалий в клетках буккального эпителия в сравнении с контрольной группой. Анализ взаимосвязи различных полиморфных вариантов генов детоксикации ксенобиотиков, диоксинов в липидах крови пожарных и индекса накопления цитогенетических нарушений показал, что лица с сочетанием 6 генотипов (EPHX1 Tyr/ Tyr, CYP1A1 A/A, GSTT1 I/I, GSTM1 I/I, GSTP1 A/A, GSTP1 C/C) характеризовались наличием ферментов детоксикации ксенобиотиков с высокой активностью и большей устойчивостью к возникновению кариопатологических изменений под воздействием генотоксикантов. Полученные в результате проведенного исследования уровни цитогенетических нарушений свидетельствуют о неблагоприятном воздействии токсичных продуктов горения (в т. ч. диоксинов), которому подвергаются сотрудники при выполнении задач по пожаротушению.
1. Федеральный закон от 28 марта 1998 г. № 52-ФЗ «Об обязательном государственном страховании жизни и здоровья военнослужащих, граждан, призванных на военные сборы, лиц рядового и начальствующего состава органов внутренних дел Российской Федерации, Государственной противопожарной службы, сотрудников учреждений и органов уголовно-исполнительной системы, сотрудников войск национальной гвардии Российской Федерации, сотрудников органов принудительного исполнения Российской Федерации» в редакции от 27 декабря 2019 г.
2. Рукавишников В.С., Лахман О.Л., Дорогова В.Б. и др. Профилактика профессиональных и производственнообусловленных заболеваний у пожарных: (методические рекомендации). Ангарск: Научный центр реконструктивной и восстановительной хирургии Сибирского отделения РАМН, 2006. 52 с.
3. Рекомендации по качеству воздуха в Европе. / Пер. с англ. М.: Издательство «Весь Мир», 2004. 312 с.
4. Беляева Н.Н., Сычева Л.П., Журков В.С. Оценка цитологического и цитогенетического статуса слизистых оболочек полости носа и рта у человека: методические рекомендации. М., 2005. 37 с.
Список литературы
1. Рукавишников В.С., Колычева И.В. Лахман О.Л. Современные аспекты сохранения и укрепления здоровья пожарных // Гигиена и санитария. 2016. Т. 95. № 12. С. 1175–1179. doi: 10.18821/0016-9900-2016-95-12-1175-1179
2. Рукавишников В.С., Колычева И.В. Медицина труда пожарных: итоги и перспективы исследований // Медицина труда и промышленная экология. 2007. № 6. С. 1–5.
3. Рукавишников В.С., Колычева И.В., Дорогова В.Б., Бударина Л.А. Некоторые подходы к мониторингу условий труда и состояния здоровья пожарных // Бюллетень Восточно-Сибирского научного центра Сибирского отделения Российской академии медицинских наук. 2005. № 2 (40). С. 7–14.
4. Стрельцова И.В., Скутова А.В. Медицинские аспекты профессиональной деятельности пожарных // Научный журнал. 2017. № 5 (18). С. 105–106.
5. Адамян В.Л., Мальков И.В. Медико-биологические аспекты трудовой деятельности пожарных // Центральный научный вестник. 2017. Т. 2. № 19 (36). С. 3.
6. Софронов Г.А., Румак В.С., Умнова Н.В., Белов Д.А, Турбабина К.А. Возможные риски хронического воздействия малых доз диоксинов для здоровья населения: к методологии выявления токсических эффектов // Медицинский академический журнал. 2016. Т. 16. № 3. С. 7–18.
7. Крийт В.Е., Сладкова Ю.Н., Санников М.В., Пятибрат А.О. Оценка концентрации диоксинов в липидах крови пожарных в зависимости от полиморфных вариантов генов детоксикации ксенобиотиков // Здоровье населения и среда обитания. 2020. № 10 (331). С. 65–74. doi: 10.35627/2219-5238/2020-331-10-65-74
8. Кузьмина Н.С., Лыонг Т.М., Рубанович А.В. Изменения метилирования ДНК, индуцированные диоксинами и диоксиноподобными соединениями, как возможный предиктор развития заболеваний // Генетика. 2020. Т. 56. № 10. С. 1136–1149. doi: 10.31857/S0016675820100069
9. Chernyak YI, Shelepchikov AA, Brodsky ES, Grassman JA. PCDD, PCDF, and PCB exposure in current and former firefighters from Eastern Siberia. Toxicol Lett. 2012;213(1):9-14. doi: 10.1016/j.toxlet.2011.09.021
10. Chernyak YI, Merinova AP, Shelepchikov AA, Kolesnikov SI, Grassman JA. Impact of dioxins on antipyrine metabolism in firefighters. Toxicol Lett. 2016;250-251:35-41. doi: 10.1016/j.toxlet.2016.04.006
11. Chernyak YI, Grassman JA. Impact of AhRR (565C > G) polymorphism on dioxin dependent CYP1A2 induction. Toxicol Lett. 2020;320:58-63. doi: 10.1016/j.toxlet.2019.12.002
12. Румак В.С., Умнова Н.В. Диоксины и безопасность биосистем: результаты натурных исследований // Жизнь Земли. 2018. Т. 40. № 3. С. 308–323.
13. Какарека С.В., Кухарчик Т.И. Источники поступления стойких органических загрязнителей в окружающую среду: опыт выявления и изучения // Природопользование. 2012. № 22. С. 157–164.
14. Румак В.С., Умнова Н.В. Биомониторинг состояния загрязненной диоксинами среды в окрестностях свалки: к минимизации риска для здоровья населения // Химическая безопасность. 2020. Т. 4. № 2. С. 68–79. doi: 10.25514/CHS.2020.2.18005
15. Chernyak YI, Shelepchikov AA, Feshin DB, Brodsky ES, Grassman JA. Polychlorinated dibenzo-p-dioxins, dibenzofurans, and biphenyls in the serum of firefighters who participated in extinguishing the 1992 fire at a cable manufacturing plant in Irkutsk oblast. Dokl Biol Sci. 2009;429:562-566. doi: 10.1134/S0012496609060234
16. Черняк Ю.И., Шелепчиков A.A., Грассман Д.А. Модификация диоксин-сигнального пути у высокоэкспонированных пожарных // Бюллетень Восточно-Сибирского научного центра Сибирского отделения Российской академии медицинских наук. 2007. № 2(54). С. 65–71.
17. Черняк Ю.И., Грассман Д.А. Воздействие диоксинов на пожарных // Медицина труда и промышленная экология. 2007. № 6. С. 18-21.
18. Шелепчиков А.А., Черняк Ю.И., Бродский Е.С., Фешин Д.Б., Грассман Д.А. Полихлорированные дибензо-п-дтоксины, дибензофураны и бифенилы в сыворотке крови пожарных Иркутского региона // Сибирский медицинский журнал (Иркутск). 2012. Т. 110. № 3. С. 53–59.
19. Софронов Г.А., Рембовский В.Р., Радилов А.С., Могиленкова Л.А. Современные взгляды на механизм токсического действия диоксинов и их санитарногигиеническое нормирование // Медицинский академический журнал. 2019. Т. 19. № 1. С. 17–28. doi: 10.17816/MAJ19117-28
20. Крийт В.Е., Санников М.В., Сладкова Ю.Н., Пятибрат А.О. Влияние полиморфизмов генов детоксикации ксенобиотиков и стажа работы на уровень кумуляции диоксинов в организме сотрудников МЧС России // Медико-биологические и социально-психологические проблемы безопасности в чрезвычайных ситуациях. 2020. № 2. С. 55–68. doi: 10.25016/2541-7487-2020-0-2-55-68
21. Сычева Л.П. Применение цитогенетического мониторинга в оценке влияния факторов окружающей среды на здоровье человека // Российский журнал восстановительной медицины. 2016. № 1. С. 48–60.
22. Сычева Л.П. Цитогенетический мониторинг для оценки безопасности среды обитания человека // Гигиена и санитария. 2012. № 6. С. 68–72.
23. Шинкарук Е.В., Агбалян Е.В. Цитогенетический статус жителей гыданского полуострова // Гигиена и санитария. 2016. Т. 95. № 9. С. 865–868. doi: 10.18821/0016-9900-2016-95-9-865-868
24. Румак В.С., Умнова Н.В., Софронов Г.А. Молекулярные и клеточные аспекты токсичности диоксинов // Вестник Российской академии медицинских наук. 2014. Т. 69. № 3-4. С. 77–84. doi: 10.15690/vramn.v69.i3-4.1000
25. Хрунин А.В., Хохрин Д.В., Лимборская С.А. Полиморфизм генов глутатион-S-трансфераз в популяции русского населения Евразийской части России // Генетика. 2008. Т. 44. № 10. С. 1429–1434.
Об авторах
В. Е. КрийтРоссия
Крийт Владимир Евгеньевич – к.х.н., руководитель отдела комплексной гигиенической оценки физических факторов
ул. 2-я Советская, д. 4, г. Санкт-Петербург, 191036
Ю. Н. Сладкова
Россия
Сладкова Юлия Николаевна – старший научный сотрудник отдела комплексной гигиенической оценки физических факторов
ул. 2-я Советская, д. 4, г. Санкт-Петербург, 191036
С. Б. Мельнов
Беларусь
Мельнов Сергей Борисович – д.б.н., профессор кафедры экологической и молекулярной медицины
ул. Долгобродская, д. 23/1, г. Минск, 220070
В. Л. Рейнюк
Россия
Рейнюк Владимир Леонидович – д.м.н., доцент, врио директора
ул. Бехтерева, д. 1А, г. Санкт-Петербург, 192019
А. О. Пятибрат
Россия
Пятибрат Александр Олегович – старший научный сотрудник
ул. Литовская, д. 2, г. Санкт-Петербург, 194100
Рецензия
Для цитирования:
Крийт В.Е., Сладкова Ю.Н., Мельнов С.Б., Рейнюк В.Л., Пятибрат А.О. Результаты исследований генотоксических эффектов диоксинов в зависимости от полиморфизмов генов детоксикации ксенобиотиков и стажа работы пожарных. Здоровье населения и среда обитания – ЗНиСО. 2022;(5):65-75. https://doi.org/10.35627/2219-5238/2022-30-5-65-75
For citation:
Kriyt V.E., Sladkova Yu.N., Melnov S.B., Reiniuk V.L., Pyatibrat A.O. Results of Studying Genotoxic Effects of Dioxins Depending on Polymorphisms of Xenobiotic Detoxification Genes and the Length of Service of Firefighters. Public Health and Life Environment – PH&LE. 2022;(5):65-75. (In Russ.) https://doi.org/10.35627/2219-5238/2022-30-5-65-75









.png)



























