Перейти к:
Вопросы безопасности травяных сборов и БАД к пище, загрязненных тропановыми алкалоидами (обзор)
https://doi.org/10.35627/2219-5238/2022-30-4-54-62
Аннотация
Введение. На мировом рынке специализированных пищевых продуктов особенный интерес представляют БАД к пище, травяные сборы, фиточаи, при этом особую актуальность приобретают вопросы безопасного использования, так как имеются сообщения о возможном загрязнении их тропановыми алкалоидами, содержание которых в зависимости от вида сырья составляет от 0,01 до 3 %.
Цель исследования: анализ безопасности БАД к пище, трав и травяных чаев, загрязненных тропановыми алкалоидами, на основании данных, представленных в настоящее время в отечественных и международных научных публикациях.
Материалы и методы исследования. Использованы информационно-аналитические методы, методы экспертной оценки на основе обобщения и анализа современных научных исследований, опубликованных на русском и английском языках в реферативных базах данных Scopus, PubMed и РИНЦ за период 2001–2021 гг. Ключевые слова для поиска: тропановые алкалоиды.
В первоначальную выборку попало 49 статей, из них 19 статей были исключены из выборки после первичного анализа. Отбор статей осуществлялся по принципу наличия в них сведений о классификации, уровнях содержания в травах и пищевых продуктах, методах выявления (обнаружения), возможном влиянии на здоровье человека тропановых алкалоидов. Авторы отобрали 30 полнотекстовых материалов, удовлетворяющих вышеуказанным критериям. Результаты исследований систематизированы по типу интервенций.
Результаты. Проведенный анализ показал, что содержание тропановых алкалоидов в некоторых травяных чаях по сумме атропина и скополамина может превышать установленный уровень разового безопасного поступления – 0,016 мкг/кг массы тела. Так как скополамин является производным гиосциамина (атропина), оценку безопасности пищевой продукции и сырья следует осуществлять на основании данных об уровне содержания в них атропина, что позволит проводить эффективный мониторинг загрязненности тропановыми алкалоидами всех видов указанной пищевой продукции с целью ее безопасного использования.
Заключение. Для безопасного использования травяных сборов и БАД к пище на растительной основе рекомендовано проведение мониторинга данных видов пищевой продукции на наличие в них тропановых алкалоидов. Считаем целесообразным разработать метод их анализа с использованием высокоэффективной жидкостной хроматографии в сочетании с масс-спектрометрическим анализом.
Для цитирования:
Короткова А.И., Багрянцева О.В., Соколов И.Е., Глиненко В.М. Вопросы безопасности травяных сборов и БАД к пище, загрязненных тропановыми алкалоидами (обзор). Здоровье населения и среда обитания – ЗНиСО. 2022;(4):54-62. https://doi.org/10.35627/2219-5238/2022-30-4-54-62
For citation:
Korotkova A.I., Bagryantseva O.V., Sokolov I.E., Glinenko V.M. Issues of Safety of Herb Mixes and Food Supplements Contaminated with Tropane Alkaloids: A Review. Public Health and Life Environment – PH&LE. 2022;(4):54-62. (In Russ.) https://doi.org/10.35627/2219-5238/2022-30-4-54-62
Введение. Мировой рынок специализированных пищевых продуктов представлен широким разнообразием средств, способствующих оптимизации рациона питания и поддержанию нормальной жизнедеятельности здорового организма. Особенный интерес в этом плане представляют БАД к пище, травяные сборы, фиточаи. Вместе с тем в последние годы появились сообщения о возможном загрязнении этих пищевых продуктов тропановыми алкалоидами [1–3].
Тропановые алкалоиды (ТА) являются вторичными метаболитами, продуцируемыми растениями, принадлежащими семействам Brassicaceae (Капустные), Solanaceae (Пасленовые), Erythroxylaceae (Эритроксиловые), Convolvulaceae (Вьюнковые) и Proteaceae (Протейные) [4–9]. Анализ поступления ТА со всеми видами пищевой продукции, проведенный Европейским агентством по безопасности пищевых продуктов (EFSA), показал, что их поступление в составе рационов различных групп населения может превышать установленный уровень разового безопасного поступления (ARfD) 0,016 мкг/кг массы тела примерно на 11–18 %, а для детей (в зависимости от возрастной категории) – на 5–25 % [10][11].
Несмотря на то что загрязнение пищевой продукции различными частями сорных растений (плодами, семенами и прочими частями растений) может быть обнаружено визуальным осмотром или уменьшено путем сортировки и очистки с использованием физических методов, некоторое количество ТА может попадать в пищевое сырье и переработанные пищевые продукты.
При этом присутствие одного семени дурмана на миллион семян/плодов пищевых растений может представлять определенный риск для здоровья населения [2][3][11][12]. Таким образом, риски токсикологического действия ТА, поступающих в составе рационов, на организм человека достаточно высоки.
Травяные сборы и БАД к пище на основе трав относятся наряду с зерновыми продуктами к пищевой продукции с наиболее высокими содержанием и частотой выявления ТА [3][10]. В этой связи целесообразно установить риски токсического действия ТА, поступающих в организм в составе БАД на растительной основе, трав и травяных чаев, а также разработать прецизионные, высокочувствительные методы их анализа в составе этих видов пищевой продукции.
Цель исследования: анализ безопасности БАД к пище, трав и травяных чаев, загрязненных тропановыми алкалоидами, на основании данных, представленных в настоящее время в отечественных и международных научных публикациях.
Материалы и методы исследования. В процессе проведения работы использованы информационно-аналитические методы, методы экспертной оценки на основе обобщения и анализа современных научных исследований, опубликованных в реферативных базах данных Scopus, PubMed и РИНЦ. Ключевые слова для поиска: тропановые алкалоиды. В первоначальную выборку попало 49 статей, из них 19 статей были исключены из выборки после первичного анализа. Отбор статей осуществлялся по принципу содержания в них сведений о классификации, уровнях содержания в травах и пищевых продуктах, методах выявления (обнаружения), возможном влиянии на здоровье человека тропановых алкалоидов. Авторы отобрали 30 полнотекстовых материалов, удовлетворяющих вышеуказанным критериям. Результаты исследований систематизированы по типу интервенций.
Результаты исследования
Классификация ТА. ТА классифицируются как производные четырех основных промежуточных соединений орнитина и аргинина – тропинона, экгонинона, 4-бензилтропанона и пиронотропана. Производные тропинона составляют самую многочисленную группу ТА типичных для семейств Solanaceae (Пасленовые) и Convolvulaceae (Вьюнковые) (табл. 1) [6]. В настоящее время идентифицировано около 200 видов ТА, которые характеризуются различной степенью биологической активности [12].
С использованием современных физических методов обнаружения количество новых соединений неуклонно растет [6][13][14].
Степень токсического воздействия ТА на организм в большей степени зависит от их химического строения. Например, атропин входит в международный и Российский перечни жизненно необходимых и важнейших лекарственных препаратов для медицинского применения на 2022 год (утвержден Распоряжением Правительства РФ от 23 декабря 2021 года № 3781-р)1 2.
Ряд ТА, являясь наркотическими средствами и психотропными веществами, в очищенном виде запрещены для оборота в Российской Федерации3 4.
Риски здоровью населения, связанные с загрязнением ТА травяных сборов и БАД на основе растительного сырья. Токсические эффекты ТА обусловлены антагонизмом связывания ацетилхолина с мускариновыми рецепторами центральной и периферической нервной системы [4, 11, 15]. Потребление любой части растений рода Datura spp. вызывает выраженные антихолинергические эффекты в виду подавления центральной и периферической холинергической нейротрансмиссии, что в итоге может привести к летальному исходу при попадании в организм высоких доз ТА. Хотя все части растения токсичны, семена также содержат высокие концентрации алкалоидов. Высушивание и кипячение не уменьшает их токсичных свойств. Интоксикация проявляется в виде дезориентации, потери памяти, неспособности обрабатывать информацию, нарушения зрения (мидриаз), подергиваний мышц, гиперпирексии, респираторных и сердечно-сосудистых осложнений [16, 17]. Сообщается, что интоксикация белладонной (Atropa belladonna) помимо антихолинергического синдрома может привести к нарушению функции печени [2].
Зарегистрированы случаи отравления ТА, связанные с загрязнением нетоксичных трав и травяных сборов. В отчетах, полученных из США, Великобритании, Австрии, Канады, Франции, Нидерландов и Испании, сообщалось о загрязнении ТА травяных чаев, изготавливаемых с использованием корня лопуха (Arctium lappa), окопника (Symphytum officinale), мальвы обыкновенной (Malva sylvestris), медуницы (Pulmonaria officinalis), корня алтея лекарственного (Althaea officinalis), крапивы двудомной (Urtica dioica) и парагвайского чая (Ilex paraguariensis). Содержание атропина в этих чаях варьировало от 0,76 до > 30 мг/г сухой массы. В Италии зарегистрированы случаи отравления ТА при приеме БАД к пище для похудения на основе форсколина (Coleus forskohlii). Отчеты из Китая содержали информацию о фактах обнаружения ТА в корневищах атрактилодеса большеголового (Rhizoma аtractylodis), корнях аукландии (Radix Aucklandiae) и стробилантиса форестии (Radix strobilanthis Forrestii), корневищах и корнях нотоптеригии (Rhizoma et radix Notopterygii) [2].
Известно, что интоксикация, вызванная поступлением в организм больших количеств дурмана обыкновенного (Datura stramonium L.), вызывает тяжелое поражение центральной нервной системы, приводящее к неконтролируемому психическому состоянию. Другие неблагоприятные воздействия включают галлюцинации, судороги, сухость кожи, нерегулярную частоту сердечных сокращений и пульса, потерю памяти, помутнение зрения и кому, что приводит к смерти [16].
Согласно проведенным исследованиям EFSA безопасный уровень поступления ТА (ARfD) в организм составляет 0,016 мкг/кг массы тела (в пересчете на сумму (L)-гиосциамина и (L)-скополамина) [3][10]. Как при их парентеральном, так и трансдермальном введении ТА могут проникать через гематоэнцефалический барьер и воздействовать на центральную нервную систему [11][18]. Отмечено, что токсикологические эффекты этих ТА у экспериментальных животных (крыс) связаны с их фармакологической активностью, в частности с расширением зрачков и нейробиоэмоциональными эффектами [19]. В хроническом 2-летнем эксперименте при введении (L)-скополамина с наименьшей дозой 0,7 мг/кг массы тела в сутки крысам и мышам у всех животных наблюдалось расширение зрачков. При более высоких дозах у подопытных животных наблюдалось снижение секреции слюнных желез и затруднение глотания, а также обезвоживание. Атропин не проявил мутагенной (в тесте Эймса), канцерогенной и генотоксической активности в отношении самцов или самок крыс линии F344/N или мышей линии B6C3F1, которым вводили данный ТА в концентрации 1,5 или 25 мг/кг массы тела в сутки [12]. Такая разница фармокинетической активности объясняется различной растворимостью ТА в водной среде. В эксперименте, проведенном на крысах, было показано, что биодоступность атропина, анизодамина, анизодина и скополамина коррелировала с показателем их растворимости в водных средах и составила 21,62, 10,78, 80,45 и 2,52 % соответственно. Степень экскреции – почечный клиренс (С = 1 г) этих веществ составил 11,33, 54,86, 32,67 и 8,69 % соответственно [20].
Исследования на грызунах выявили факт того, что скополамин увеличивает передачу глутамата и синаптогенез (процесс формирования синапсов между нейронами в нервной системе) в медиальной префронтальной коре (mPFC). Эта область мозга вовлечена в планирование сложного когнитивного поведения, проявления личности, принятие решений и регулирование социальным поведением [21].
Биологическое действие ТА является стереоселективным вследствие различия стереоизомеров, отличающихся степенью сродства с мускариновыми рецепторами. Это приводит к разной степени воздействия S-(L)- и R-(D)-изомеров гиосциамина: S-(L)- изомер оказывает в 30–300 раз более выраженное воздействие, чем R-(D)- изомер. S-(L) изомер гиосциамина нестабилен и быстро превращается в атропин. Атропин очень стабилен в течение длительного времени. Наиболее значимое влияние атропина на организм человека осуществляется в виде тахикардии. Это происходит из-за блокады рецепторов М2, в результате чего снижается тонус блуждающего нерва [4][21–23].
Калистегины (A3, A5, B1, B2, B3, B4) – полигидроксилированные алкалоиды нортропана, согласно данным немногочисленных исследований, обладают значительно меньшим токсическим потенциалом, чем атропин и скополамин. Калистегины не проявляют каких-либо психоактивных эффектов, так как они являются гидрофильными веществами и поэтому неспособны преодолевать гематоэнцефалический барьер [4]. Показано, что при однократном пероральном введении мышам суммы калистегинов из экстракта белены белой (Hyoscyamus albus) в дозах до 2000 мг/кг массы тела у подопытных животных не наблюдалось смертности. Гистопатологические изменения печени наблюдались в дозах, превышающих 300 мг/кг массы тела. Повышение гипогликемической активность наблюдалось у мышей в дозах 10 мг/кг массы тела или 20 мг/кг массы тела. Раздельное пероральное введение калистегинов (В1, В2, В3 и С1) в течение двух недель в дозах от 1,2 до 3,0 мг/кг массы тела не вызывало у крыс никаких побочных эффектов. При пероральном однократном введении крысам экстракта белены в количестве 15 г/кг массы тела, содержащего суммарную дозу калистегинов приблизительно 8,4 мг/кг массы тела, в течение 14 дней наблюдались негативные изменения в некоторых внутренних органах. Достоверные гистопатологические изменения внутренних органов у крыс наблюдались только в отношении калистегина А3 при его однократном введении в дозе 140 мг/кг массы тела. В связи с малой изученностью токсичности калистегинов EFSA сделало вывод о необходимости более полного изучения их возможного негативного действия – данных о степени выраженности токсического действия в настоящее время недостаточно [10].
Растения, содержащие ТА. Содержание ТА в различных тканях растений, а также в зависимости от их вида составляет от 0,01 до 3 %5.
В процессе исследований в пищевой продукции было обнаружено двадцать четыре вида различных ТА. При этом гиосциамин и скополамин выявлялись в 83 % анализируемых образцов (TFSA 2014). Анализ видового состава ТА в различных органах дурмана обыкновенного (D. stramonium L.), культивируемого в Марокко, позволил идентифицировать 67 видов ТА. В семенах этого растения гиосциамин и скополамин составляли 66 и 20 % от общего содержания ТА. Гиосциамин и скополамин являются основными видами ТА, выявляемыми в растениях, принадлежащих к родам Datura spp., Brugmansia spp., Hyoscyamus spp., Scopolia spp., Atropa spp. и Duboisia spp. [10]. Далее по частоте выявления следуют анизодамин, анизодин, апогиосцин апоскополамин, гоматропин, апоатропин, 6-гидрокситропинон, ацетат скополамина, альфа-гидроксиметилатропин, конволамин, конволидин, конвольвин, филлалбин, литорин, норатропин, норскополамин, нортропинон, 3-альфа-фенилацетокситропан, псевдотропин, скопин, скополин, тропинон, калистегины А3, А5, В1, В2, В3, В4 [10].
Травяные чаи и травы, эфирные масла, загрязненные ТА, могут представлять серьезную опасность для здоровья из-за их возможного наличия в больших количествах и достаточной устойчивости к нагреванию [2][20][24–27]. Вид и концентрация ТА, продуцируемых сорным растением, определяются его видом и стадией развития, а также факторами окружающей среды [16][24]. В таблице приведены данные об уровнях содержании атропина и скополамина в различных частях дурмана обыкновенного (D. stramonium L.) (табл. 2) [16].
Растения, содержащие ТА, могут загрязнить травы во время их ненадлежащего сбора и/или переработки [2]. Использование травяных сборов, содержащих высокие концентрации ТА, в составе БАД может вызвать антихолинергический синдром и тяжелую интоксикацию [1][2][10].
Проведенная EFSA оценка уровней поступления ТА с пищей, показала, что из 44 184 проанализированных образцов пищевой продукции в 7391 образцах были TA. Большинство образов (95 %) содержали ТА в количествах ниже предела точности используемых методов исследования. В отчете сообщается о высокой частоте встречаемости атропина и скополамина в некоторых сортах чая, травах для настоев, специях, семенах конопли, злаках, а калистегинов – в корнях и клубнях культивируемых растений и продуктах из картофеля (табл. 3) [3][10].
Сообщается о наличии ТА в 70,2 % из 121 образцов травяных чаев в количествах от 71,4 до 4357,6 мкг/кг (в пересчете на сухой вес). Атропин и скополамин были выявлены в 60 и 53 % случаев соответственно. В количественном отношении в составе данных групп пищевой продукции преобладал конвольвин (синтезируется растениями сем. Convolvulaceae), содержание которого составило 72 % от суммы всех ТА. На долю атропина, скополамина и тропина приходилось 13,5 % от количества всех определяемых видов ТА. Эффективность элюирования ТА из сухих сборов трав в настои при кипячении составила для атропина 54 %, скополамина 42 %, конвольвина 23 % [2]. По результатам исследований, проведенных в Великобритании, в 16 из 20 образцов травяного чая были обнаружены ТА. При этом примерно 47 % ТА элюировались из сухих чаев в настои. Самый высокий уровень атропина – 129 мкг/кг был обнаружен в мятном чае [5]. Согласно исследованиям, проведенным EFSA, было обнаружено загрязнение продукции растительного происхождения ТА в следующих количествах (табл. 4) [3].
Проведенные исследования показали, что средняя концентрация суммы атропина и скополамина, выявленная в образцах сборов трав, травяных чаев, БАД к пище на растительной основе составила 13,4 мкг/кг, максимальная – 428 мкг/кг [3]. Выявляемые в этих видах пищевой продукции ТА являются производными тропинона. Полученные сведения дают основание полагать, что содержание ТА в некоторых травяных чаях (например, на основе мяты) может превышать установленный уровень разового безопасного поступления (ARfD) – 0,016 мкг/кг массы тела (сумма атропина и скополамина), что свидетельствует о необходимости нормирования ТА в БАД к пище на растительной основе, травяных сборах и настоях. В связи с тем, что в данных видах пищевой продукции чаще всего обнаруживаются атропин и скополамин, а скополамин является производным гиосциамина (атропина), следует установить максимально допустимый уровень содержания атропина в БАД к пище на основе трав, травяных сборах, настоях, учитывая сведения, содержащиеся в Постановлении ЕС 2021/1408 от 27.08.20216.
Таблица 1. Классификация ТА по химическому строению
Table 1. Classification of tropane alkaloids (TAs) by their chemical structure
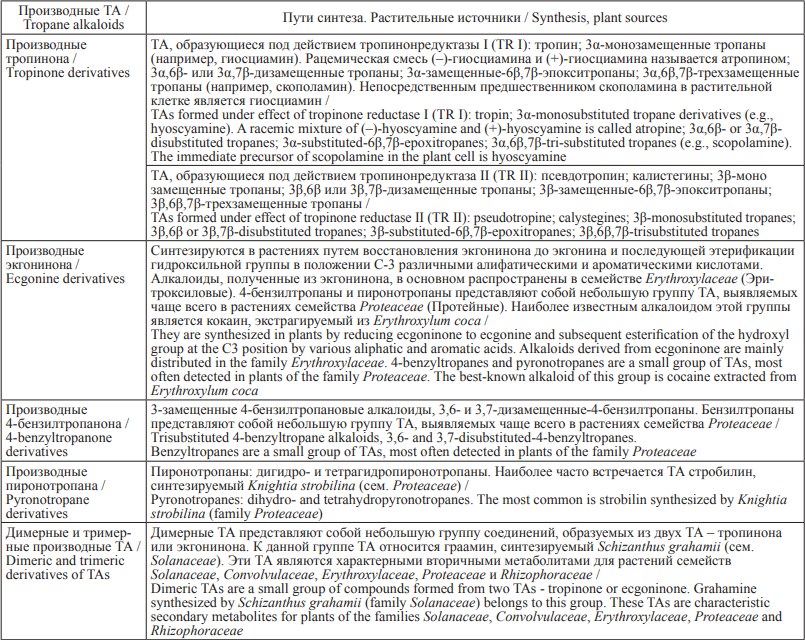
Таблица 2. Концентрация (мкг/мг) атропина и скополамина в различных частях растения Datura stramonium
Table 2. Concentrations of tropane alkaloids in Datura stramonium
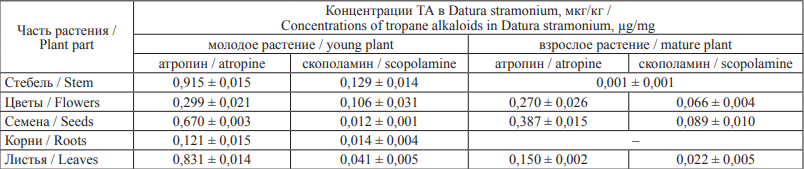
Таблица 3. Результаты анализа содержание ТА в травах, используемых в составе травяных чаев и БАД к пище на растительной основе
Table 3. The results of analyzing the contents of tropane alkaloids in herbs used in herbal teas and plant-based dietary supplements
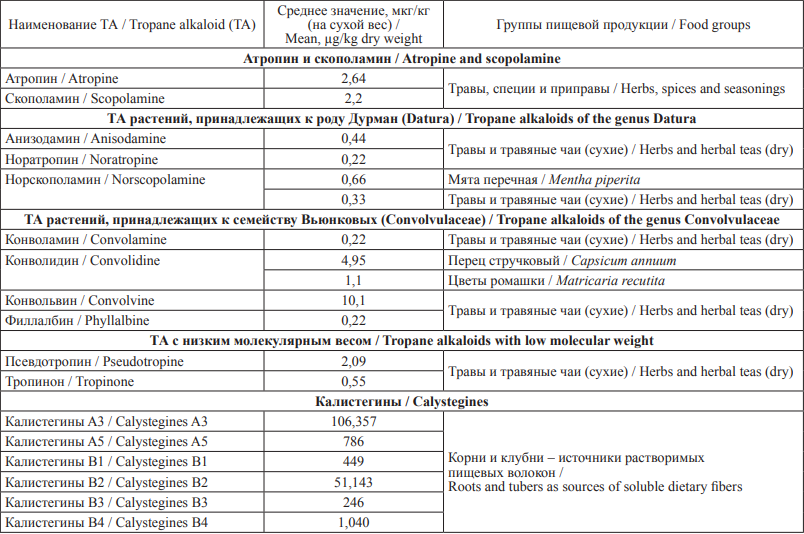
Таблица 4. Содержание ТА в продукции растительного происхождения
Table 4. Levels of tropane alkaloids (TAs) in foods of plant origin
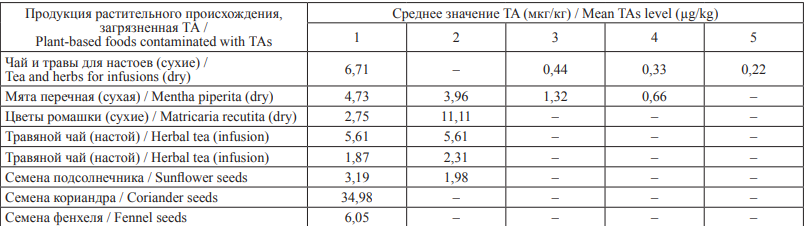
Примечание: 1 – Атропин, 2 – Скополамин, 3 – Анизодамин, 4 – Норскополамин, 5 – Норатропин; «–» – не обнаружено.
Notes: 1 – Atropine, 2 – Scopolamine, 3 – Anisodamine, 4 – Norscopolamine, 5 – Noratropine. “–” – not detected.
Методы выявления ТА. Контроль содержания загрязнителей пищевых продуктов невозможен без установления методов их анализа. В настоящее время с целью анализа содержания тропановых алкалоидов (в т. ч. атропина) в пищевой продукции используются: спектроскопические методы (метод детекции в ультрафиолетовом спектре, флуоресцентный анализ с использованием амфифильного комплекса цинка (II) с шиффовым основанием), радиоиммуноанализ (RIA), иммуноферментный анализ (ELISA), метод газовой хроматографии (ГХ), а также метод газовой хроматографии в сочетании с масс-спектрометрией (ГХ-МС), метод высокоэффективной жидкостной хроматографии (ВЭЖХ), а также ВЭЖХ-МС метод, метод капиллярного электрофореза [28–30].
Сравнительный анализ чувствительности, специфичности и степени воспроизводимости этих методов показал, что наиболее приемлемым методом выявления ТА на современном этапе являются методы ВЭЖХ и ВЭЖХ-МС. Согласно данным различных авторов чувствительность этих методов (в зависимости от условий анализа) составляет 0,7–15 мкг ТА на 1 кг семян (пшеница, рожь, кукуруза, соя, льняное семя). Такая чувствительность позволяет эффективно проводить анализ ТА в переработанных пищевых продуктах на основе зерна, БАД к пище на растительной основе, травяных сборах и настоях [20].
В настоящее время в РФ разработан и утвержден количественный метод определения атропина в зерне и зерновой продукции при помощи высокоэффективной жидкостной хроматографии в сочетании с масс-спектрометрическим анализом (ВЭЖХ-МС/МС), который отличается хорошей воспроизводимостью, селективностью, высокой чувствительностью и надежностью, а также отсутствием необходимости использования дериватизации образцов7. Диапазон концентраций атропина, определяемых данным методом, составляет от 0,01 до 0,0002 мг/кг. Считаем возможным использование этого метода и при контроле содержания атропина в БАД к пище на растительной основе, травяных сборах и настоях при условии разработки соответствующих методов подготовки образцов.
Обсуждение. В последние годы появились сообщения о возможном загрязнении БАД к пище на растительной основе, травяных сборов, настоев ТА – вторичными метаболитами сорных растений, принадлежащих семействам Brassicaceae, Solanaceae, Erythroxylaceae, Convolvulaceae и Proteaceae. Эти виды пищевой продукции относятся наряду с зерновыми продуктами к пищевой продукции с наиболее высокими содержанием и частотой выявления ТА. В процессе исследований этих видов пищевой продукции было обнаружено двадцать четыре вида различных ТА. Все они относятся к производным тропинона. При этом атропин (рацемическая смесь (–)-гиосциамина и (+)-гиосциамина) и скополамин выявлялись в большинстве анализируемых образцов и в наибольших количествах. Проведенные оценки рисков показали, что содержание ТА в некоторых травяных чаях по сумме атропина и скополамина может превышать установленный уровень разового безопасного поступления (ARfD) – 0,016 мкг/кг массы тела. В связи с тем что скополамин является производным гиосциамина (атропина), оценку безопасности пищевой продукции, в том числе БАД к пище на растительной основе, травяных сборов и настоев, следует проводить на основе данных об уровне содержания в них атропина. Такой подход позволит проводить эффективный мониторинг загрязненности ТА всех видов пищевой продукции на растительной основе, в том числе БАД к пище на основе трав, травяных сборов и настоев. В настоящее время в РФ разработан и утвержден количественный метод определения атропина в зерне и зерновой продукции при помощи высокоэффективной жидкостной хроматографии в сочетании с масс-спектрометрическим анализом (ВЭЖХ-МС/МС). Вместе с тем следует разработать метод определения атропина в БАД к пище на растительной основе, травяных сборах, настоях, а также установить его максимально допустимый уровень содержания в данной категории пищевой продукции.
Заключение. Для безопасного использования травяных сборов и БАД к пище на растительной основе рекомендовано проведение мониторинга данных видов пищевой продукции на наличие в них ТА. Считаем возможным в ходе контрольно-надзорных мероприятий в качестве индикаторного показателя безопасности БАД к пище на растительной основе, травяных чаев и настоев по содержанию в них ТА использовать значения содержания в них атропина. С целью эффективного мониторинга и контроля этих видов пищевой продукции по содержанию ТА считаем необходимым разработать метод их анализа с использованием высокоэффективной жидкостной хроматографии в сочетании с масс-спектрометрическим анализом (ВЭЖХ-МС/МС).
1. Распоряжение Правительства РФ от 12.10.2019 № 2406-р (ред. от 23.12.2021) «Об утверждении перечня жизненно необходимых и важнейших лекарственных препаратов, а также перечней лекарственных препаратов для медицинского применения и минимального ассортимента лекарственных препаратов, необходимых для оказания медицинской помощи». Доступно по: http://www.consultant.ru/document/cons_doc_LAW_335635/.
2. WHO Model Lists of Essential Medicines. Доступно по: https://www.who.int/medicines/publications/essentialmedicines/en/.
3. Постановление Правительства РФ от 12.10.2021 № 1737 «Об утверждении Правил переработки наркотических средств, психотропных веществ и их прекурсоров и признании утратившими силу некоторых актов и отдельных положений некоторых актов Правительства Российской Федерации». Доступно по: http://www.consultant.ru/law/hotdocs/71367.html/.
4. Постановление Правительства РФ от 01.10.2012 № 1002 (ред. от 24.01.2022) «Список наркотических средств и психотропных веществ, оборот которых в Российской Федерации запрещен в соответствии с законодательством Российской Федерации и международными договорами Российской Федерации (список I)». Доступно по: http://www.consultant.ru/document/cons_doc_LAW_136206/.
5. Executive Summary of the Joint FAO/WHO Expert meeting on tropane alkaloids, March 30 –April 3, 2020. www.fao.org/fao-who-codexalimentarius/en/.
6. Commission Regulation (EU) 2021/1408 of August 27, 2021 amending Regulation (EC) No 1881/2006 as regards maximum levels of tropane alkaloids in certain foodstuffs. Official Journal of the European Union. L 304, 30.8.2021.
7. Определение атропина в зерне злаковых культур методом высокоэффективной жидкостной хроматографии в сочетании с масс-спектрометрическим анализом (ВЭЖХ-МС/МС). Свидетельство об аттестации методики (метода) измерений № 0175/РОСС RU.001.310430/2020. Метод разработан ФГБУН «ФИЦ питания и биотехнологии». Авторы: В.А. Тутельян, Д.Б. Никитюк, С.А. Хотимченко, И.Е. Соколов, О.В. Багрянцева, А.Д. Малинкин, В.В. Бессонов, А.И. Колобанов, Е.В. Елизарова.
Список литературы
1. Soulaidopoulos S., Sinakos E., Dimopoulou D., Vettas C., Cholongitas E., Garyfallos A. Anticholinergic syndrome induced by toxic plants. World J Emerg Med. 2017; 8 (4): 297-301. doi: 10.5847/wjem.j.1920-8642.2017.04.009
2. Chan T. Y. K. Worldwide occurrence and investigations of contamination of herbal medicines by tropane alkaloids. Toxins (Basel). 2017; 9 (9): 284. doi: 10.3390/toxins9090284
3. European Food Safety Authority (EFSA); Arcella D., Altieri A., Horváth Z. Human acute exposure assessment to tropane alkaloids. EFSA J. 2018;16 (2): e05160. doi: 10.2903/j.efsa.2018.5160
4. Kim N., Estrada O., Chavez B., Stewart C., D’Auria J. C. Tropane and granatane alkaloid biosynthesis: A systematic analysis. Molecules. 2016; 21 (11): 1510. doi: 10.3390/molecules21111510
5. Stratton J., Clough J., Leon I., Sehlanova M., MacDonald S. Monitoring of Tropane Alkaloids in Food: Final Report. FS 102116. Fera Science Ltd.; 2017. Accessed April 25, 2022. https://www.food.gov.uk/sites/default/files/media/document/fs102116finalreport.pdf
6. Philipov S., Doncheva T. Alkaloids derived from ornithine: Tropane alkaloids. In: Ramawat K., Mérillon J. M., eds. Natural Products. Springer, Berlin, Heidelberg; 2013: 343-358. doi: 10.1007/978-3-642-22144-6_8
7. Cinelli M. A., Jones A. D. Alkaloids of the Genus Datura: Review of a rich resource for natural product discovery. Molecules. 2021; 26 (9): 2629. doi: 10.3390/molecules26092629
8. Головкин Б. Н. Биологически активные вещества растительного происхождения: В трех томах. – Москва: Федеральное государственное унитарное предприятие «Академический научно-издательский, производственно-полиграфический и книгораспространительский центр «Наука», 2001. – Т. 1. – 764 с.
9. Compendium of botanicals reported to contain naturally occuring substances of possible concern for human health when used in food and food supplements. EFSA J. 2012; 10 (5): 2663. doi: 10.2903/j.efsa.2012.2663
10. Mulder P., de Nijs M., Castellari M., et al. Occurrence of tropane alkaloids in food. EFSA Support Publ. 2016; 13 (12): 1140E. doi: 10.2903/sp.efsa.2016.EN-1140
11. Багрянцева О. В. О регламентации тропановых алкалоидов в зерновых продуктах / О. В. Багрянцева [и др.] // Вопросы питания. – 2020. – Т. 89. – № 3. – С. 54–61: doi: 10.24411/0042-8833-2020-10029
12. EFSA Panel on Contaminants in the Food Chain (CONTAM). Scientific Opinion on Tropane alkaloids in food and feed. EFSA J. 2013; 11 (10): 3386. doi: 10.2903/j.efsa.2013.3386
13. European Food Safety Authority (EFSA); Arcella D.,Altieri A., Horváth Z. Human acute exposure assessment to tropane alkaloids. EFSA J. 2018; 16 (2): e05160. doi: 10.2903/j.efsa.2018.5160
14. Eguchi R., Ono N., Hirai Morita A., et al. Classification of alkaloids according to the starting substances of their biosynthetic pathways using graph convolutional neural networks. BMC Bioinformatics. 2019; 20 (1): 380. doi: 10.1186/s12859-019-2963-6
15. Kerchner A., Farkas А. Worldwide poisoning potential of Brugmansia and Datura. Forensic Toxicol. 2020; 38: 30-41. doi: 10.1007/s11419-019-00500-2
16. Sharma M., Dhaliwal I., Rana K., Delta A. K., Kaushik P. Phytochemistry, pharmacology, and toxicology of Datura Species – A review. Antioxidants (Basel). 2021; 10 (8): 1291. doi: 10.3390/antiox10081291
17. Gonçalves J., Luís В., Gallardo E., Duarte A. P. Psychoactive substances of natural origin: Toxicological aspects, therapeutic properties and analysis in biological samples. Molecules. 2021; 26 (5): 1397. doi: 10.3390/molecules26051397
18. Nachum Z., Shahal B., Shupak A., et al. Scopolamine bioavailability in combined oral and transdermal delivery. J Pharmacol Exp Ther. 2001; 296 (1): 121-123.
19. Gonçalves C., Cubero-Leon E., Stroka J. Determination of tropane alkaloids in cereals, tea and herbal infusions: Exploiting proficiency testing data as a basis to derive interlaboratory performance characteristics of an improved LC-MS/MS method. Food Chem. 2020; 331: 127260. doi: 10.1016/j.foodchem.2020.127260
20. Romera-Torres A., Romero-González R., Martínez Vidal J. L., Frenich A. G. Simultaneous analysis of tropane alkaloids in teas and herbal teas by liquid chromatography coupled to high-resolution mass spectrometry (Orbitrap). J Sep Sci. 2018; 41 (9): 1938-1946. doi: 10.1002/jssc.201701485
21. Debnath B., Singh W. S, Das M., et al. Role of plant alkaloids on human health: A review of biological activities. Mater Today Chem. 2018; 9: 56-72; doi: 10.1016/j.mtchem.2018.05.001
22. Kohnen-Johannsen K. L., Kayser O. Tropane alkaloids: Chemistry, pharmacology, biosynthesis and Production. Molecules. 2019; 24 (4): 796. doi: 10.3390/molecules24040796
23. Park L., Furey M., Nugent A. C., et al. Neurophysiological changes associated with antidepressant response to ketamine not observed in a negative trial of scopolamine in major depressive disorder. Int J Neuropsychopharmacol. 2019; 22 (1): 10-18. doi: 10.1093/ijnp/pyy051
24. Marín-Sáez J., Romero-González R., Garrido Frenich A. Multi-analysis determination of tropane alkaloids in cereals and solanaceaes seeds by liquid chromatography coupled to single stage Exactive-Orbitrap. J Chromatogr A. 2017; 1518: 46-58. doi: 10.1016/j.chroma.2017.08.052
25. Shimshoni J. A., Duebecke A., Mulder P. P., Cuneah O., Barel S. Pyrrolizidine and tropane alkaloids in teas and the herbal teas peppermint, rooibos and chamomile in the Israeli market. Food Addit Contam Part A Chem Anal Control Expo Risk Assess. 2015; 32 (12): 2058-2067. doi: 10.1080/19440049.2015.1087651
26. Vaclavik L., Krynitsky A. J., Rader J. I. Targeted analysis of multiple pharmaceuticals, plant toxins and other secondary metabolites in herbal dietary supplements by ultra-high performance liquid chromatography-qu-adrupole-orbital ion trap mass spectrometry. Anal Chim Acta. 2014; 810: 45-60. doi: 10.1016/j.aca.2013.12.006
27. Chan W. S., Wong G. F., Hung C. W., et al. Interpol review of toxicology 2016–2019. Forensic Sci Int Synerg. 2020; 2: 563-607. doi: 10.1016/j.fsisyn.2020.01.018
28. Jones N. S., Comparin J. H. Interpol review of controlled substances 2016–2019. Forensic Sci Int Synerg. 2020; 2: 608-669. doi: 10.1016/j.fsisyn.2020.01.019
29. Zheng W., Yoo K. H., Choi J. M., et al. A modified QuE-ChERS method coupled with liquid chromatography-tandem mass spectrometry for the simultaneous detection and quantification of scopolamine, L-hyoscyamine, and sparteine residues in animal-derived food products. J Adv Res. 2018; 15: 95-102. doi: 10.1016/j.jare.2018.09.004
30. Dzuman Z., Jonatova P., Stranska-Zachariasova M., et al. Development of a new LC-MS method for accurate and sensitive determination of 33 pyrrolizidine and 21 tropane alkaloids in plant-based food matrices. Anal Bioanal Chem. 2020; 412 (26): 7155-7167. doi: 10.1007/s00216-020-02848-6
Об авторах
А. И. КоротковаРоссия
Алена Игоревна Короткова, врач по гигиене питания, аспирант
ФБУЗ «Центр гигиены и эпидемиологии в городе Москве»
отдел гигиены питания
129626
Графский пер., д. 4, корп. 2, 3, 4
109240
Устьинский пр-д, д. 2/14
Москва
О. В. Багрянцева
Россия
Ольга Викторовна Багрянцева, д. б. н., ведущий научный сотрудник, профессор
лаборатория пищевой токсикологии и оценки безопасности нанотехнологий
109240
Устьинский пр-д, д. 2/14
ФГАОУ ВО «Первый Московский государственный медицинский университет им. И. М. Сеченова»
кафедра гигиены питания и токсикологии
119048
ул. Трубецкая, д. 8, стр. 2
Москва
И. Е. Соколов
Россия
Илья Евгеньевич Соколов, младший научный сотрудник
лаборатория пищевой токсикологии и оценки безопасности нанотехнологий
109240
Устьинский пр-д, д. 2/14
Москва
В. М. Глиненко
Россия
Виктор Михайлович Глиненко, д. м. н., профессор, заведующий кафедрой
ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А. И. Евдокимова»
кафедра общей гигиены
127473
ул. Делегатская, д. 20, стр. 1
Москва
Рецензия
Для цитирования:
Короткова А.И., Багрянцева О.В., Соколов И.Е., Глиненко В.М. Вопросы безопасности травяных сборов и БАД к пище, загрязненных тропановыми алкалоидами (обзор). Здоровье населения и среда обитания – ЗНиСО. 2022;(4):54-62. https://doi.org/10.35627/2219-5238/2022-30-4-54-62
For citation:
Korotkova A.I., Bagryantseva O.V., Sokolov I.E., Glinenko V.M. Issues of Safety of Herb Mixes and Food Supplements Contaminated with Tropane Alkaloids: A Review. Public Health and Life Environment – PH&LE. 2022;(4):54-62. (In Russ.) https://doi.org/10.35627/2219-5238/2022-30-4-54-62









.png)



























