Перейти к:
Особенности генетического полиморфизма генов GSTM1, GSTT1, GSTP1 у рабочих Нижнетагильского металлургического комбината с заболеваниями сердечно-сосудистой системы
https://doi.org/2219-5238/2021-29-12-36-40
Аннотация
Введение. На формирование сердечно-сосудистых патологий влияют не только условия труда рабочих, но и генетические особенности организма. Генетические вариации генов GSTM1, GSTT1 и GSTP1 вносят вклад в индивидуальные различия в реакции на химические и канцерогенные соединения.
Цель исследования — изучить особенности генетического полиморфизма генов GSTM1, GSTT1 и GSTP1 у работающих на предприятии Нижнетагильского металлургического комбината с заболеваниями сердечно-сосудистой системы.
Материалы и методы. В группе наблюдения был обследован 61 человек, мужчины, работающие в конвертерном цехе, в возрасте от 33 до 61 года (средний возраст 48,15 ± 7,50 года) с патологией сердечно-сосудистой системы. Группу сравнения составили 29 человек, мужчины, условно здоровые работники предприятия без проявления признаков сердечно-сосудистой патологии, возраст от 23 до 56 лет. ДНК выделяли из периферической крови по стандартной методике. Определение делеционного полиморфизма генов GSTM1, GSTT1 проводилось методом qPCR, определение полиморфизма Ile105Val гена GSTP1 методом qPCR производилось с помощью готового коммерческого набора.
Результаты. Не было обнаружено статистически значимой разницы между группами ни по одному из исследуемых генов. Частота встречаемости сочетания GSTM1 (0/0) и GSTT1 (0/0) у группы наблюдения составила 14 %, а у группы сравнения – 11 %. Однако статистически достоверной разницы между группами обнаружено не было.
Выводы. В результате проведенного нами исследования было установлено, что присутствие нулевых генотипов GSTM1, GSTT1, а также мутантного аллеля GSTP1 и сопряженная с этим потеря функциональной активности фермента не вносят весомый вклад в развитие сердечно-сосудистых заболеваний в условиях влияния производственной среды.
Ключевые слова
Для цитирования:
Шаихова Д.Р., Амромина А.М., Ситников И.А., Сутункова М.П., Гурвич В.Б., Астахова С.Г. Особенности генетического полиморфизма генов GSTM1, GSTT1, GSTP1 у рабочих Нижнетагильского металлургического комбината с заболеваниями сердечно-сосудистой системы. Здоровье населения и среда обитания – ЗНиСО. 2021;1(12):36-40. https://doi.org/2219-5238/2021-29-12-36-40
For citation:
Shaikhova D.R., Amromina A.M., Sitnikov I.A., Sutunkova M.P., Gurvich V.B., Astakhova S.G. Features of GSTM1, GSTT1 and GSTP1 Genetic Polymorphism in Nizhny Tagil Metallurgical Plant Workers with Cardiovascular Diseases. Public Health and Life Environment – PH&LE. 2021;1(12):36-40. (In Russ.) https://doi.org/2219-5238/2021-29-12-36-40
Введение. В настоящее время остро ощущается проблема роста преждевременной смертности трудоспособного населения, а также увеличения уровня трудопотерь, вызванных развитием профессиональных заболеваний. На формирование данных патологий влияют не только условия труда рабочих (тяжесть трудового процесса, свойства и дозы экспонированных аэрозолей и т. д.), но и генетические (индивидуальные) особенности организма. Поэтому важной задачей современной медицины труда является оценка роли не только экзогенных факторов (условий труда), но и эндогенных (генетических) факторов, способствующих развитию профессиональных патологий у работающего населения, с целью выявления потенциальных групп риска и своевременного проведения профилактико-диагностических мероприятий [1][2].
В воздухе рабочей зоны на металлургических предприятиях встречается большое количество ксенобиотиков: марганец, железо, ванадий, хром, никель, сера и т. д. [3]. Известно, что их попадание в организм может вызывать окислительный стресс и, как следствие, возникновение различных заболеваний [2][4]. Сердечно-сосудистые заболевания (ССЗ) тесно связаны с окислительным стрессом, который играет важную роль в патофизиологии. Почти каждый третий работающий во вредных условиях труда в Свердловской области имеет заболевания сердечно-сосудистой системы, которые являются ведущими среди причин смертности населения трудоспособного возраста, в том числе случаев смерти на производстве [1].
Глутатион-S-трансферазы (GST) потенциально играют важную роль в снижении окислительного стресса, а генетические полиморфизмы генов GST могут объяснить вариабельные реакции человека на воздействие ксенобиотиков [5][6]. Генетические вариации генов GSTM1, GSTT1 и GSTP1 вносят вклад в индивидуальные различия в реакции на химические и канцерогенные соединения. Нулевой генотип GSTM1 или GSTT1 приводит к полному отсутствию активности фермента, а GSTP1 Ile105Val – к снижению активности этого фермента [7–9]. Комбинированные мутации в этих генах могут изменять потенциальные риски, вызванные токсичными веществами или продуктами стадий окислительного стресса и воспаления [4]. Накопленные к настоящему времени сведения не создают ясной картины о связи нулевых генотипов GST с риском развития ССЗ.
Цель исследования – изучить особенности генетического полиморфизма генов GSTM1, GSTT1 и GSTP1 у работающих на предприятии нижнетагильского металлургического комбината с заболеваниями сердечно-сосудистой системы.
Материалы и методы. В группе наблюдения было обследовано 61 человек, мужчины, работающие в конвертерном цехе, возраст от 33 до 61 года (средний возраст 48,15 ± 7,50 года), с патологией сердечно-сосудистой системы, относящейся по МКБ-10 к классу болезней I00-I99, занятые на рабочих местах огнеупорщика, разливщика стали, оператора загрузки конвертера, слесаря-ремонтника, электрогазосварщика, сталевара конвертера, машиниста крана металлургического производства, электромонтера по ремонту и обслуживанию электрооборудования, машиниста дистрибутора, шлаковщика, миксерового, ковшевого, оператора машины непрерывного литья заготовок, машиниста транспортировщика горячего металла, сталевара установки внепечной обработки стали, шихтовщика. Группу сравнения составили 29 человек, мужчины, условно здоровые работники предприятия без проявления признаков сердечно-сосудистой патологии, возраст от 23 до 56 лет (средний возраст 44,03 ± 7,63 года). ДНК выделяли из периферической крови по стандартной методике с использованием набора diaGene для выделения ДНК из цельной крови на спин-колонках. Для определения делеционного полиморфизма генов GSTM1, GSTT1 были использованы последовательности праймеров, которые перечислены в табл. 1.
Таблица 1. Последовательность праймеров [10]
Table 1. Sequence of primers [10]

Состав ПЦР-смеси: БиоМастер HS-qPCR SYBR Blue, прямой и обратный праймеры – по 0,2 мкм каждый, вода и образец ДНК. Амплификация проводилась с помощью амплификатора Quant Studio 3 (Thermo Scientific, США) со следующими условиями: начальная денатурация 5 мин при 95 °С; далее 40 циклов по три шага: денатурация – 15 сек. при 95 °С, отжиг праймеров – 15 сек. при 60 °С, элонгация – 30 сек. при 72 °С. Начальная температура кривых плавления – 59 °С, регистрация флуоресцентного сигнала производилась непрерывно, скорость повышения температуры составляла 0,15 °С/сек. Полученные результаты интерпретировали исходя из анализа графиков накопления флюоресценции, специфичность оценивалась с помощью кривой плавления.
Наличие гомозиготной делеции в генах GSTT1 и GSTM1 регистрировалось только при условии амплификации гена ALB как позитивного контроля. Определение полиморфизма Ile105Val гена GSTP1 методом qPCR производилось с помощью готового коммерческого набора «SNP-Скрин» (Синтол, Россия). Популяционные частоты аллельных вариантов вычисляли на основе наблюдаемых частот генотипов.
Для сравнения частот генотипов в группах больных и контроля применяли критерии χ2 и χ2 с поправкой Йейтса для таблиц сопряженности 2 × 2. Статистическая обработка результатов проводилась с использованием пакета программ Statistica 12 (StatSoft Inc., USA).
Результаты и обсуждение. В настоящем исследовании мы оценили частоты полиморфизмов GSTT1, GSTM1 и GSTP1, которые могут влиять на индивидуальную восприимчивость к CСЗ, и проверили SNP, которые, как считается, влияют на ферментативную активность.
Не было обнаружено статистически значимой разницы между группами ни по одному из исследуемых генов. Распределение частот генотипов, достоверность различий и значение критерия χ2 представлены в табл. 2.
Таблица 2. Распределение частот генотипов по генам GSTM1, GSTT1, GSTP1 у работающих с сердечно-сосудистой патологией
Table 2. Distribution of genotype frequencies by GSTM1, GSTT1 and GSTP1 genes in workers with cardiovascular diseases
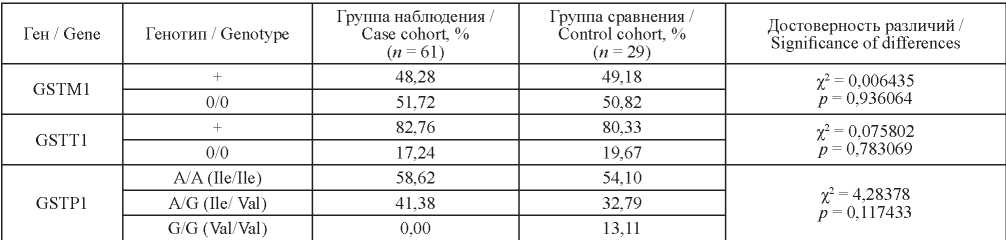
Также были посчитаны сочетания нулевых генотипов GSTM1 и GSTT1. Так, частота встречаемости сочетания GSTM1 (0/0) и GSTT1 (0/0) у группы наблюдения составила 14 %, а у группы сравнения – 11 %. Однако статистически достоверной разницы между группами обнаружено не было.
Для полиморфизмов GSTT1, GSTM1 и GSTP1 распределение частот генотипов в изученных выборках соответствовало ожидаемому при равновесии Харди – Вайнберга. Известно, что
частота полиморфных делеционных вариантов генов GSTT1, GSTM1 и GSTP1 различается в разных популяциях [11–13]. Нулевой вариант аллеля GSTM1 чрезвычайно широко распространен в человеческой популяции – так, частота делеционного генотипа в Европе составляет 42–58 % [13], что согласуется с полученными нами данными. Частота гомозиготного по «нулевому» аллелю GSTT1 генотипа в популяциях европеоидов составляет 15–30 % [11], а гомозиготного мутантного генотипа (Val/Val) GSTP1 – 10–20 % [12], что также согласуется с полученными нами данными.
В ходе аэробного метаболизма в клетках постоянно происходят реакции с образованием активных форм кислорода, которые представлены в виде гидроксильных радикалов, пероксида водорода, окиси азота и т. д. В связи с их высокой реакционной способностью, данные соединения приводят к окислительному стрессу.
Система обезвреживания с участием GSTs и глутатиона играет важную роль в формировании резистентности организма к самым различным воздействиям и является надежным защитным механизмом клетки. Помимо участия цитозольных GSTs в реакциях конъюгации и изомеризации, они могут ковалентно и нековалентно связывать гидрофобные несубстратные лиганды, что необходимо для внутриклеточного транспорта, изоляции и ликвидации ксенобиотиков [14]. Таким образом, во второй фазе детоксикации ферменты семейства GSTs играют ключевую роль в процессах обезвреживания чужеродных веществ в клетках [15].
Полиморфизм, выявленный в генах данного генного суперсемейства, может оказывать свое непосредственное влияние на активность кодируемых ферментов, что в конечном счете способно приводить к изменениям в клеточном метаболизме.
В исследовании Sobha S.P. et al. было показано, что обнаружение нулевых мутаций GSTM1 и GSTT1 и полиморфизма GSTP1 имеет клиническое значение и может использоваться как биомаркер для ранней диагностики развития ССЗ и ССЗ при сахарном диабете (СД) [6]. В исследовании, проведенном в Малайзии, также были получены достоверные данные о связи делеционного полиморфизма GSTT1 с развитием ССЗ при СД [16]. Другое исследование обнаружило связь риска сердечной недостаточности с аллелем GSTP1 Val [17]. В работе не было выявлено никаких значимых ассоциаций между генотипом GSTT1 и сердечно-сосудистыми заболеваниями, но было продемонстрировано, что нулевой генотип GSTM1 защищает как от ишемической болезни сердца, так и от острого инфаркта миокарда [18], однако исследование Phulukdaree A. et al. показало, что нулевой генотип GSTM1 связан с повышенным в 2,6 раза риском развития ишемической болезни сердца [19]. Исследование, проведенное в Северной Индии, подтвердило связь нулевого генотипа GSTT1 и ишемической болезни сердца [20]. В то же время в ряде исследовании не было показано значительной разницы в частотах нулевых генотипов GSTT1 и GSTM1 между пациентами и контрольной группой [21–23].
Однако данных о связи развития ССЗ в условиях неблагоприятного воздействия факторов окружающей среды и полиморфизма генов GST, которые опровергали или подтверждали полученные нами результаты, обнаружено не было.
Заключение. В результате проведенного нами исследования было установлено, что присутствие нулевых генотипов GSTM1, GSTT1, а также мутантного аллеля GSTP1 и сопряженная с этим потеря функциональной активности фермента не вносят весомый вклад в развитие ССЗ в условиях влияния производственной среды. Возможно, это связано с тем, что в биотрансформации ксенобиотиков участвуют более 200 ферментных систем, которые частично взаимозаменяют друг друга [24].
Список литературы
1. Газимова В.Г., Рузаков В.О., Шастин А.С., Федорук А.А., Гурвич В.Б., Плотко Э.Г. Основные организационные вопросы профилактики заболеваемости работающего населения в современных условиях // Медицина труда и промышленная экология. 2018. № 11. С. 32–35.
2. Gong M, Dong W, Shi Z, Xu Y, Ni W, An R. Genetic polymorphism of GSTM1, GSTT1, and GSTP1 with prostate cancer risk: a meta-analysis of 57 studies. PloS One. 2012;7(11):e50587. doi: 10.1371/journal.pone.0050587
3. Шмакова Е.Е., Липатов Г.Я., Адриановский В.И., Самылкин А.А., Гусельников С.Р., Гоголева О.И. Гигиенические факторы воздушной среды и их роль в формировании онкологической опасности в гидрометаллургическом производстве меди // Здоровье населения и среда обитания. 2018. № 12(309). С. 15–18.
4. Sirivarasai J, Wananukul W, Kaojarern S, et al. Association between inflammatory marker, environmental lead exposure, and glutathione S-transferase gene. Biomed Res Int. 2013:474963. doi: 10.1155/2013/474963
5. Sun P, Qian J, Zhang ZB, et al. Polymorphisms in phase I and phase II metabolism genes and risk of chronic benzene poisoning in a Chinese occupational population. Carcinogenesis. 2008;29(12):2325–2329. doi: 10.1093/carcin/bgn208
6. Sobha SP, Ebenezar K. Susceptibility of glutathioneS-transferase polymorphism to CVD development in type 2 diabetes mellitus – A review. Endocr Metab Immune Disord Drug Targets. 2021. doi: 10.2174/1871530321666210908115222
7. Nourozi MA, Neghab M, Bazzaz JT, Nejat S, Mansoori Y, Shahtaheri SJ. Association between polymorphism of GSTP1, GSTT1, GSTM1 and CYP2E1 genes and susceptibility to benzene-induced hematotoxicity. Arch Toxicol. 2018;92(6):1983–1990. doi: 10.1007/s00204-017-2104-9
8. Klusek J, Głuszek S, Klusek J. GST gene polymorphisms and the risk of colorectal cancer development. Contemp Oncol (Pozn). 2014;18(4):219–221. doi: 10.5114/wo.2014.41388
9. Farmohammadi A, Arab-Yarmohammadi V, Ramzanpour R. Association analysis of rs1695 and rs1138272 variations in GSTP1 gene and breast cancer susceptibility. Asian Pac J Cancer Prev. 2020;21(4):1167–1172. doi: 10.31557/APJCP.2020.21.4.1167
10. Koh W-P, Nelson HH, Yuan J-M, et al. Glutathione S-transferase (GST) gene polymorphisms, cigarette smoking and colorectal cancer risk among Chinese in Singapore. Carcinogenesis. 2011;32(10):1507–1511. doi: 10.1093/carcin/bgr175
11. Фетисова И.Н., Межинский С.С., Чаша Т.В., Ратникова С.Ю., Фетисов Н.С. Полиморфизм генов системы детоксикации // Вестник Ивановской медицинской академии. 2014. Т. 19. № 4. С. 50–58.
12. Landi S. Mammalian class theta GST and differential susceptibility to carcinogens: a review. Mutat Res. 2000;463(3):247–283. doi: 10.1016/s1383-5742(00)00050-8
13. Palma-Cano LE, Córdova EJ, Orozco L, et al. GSTT1 and GSTM1 null variants in Mestizo and Amerindian populations from northwestern Mexico and a literature review. Genet Mol Biol. 2017;40(4):727–735. doi: 10.1590/1678-4685-GMB-2016-0142
14. Pajaud J, Kumar S, Rauch C, Morel F, Aninat C. Regulation of signal transduction by glutathione transferases. Int J Hepatol. 2012;2012:137676. doi: 10.1155/2012/137676
15. Di Pietro G, Magno L, Rios-Santos F. Glutathione S-transferases: an overview in cancer research. Expert Opin Drug Metab Toxicol. 2010;6(2):153–170. doi: 10.1517/17425250903427980
16. Etemad A, Vasudevan R, Aziz AF, et al. Analysis of selected glutathione S-transferase gene polymorphisms in Malaysian type 2 diabetes mellitus patients with and without cardiovascular disease. Genet Mol Res. 2016;15(2). doi: 10.4238/gmr.15025845
17. Simeunovic D, Odanovic N, Pljesa-Ercegovac M, et al. Glutathione transferase P1 polymorphism might be a risk determinant in heart failure. Dis Markers. 2019:6984845. doi: 10.1155/2019/6984845
18. Wilson MH, Grant PJ, Kain K, Warner DP, Wild CP. Association between the risk of coronary artery disease in South Asians and a deletion polymorphism in glutathione S-transferase M1. Biomarkers. 2003;8(1):43–50. doi: 10.1080/1354750021000042439
19. Phulukdaree A, Khan S, Moodley D, Chuturgoon AA. GST polymorphisms and early-onset coronary artery disease in young South African Indians. S Afr Med J. 2012;102(7):627–630. doi: 10.7196/samj.5520
20. Girisha KM, Gilmour A, Mastana S, et al. T1 and M1 polymorphism in glutathione S-transferase gene and coronary artery disease in North Indian population. Indian J Med Sci. 2004;58(12):520–526.
21. Türkanoğlu A, Can Demirdöğen B, Demirkaya Ş, Bek S, Adali O. Association analysis of GSTT1, GSTM1 genotype polymorphisms and serum total GST activity with ischemic stroke risk. Neurol Sci. 2010;31(6):727–734. doi: 10.1007/s10072-010-0330-5
22. Samuel AM, Kollu R, Rao S, Rao A. Serum total glutathione-S-transferase in stroke, a preliminary report. Clin Chem Lab Med. 2004;42(8):984–986. doi: 10.1515/CCLM.2004.162
23. Pourkeramati A, Mehrjardi EZ, Tezerjani MD, Seifati SM. Association of GSTP1, GSTT1 and GSTM1 gene variants with coronary artery disease in Iranian population: A case–control study. Int J Gen Med. 2020;13:249–259. doi: 10.2147/IJGM.S252552
24. Захаренков В.В., Гафаров Н.И., Панев Н.И. и др. Распределение биохимических и молекулярногенетических маркеров генов у работников угледобывающих предприятий Кузбасса, больных хроническим пылевым бронхитом // Acta Biomedica Scientifica. 2012. № 1. С. 93–97.
Об авторах
Д. Р. ШаиховаРоссия
Шаихова Дарья Рамильевна – младший научный сотрудник отдела молекулярной биологии и электронной микроскопии
ул. Попова, д. 30, г. Екатеринбург, 620014
А. М. Амромина
Россия
Амромина Анна Михайловна – младший научный сотрудник отдела молекулярной биологии и электронной микроскопии
ул. Попова, д. 30, г. Екатеринбург, 620014
И. А. Ситников
Россия
Ситников Иван Андреевич – младший научный сотрудник отдела молекулярной биологии и электронной микроскопии
ул. Попова, д. 30, г. Екатеринбург, 620014
М. П. Сутункова
Россия
Сутункова Марина Петровна – доктор медицинских наук, директор
ул. Попова, д. 30, г. Екатеринбург, 620014
В. Б. Гурвич
Россия
Гурвич Владимир Борисович – доктор медицинских наук, научный руководитель
ул. Попова, д. 30, г. Екатеринбург, 620014
С. Г. Астахова
Россия
Астахова Светлана Геннадьевна – заведующая отделом организации клинической деятельности и медицинской статистики
ул. Попова, д. 30, г. Екатеринбург, 620014
Рецензия
Для цитирования:
Шаихова Д.Р., Амромина А.М., Ситников И.А., Сутункова М.П., Гурвич В.Б., Астахова С.Г. Особенности генетического полиморфизма генов GSTM1, GSTT1, GSTP1 у рабочих Нижнетагильского металлургического комбината с заболеваниями сердечно-сосудистой системы. Здоровье населения и среда обитания – ЗНиСО. 2021;1(12):36-40. https://doi.org/2219-5238/2021-29-12-36-40
For citation:
Shaikhova D.R., Amromina A.M., Sitnikov I.A., Sutunkova M.P., Gurvich V.B., Astakhova S.G. Features of GSTM1, GSTT1 and GSTP1 Genetic Polymorphism in Nizhny Tagil Metallurgical Plant Workers with Cardiovascular Diseases. Public Health and Life Environment – PH&LE. 2021;1(12):36-40. (In Russ.) https://doi.org/2219-5238/2021-29-12-36-40









.png)



























