Перейти к:
Анализ специфической респираторной токсичности фармацевтической субстанции артикаина гидрохлорид при хронической ингаляционной экспозиции
https://doi.org/10.35627/2219-5238/2024-32-10-52-60
Аннотация
Введение. В Республике Беларусь не разработаны гигиенические нормативы и методы контроля в воздухе рабочей зоны для группы современных местноанестезирующих лекарственных средств амино-амидного типа, в том числе и для артикаина гидрохлорида.
Цель исследования: изучить специфическое токсическое действие фармацевтической субстанции артикаина гидрохлорида на бронхолегочную систему, установить лимитирующие показатели и пороговую концентрацию при хронической ингаляционной экспозиции для последующего обоснования безопасного содержания субстанции в воздушной среде фармацевтического производства.
Материалы и методы. Экспериментальные исследования выполнены на аутбредных белых крысах (общее количество – 36 штук), которые подвергались ингаляционной экспозиции (путем интраназального введения) различными концентрациями (2, 10 и 50 мг/м3) изучаемой фармацевтической субстанции на протяжении 4 месяцев. По окончании эксперимента у животных был выполнен бронхоальвеолярный лаваж, в котором определяли содержание цитокинов, на цитологических препаратах лаважа изучали характер его клеточного состава. У эвтанизированных животных выделяли трахею, бронхи и легкие для патоморфологических исследований. Статистическая обработка данных выполнена параметрическим и непараметрическим методами с помощью компьютерной программы Statistica 13. Различия в сравниваемых группах считались значимыми при уровне p < 0,05.
Результаты. Специфическое токсическое действие фармсубстанции на бронхолегочную систему при различных уровнях (2-10-50 мг/м3) ингаляционной экспозиции артикаина гидрохлорида проявилось максимальным развитием патоморфологических структурных изменений на самой высокой концентрации 50 мг/м3, таких как достоверное увеличение толщины межальвеолярных перегородок легких в 1,85 раза, появление у более чем половины крыс выраженной периваскулярной и перибронхиальной инфильтрации в легких. Изменения в составе бронхоальвеолярного лаважа характеризовались достоверным нарастанием клеточного воспалительного компонента и трансформацией цитокинового профиля. При экспозиции 50 мг/м3 отмечено увеличение содержания лимфоцитов и нейтрофилов в 6,09 и 3,4 раза соответственно, появление плазмоцитов и увеличение концентрации ИЛ-1 и ИЛ-6 в 2,0 и 3,2 раза.
Выводы. Дозозависимые морфологические, цитологические и функциональные изменения органов бронхолегочной системы и лаважа характеризуют концентрацию экспозиции 2 мг/м3 как практически недействующую, 10 мг/м3 – пороговую, а 50 мг/м3 – действующую по изученным токсическим эффектам.
Ключевые слова
Для цитирования:
Евтерева А.А., Василькевич В.М., Сычик С.И., Рябцева С.Н. Анализ специфической респираторной токсичности фармацевтической субстанции артикаина гидрохлорид при хронической ингаляционной экспозиции. Здоровье населения и среда обитания – ЗНиСО. 2024;32(10):52-60. https://doi.org/10.35627/2219-5238/2024-32-10-52-60
For citation:
Evtereva A.A., Vasilkevich V.M., Sychik S.I., Ryabtseva S.N. Specific Respiratory Toxicity of the Pharmaceutical Substance Articaine Hydrochloride Following Chronic Inhalation Exposure. Public Health and Life Environment – PH&LE. 2024;32(10):52-60. (In Russ.) https://doi.org/10.35627/2219-5238/2024-32-10-52-60
Введение. Спецификой химико-фармацевтического производства является применение химических веществ с высокой биологической активностью, как, например, фармацевтические субстанции. При этом на фармацевтических предприятиях ряд технологических процессов несовершенны (не полностью автоматизированы и др.), для многих из химических веществ, присутствующих в воздухе рабочей зоны в виде аэрозолей не разработаны гигиенические нормативы и не проводится аналитический контроль их содержания в воздухе рабочей зоны. Следовательно, постоянный контакт работников производства лекарственных препаратов с различными химическими веществами, а также дополнительное влияние тяжести и напряженности трудового процесса, шума, вибрации и/или других вредных профессиональных факторов нередко способствуют возникновению среди работников различных форм патологии [1–12]. По данным ряда авторов, в структуре заболеваемости работников химико-фармацевтической промышленности одно из первых мест занимают болезни органов дыхания неспецифического генеза и аллергической этиологии, в том числе хронический бронхит, обусловленный длительной работой в условиях относительно невысоких концентраций аэрозолей вредных веществ [3][5][7][8][11][12].
Полное исключение из производственной среды вредных химических веществ практически невозможно, поэтому количественное ограничение воздействия химических веществ на безопасном и технически достижимым уровне на сегодняшний день является наиболее эффективным способом сохранения здоровья работающих [8][13–15]. Также дополнительное значение для объективной оценки и разработки эффективных мер управлением риска профессионального воздействия химического фактора приобретает изучение токсического действия веществ, используемых или получаемых в процессе синтеза лекарственных препаратов, при ингаляционном пути поступления в организм, который, как правило, не учитывается для большинства лекарственных средств на этапе доклинических испытаний.
В Республике Беларусь не разработаны гигиенические нормативы и методы контроля в воздухе рабочей зоны для группы современных местноанестезирующих лекарственных средств амино-амидного типа, в том числе и для артикаина гидрохлорида. С этой целью в течение 2021–2025 гг. на базе Научно-исследовательского института гигиены, токсикологии, эпидемиологии и вирусологии ГУ РЦГЭОЗ реализуется НИР «Разработать и обосновать предельно допустимую концентрацию (ПДК) и методики измерений фармацевтической субстанции артикаина гидрохлорида в воздухе рабочей зоны и атмосферном воздухе».
Следует упомянуть, что согласно данным Европейского химического агентства (ECHA) при классификации артикаина гидрохлорид по критериям Регламента (ЕС) № 1272/20081 (европейский аналог Согласованной на глобальном уровне системы классификации опасности и маркировки химической продукции) была отмечена возможность фармсубстанции вызывать поражение респираторной системы при многократном длительном воздействии, а легкие являлись критическим органом-мишенью (197 компаний подали 9 общих уведомлений в реестр ЕСНА, в которых в 44,7 % случаев данные, указывающие на органоспецифическую токсичность в отношении бронхолегочной системы, были признаны релевантными) [16].
Ранее авторами в эксперименте на животных была изучена острая токсичность и оценена степень опасности артикаина гидрохлорида при ингаляционном пути поступления. По данному параметру фармацевтическая субстанция была отнесена к веществам 2-го класса опасности (вещества высокоопасные) по ГОСТ 12.1.0072. При этом на этапе первичной токсикологической оценки артикаина гидрохлорида среди всех изученных токсикометрических показателей именно острая ингаляционная токсичность являлась лимитирующим критерием вредности [17]. Закономерно, что и в случае токсикологического исследования в условиях длительного (хронического) эксперимента на более низких уровнях кроме общетоксических особое внимание требовало изучение респираторных токсических эффектов субстанции артикаина гидрохлорида.
Учитывая вышеизложенное, целью данной работы являлось изучить специфическое токсическое действие фармацевтической субстанции артикаина гидрохлорида на бронхолегочную систему, установить лимитирующие показатели и пороговую концентрацию при хронической ингаляционной экспозиции для последующего обоснования безопасного содержания субстанции в воздушной среде фармацевтического производства.
Материалы и методы. Для реализации намеченной цели животные (аутбредные белые крысы по 9 особей в каждой группе) подвергались ингаляционной (путем интраназального введения) экспозиции на протяжении 4 мес. (по 5 раз в неделю) в различных дозах, соответствующих концентраций артикаина гидрохлорида в 2 (опытная гр. № 1), 10 (опытная гр. № 2) и 50 мг/м³ (опытная гр. № 3). При пересчете доз в концентрации для интраназального введения руководствовались рекомендациями из МУ № 5789/1-913. Выбор доз основывался на собственных данных первичной токсикологической оценки [17] и на предварительных расчетах, выполненных по логарифмическим формулам из Инструкции 1.1.11-12-206-20034.
Интактные животные (гр. контроля) содержались в аналогичных условиях, им интраназально вводили растворитель – дистиллированную воду. Для исследования гистопатологических изменений были рандомно сформированы группы из половозрелых особей обоего пола в количестве 9 штук в каждой группе, для изучения бронхоальвеолярного лаважа количество животных в группах – по 6 особей.
По окончанию эксперимента у животных интактной (контрольной) и опытных групп был выполнен бронхоальвеолярный лаваж. Бронхоальвеолярную жидкость (БАЛЖ) получали закрытым способом на предварительно наркотизированных животных [18]. Наркотизация осуществлялась путем внутрибрюшинного введения тиопентала натрия (ОАО «Синтез», Российская Федерация) в дозе 100 мг/кг. Бронхи и легкие животных промывали двукратно физиологическим раствором в объеме 2 мл с последующей его аспирацией с помощью катетера диаметром 24G и шприца, далее полученную жидкость центрифугировали (Allegra 64R Centrifuge, Beckman coulter, США) для разделения проб лаважа (400 g, в течении 10 мин при температуре +4 °С). Осадок использовали для приготовления цитологических мазков с окраской по Романовскому – Гимзе, надосадочную жидкость – для определения содержания цитокинов. Изготовление микрофотографий было выполнено с помощью гистологического сканера AperioАТ2 фирмы «Leica». При цитологическом исследовании оценивали клеточную плотность воспалительного инфильтрата в десяти не перекрываемых полях зрения (ПЗ) при увеличении ×40,0. Концентрацию цитокинов в БАЛЖ (интерлейкины 1 и 6, фактор некроза опухолей, интерферон гамма – ИЛ-1, ИЛ-6, ФНО, IFN-γ) определяли иммуноферментным методом с использованием наборов реагентов производства АО «Вектор-Бест», Российская Федерация.
После забора лаважа из бронхов и легких животные подвергались эвтаназии методом мгновенной декапитации. Для изучения токсического влияния артикаина гидрохлорида на бронхолегочную систему выделяли трахею, бронхи и легкие, которые фрагментарно фиксировали для гистологического исследования в 10%-м растворе нейтрального формалина. Для полуавтоматической проводки и заливки использовали вакуумный гистопроцессор серии KD-TS6B и станцию заливки срезов в парафиновые блоки KD-BMIII BLIII (KEDEE, Китай). Гистологические срезы толщиной 3-4 мкм получали на ротационном микротоме CUT56 (Slee Medical, Германия), окрашивали гематоксилином и эозином по стандартной методике.
Микрофотографии были изготовлены на гистосканере AperioАТ2 фирмы «Leica». Основными критериями токсического действия артикаина гидрохлорида при микроскопическом исследовании гистологических препаратов трахеи, бронхов и легких являлись наличие либо отсутствие альтерации, воспаления, компенсаторно-приспособительных изменений (атрофии, фиброза, склероза, гипо-, гипертрофии, пролиферации). Анализ толщины межальвеолярных перегородок выполнен с помощью программы анализа изображений Aperio ImageScope v9.0.1.1506 (https://aperio-imagescope.software.informer.com/9.0) и ее приложения «Pen Tool». Ширина межальвеолярных перегородок оценивалась в пяти не перекрываемых полях зрения при увеличении ×20,0. Площадь поля составила 2055687,00 мкм².
Статистическая обработка экспериментальных данных выполнена параметрическим и непараметрическим методами с помощью компьютерной программы STATISTICA 13 (лиц. № AXA811I525627ARCN2ACD-M). Различия в сравниваемых группах считались статистически значимыми при p < 0,05.
Результаты
Характеристика содержимого бронхоальвеолярного лаважа (цитологические параметры и цитокиновый профиль)
В бронхоальвеолярном лаваже от первой опытной группы к третьей наблюдается нарастание клеточной плотности воспалительного компонента с присоединением нейтрофилов и плазмоцитов. Так, общее содержание нейтрофилов в БАЛЖ животных гр. № 2-3 при сравнении с контролем увеличилось в 6,28 и 7,29 раза, лимфоцитов – в 5,15 и 6,85 раза, в то же время, прирост макрофагов в БАЛЖ крыс данных групп был менее выражен – в 2,90 и 3,73 раза, соответственно. При этом, полученные данные о содержании клеток воспалительного инфильтрата в поле зрения как в опытной гр. № 2, так и в опытной гр. № 3 также характеризуются значимыми различиями (р < 0,01 для обоих групп) по количеству лимфоцитов, сегментоядерных нейтрофилов, плазмоцитов и макрофагов в сравнении с контрольными животными (см. табл. 1, рис. 1).
Таблица 1. Морфологические параметры бронхоальвеолярного лаважа групп исследования
Table 1. Morphological parameters of bronchoalveolar lavage in the study groups
|
Наименование показателя / Parameter |
Контрольная группа / |
Группа № 1 / |
Группа № 2 / |
Группа № 3 / |
|
Общая клеточность (кол-во клеток в 10 ПЗ) / |
78 ± 1,14 |
110 ± 1,60 |
402 ± 3,67* |
534 ± 8,90* |
|
Количество лимфоцитов в лаваже (в числителе – клеток в 10 ПЗ, в знаменателе – в %) / |
34,00 ± 0,56 |
45,00 ± 0,95 |
206,00 ± 2,37* |
274,00 ± 4,57* |
|
Количество нейтрофилов в лаваже (в числителе – клеток в 10 ПЗ, в знаменателе – в %) / |
7,00 ± 0,32 |
15,00 ± 0,54 |
44,00 ± 1,29* |
51,00 ± 0,85* |
|
Количество плазмоцитов в лаваже (в числителе – клеток в 10 ПЗ, в знаменателе – в %) / |
0,00 ± 0,00 |
0,00 ± 0,00 |
45,00 ± 0,73* |
71,00 ± 1,18* |
|
Количество макрофагов в лаваже (в числителе – клеток в 10 ПЗ, в знаменателе – в %) / |
37,00 ± 0,80 |
50,00 ± 1,18 |
107,00 ± 1,39* |
138,00 ± 2,30* |
Примечание: * различия от контроля по t-критерию при р < 0,01.
Note: * p < 0.01, compared with the controls, based on t-test.
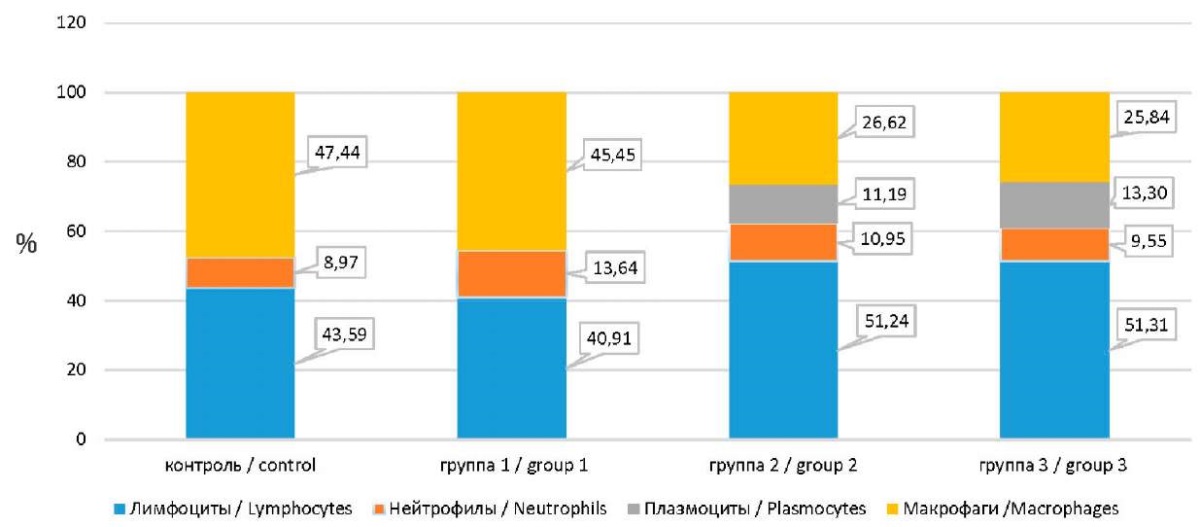
Рис. 1. Особенности клеточного состава БАЛЖ у экспонированных животных
Fig. 1. Group-specific cellular composition of the bronchoalveolar lavage fluid in the exposed animals
Монотонная хроническая инспираторная экспозиция субстанцией артикаина гидрохлорида вызывает увеличение не только абсолютного, но и относительного содержания основных компонентов БАЛЖ и изменение клеточного состава, которые становится критическим, позволяющим расценивать их как лимитирующий эффект, при концентрации в 10 мг/м³, а наиболее выражено при максимальном уровне экспозиции в данных условиях эксперимента (50 мг/м³).
Хроническая ингаляционная воздействие фармацевтической субстанции артикаина гидрохлорида отразилась на изменении у экспонированных лабораторных животных цитокинового профиля бронхоальвеолярного лаважа. Установлено повышение (p < 0,05) концентрации интерлейкина 6 (IL-6) и фактора некроза опухоли альфа (TNF-α) в опытных группах № 2, 3 по сравнению с контрольной группой (см. табл. 2). В группе № 3 выросло содержание IL-1β.
Таблица 2. Концентрация цитокинов в бронхоальвеолярной жидкости подопытных животных
Table 2. Cytokine concentrations in the bronchoalveolar lavage fluid of the experimental animals
|
Изучаемые показатели, единицы измерения / |
Контрольная группа / |
Группа № 1 / |
Группа № 2 / |
Группа № 3 / |
|
Интерлейкин-6 (IL-6), пг/мл / |
1,65 |
1,55 |
4,20 |
4,95 |
|
Фактор некроза опухоли альфа (TNFα), пг/мл / |
0,75 |
1,00 |
14,00 |
20,30 |
|
Интерлейкин-1 бета (IL-1β), пг/мл / |
8,45 |
13,20 |
15,65 |
26,35 |
|
Интерферон гамма (IFNγ), пг/мл / |
17,55 |
24,85 |
25,18 |
17,10 |
Примечание: * различия от контроля по U-критерию при р < 0,05.
Note: * differences from control according to U-test at p < 0.05.
Микроскопические изменения бронхолегочной системы (трахея, бронхи и легкие)
В гистологических срезах у животных контрольной группы в слизистой оболочке и стенке бронхов и трахеи признаков фиброза, некроза и воспалительной инфильтрации не выявлено, отмечен слабо выраженный подслизистый отек (как результат проведенного бронхоальвеолярного лаважа). В легких эпителий мелких бронхов и бронхиол сохранен, местами выявлена десквамация клеток, стенки альвеол малоклеточные, тонкие, представлены капиллярами, альвеолярными макрофагами и альвеолоцитами (см. рис. 3А). Толщина межальвеолярных перегородок варьировала от 12,47 мкм до 28,13 мкм, медиана толщины межальвеолярных перегородок составила 19,45 (15,97;22,33) мкм. Воспалительной инфильтрации в легочной паренхиме не выявлено.
У животных опытной гр. № 1 (2 мг/м³) в слизистой оболочке трахеи отмечено снижение количества реснитчатых клеток, также отсутствовала воспалительная инфильтрация как в стенке трахеи, бронхов, так и в легочной паренхиме, дополнительно отмечены признаки распространенной панацинарной эмфизематозной трансформации, что может быть следствием выполненного бронхоальвеолярного лаважа (см. рис. 2А). Толщина межальвеолярных перегородок варьировала от 13,54 до 26,92 мкм, медиана толщины межальвеолярных перегородок составила 20,25 (16,91;22,62) мкм. В просвете альвеол – эритроциты (посмертные изменения), единичные макрофаги (см. рис. 3Б).
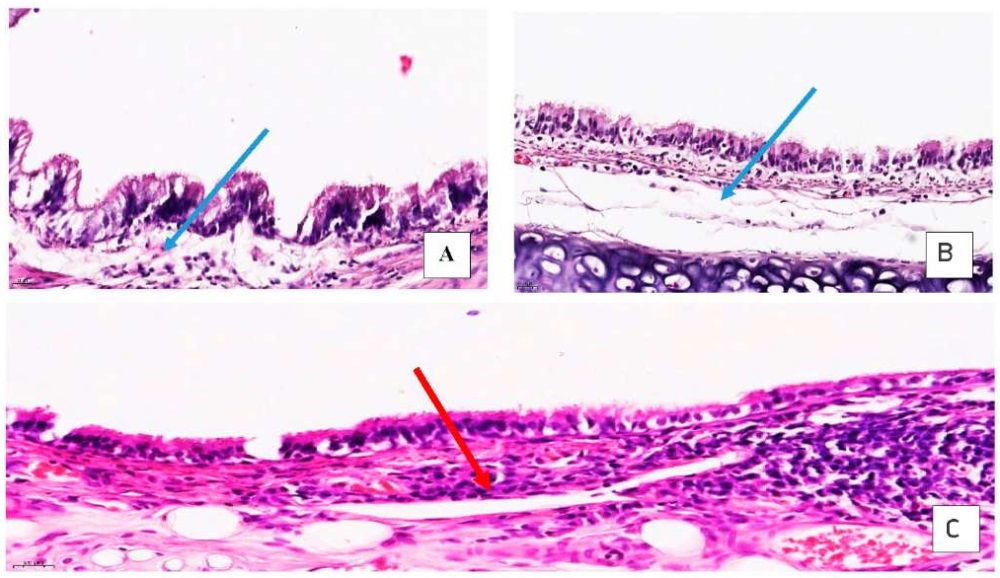
Рис. 2. Гистологическая характеристика трахеи подопытных животных групп исследования
Fig. 2. Exposure group-specific histological images of the trachea of the experimental animals
А – незначительный подслизистый отек трахеи (стрелка) у подопытных животных гр. № 1 (2 мг/м³) /
slight submucosal edema of the trachea (arrow) in experimental animals gr. No. 1 (2 mg/m³)
В – умеренно выраженный подслизистый отек трахеи (стрелка) у крыс гр. № 2 (10 мг/м³) /
moderately pronounced submucosal edema of the trachea (arrow) in rats gr. No. 2 (10 mg/m³)
С – воспалительная инфильтрация в подслизистом слое слизистой оболочки трахеи (стрелка) у крыс гр. № 3 (50 мг/м³); окраска гематоксилином и эозином, увеличение ×40,0 /
inflammatory infiltration in the submucosal layer of the tracheal mucosa (arrow) in rats gr. No. 3 (50 mg/m³); hematoxylin and eosin staining, magnification ×40.0
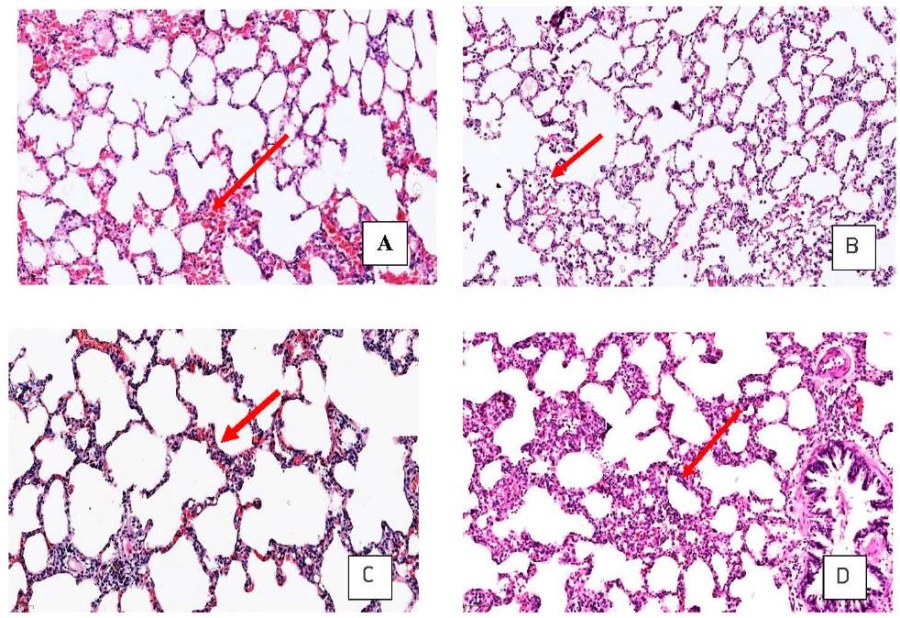
Рис. 3. Гистологическая характеристика легочной паренхимы крыс групп исследования
Fig. 3. Exposure group-specific histological images of the trachea of the experimental animals
А – внутриальвеолярные кровоизлияния (стрелка) в легочной паренхиме крыс контрольной группы /
intraalveolar hemorrhages (arrow) in the pulmonary parenchyma of rats of the control group
B – скопления альвеолярных макрофагов (стрелка) в просвете альвеол легких подопытных животных гр. № 1 (2 мг/м³) /
accumulations of alveolar macrophages (arrow) in the lumen of the alveoli of the lungs of experimental animals gr. No. 1 (2 mg/m³)
C – слабовыраженное утолщение межальвеолярных перегородок (стрелка) легких крыс гр. № 2 (10 мг/м³) /
weakly expressed thickening of the interalveolar septa (arrow) of the lungs of rats gr. No. 2 (10 mg/m³)
D – умеренно выраженное утолщение межальвеолярных перегородок легких (стрелка) крыс гр. № 3 (50 мг/м³); окраска гематоксилином и эозином, увеличение ×20,0 /
moderately pronounced thickening of the interalveolar septa of the lungs (arrow) of rats gr. No. 3 (50 mg/m³); hematoxylin and eosin staining, magnification ×20.0
В слизистой оболочке и стенке бронхов и трахеи в гистологических срезах животных гр. № 2 (10 мг/м³) отмечено нарастание количества бокаловидных клеток и снижение слоя ресничек реснитчатых клеток, выявлена гиперплазия базальных клеток эпителия, наблюдались умеренно выраженный подслизистый отек и слабовыраженная лимфоцитарная инфильтрация с примесью единичных плазмоцитов (см. рис. 2Б). В одном случае (11,1 %) в воспалительном инфильтрате присутствовали нейтрофилы. При микроскопическом изучении гистологических препаратов ткани легких животных гр. № 2 выявлено утолщение межальвелярных перегородок. Толщина межальвеолярных перегородок варьировала от 13,54 до 36,92 мкм, медиана толщины межальвеолярных перегородок составила 23,35 (18,96;26,92) мкм. В отдельных случаях отмечена слабовыраженная перибронхиальная лимфоцитарная инфильтрация (2/22,2 %) и слабовыраженная периваскулярная (3/33,3 %) лимфоцитарная инфильтрация в легочной паренхиме крыс. Выявлены признаки панацинарной эмфизематозной трансформации (рис. 3В).
В слизистой оболочке и стенке бронхов и трахеи у животных опытной гр. № 3 (50 мг/м³) отмечены снижение количества бокаловидных клеток и снижение толщины слоя ресничек реснитчатых клеток респираторного эпителия, умеренно выраженная лимфоцитарная инфильтрация подслизистого слоя с примесью плазмоцитов (6/66,7 %), в трех случаях (33,3 %) в воспалительном инфильтрате присутствовали нейтрофилы (см. рис. 2В). В легочной паренхиме – стенки альвеол резко и неравномерно утолщены за счет пролиферации альвеолярных макрофагов и скоплений лимфоцитов и плазмоцитов (см. рис. 3Г). Толщина межальвеолярных перегородок варьировала от 17,18 мкм до 94,95 мкм, медиана толщины межальвеолярных перегородок составила 37,14 (28,62;45,19) мкм. Во всех случаях (9/100 %) наблюдалась умеренно (5/55,6 %) и выраженная (4/44,4 %) перибронхиальная лимфоцитарная инфильтрация, периваскулярно также отмечена умеренно выраженная (6/66,7 %) и выраженная (3/33,3 %) воспалительная инфильтрация. Отмечены признаки панацинарной эмфизематозной трансформации в верхних долях легких.
При статистической обработке полученных данных установлены значимые (р < 0,01) различия с контрольными значениями по следующим морфологических параметрам: толщина межальвеолярных перегородок легких крыс опытных гр. № 2 и 3, выраженность периваскулярной и перибронхиальной инфильтрации в легких крыс опытной гр. № 3.
Обсуждение. Современные цито- и иммунологические методы изучения БАЛЖ обладают несомненной диагностической ценностью, позволяют выявить определенные изменения жизнеспособности клеток, их функциональной активности и соотношений между отдельными клеточными элементами лаважа для установления наличия, возможной этиологии и степени активности патологического процесса в бронхолегочной системе.
Наблюдаемое увеличение клеточности БАЛЖ, привлечение в дыхательные пути и ткани легких фагоцитирующих клеток с дополнительной мобилизацией нейтрофилов связано с развитием воспалительных изменений в бронхолегочной системе, а появление плазматических клеток и значительное количество в общей структуре лимфоцитов свидетельствует о хронизации ответной воспалительной реакции. Доказанным фактом является взаимная связь между морфологическими и иммунологическими изменениями в верхних дыхательных путях, развивающихся при воздействии промышленных аэрозолей [19][20]. Так, Панкова В.Б. и соавт. отмечают, что ингаляционное поступление промышленных аэрозолей в организм создает возможности для воздействия сенсибилизирующего химического вещества на весь респираторный тракт, а сам процесс сенсибилизации носит длительный, хронический характер и сопровождается аутоиммунной реакцией [19].
Обобщенная оценка выявленных изменений БАЛЖ (цитологические особенности и содержание цитокинов) свидетельствует, что пороговым значением для органоспецифического действия артикаина гидрохлорида на бронхолегочную систему лабораторных животных в условиях хронической ингаляционной экспозиции является концентрация субстанции 10 мг/м³, а лимитирующими показателями – абсолютное и относительное содержание клеточных элементов (лимфоциты, нейтрофилы, плазмоциты и макрофаги) и цитокинов (ИЛ-6 и ФНО-α) в БАЛЖ.
Исходя из полученных данных о микроскопической структуре органов бронхолегочной системы подопытных животных после хронической ингаляционной экспозиции фармакологической субстанции артикаина гидрохлорида в различных концентрациях установлено, что ингаляционная экспозиция на протяжении 4 месяцев анализируемой фармакологической субстанции в концентрации 2 мкг/м³ у подопытных животных не приводила к патологическим изменениям в дыхательных путях и легочной паренхиме, при концентрации 10 мкг/м³ сопровождалась минимальными проявлениями раздражающего действия субстанции на слизистую оболочку бронхиального дерева и легочной паренхимы. Ингаляционная экспозиция фармакологической субстанции артикаина гидрохлорида на уровне 50 мкг/м³ характеризовалась значительными структурными изменениями изученных органов и развитием выраженного интерстициального пневмонита.
Выводы
- Данные о клеточном составе БАЛЖ коррелировали с гистологическими изменениями трахеи, бронхов и легочной паренхимы крыс. Так, увеличение клеточности (лимфоцитов, нейтрофилов и макрофагов), появление в мазках БАЛЖ плазмоцитов, рост концентрации провоспалительных цитокинов (ИЛ-6 и ФНО) и структурные патоморфологические изменения органов были статистически значимыми при экспозиции животных субстанцией на уровне 10 и 50 мг/м³и носили дозозависимый характер, приобретая большую степень выраженности с увеличением уровня экспозиции.
- Порогом вредного хронического органоспецифического действия артикаина гидрохлорид на бронхолегочную систему лабораторных животных является уровень экспозиции 10 мг/м³, что необходимо учитывать при обосновании гигиенического норматива безопасного содержания фармсубстанции в воздухе рабочей зоны.
1. Регламент (ЕС) № 1272/2008 Европейского парламента и Совета Евросоюза от 16.12.2008 «Классификация, маркировка и упаковка». Доступно по: https://reach.ru/CLPexample.pdf (русскоязычный вариант) (дата обращения: 15.09.2024).
2. Вредные вещества. Классификация и общие требования безопасности: ГОСТ 12.1.007-76. Введ. 01.01.1977. М.: Стандартинформ, 2007. 5 с.
3. Методические указания по экспериментальному обоснованию ПДК микроорганизмов-продуцентов и содержащих их готовых форм препаратов в объектах производственной и окружающей среды : метод. указания № 5789/1-91. М., 1993. 19 с.
4. Инструкция 1.1.11-12-206-2003. Гигиеническое нормирование лекарственных средств в воздухе рабочей зоны, атмосферном воздухе населенных мест и воде водных объектов : утв. Гл. гос. санитар. врачом Респ. Беларусь 30.12.2003 : введ. 01.07.2004 // Сборник санитарных правил и норм по коммунальной гигиене : [в 2 ч.] / М-во здравоохранения Респ. Беларусь. Минск, 2004. Ч. 2. С. 13–63.
Список литературы
1. Binks SP. Occupational toxicology and the control of exposure to pharmaceutical agents at work. Occup Med (Lond). 2003;53(6):363–370. doi: 10.1093/occmed/kqg116
2. Горохова Л.Г., Уланова Е.В., Шавцова Г.М., Ердеева С.В., Блажина О.Н. Состояние здоровья работающих в химико-фармацевтической отрасли // Медицина труда и пром. экология. 2018. № 6. С. 38–42. doi: 10.31089/1026-9428-2018-6-38-42
3. Арабей С.В., Гиндюк А.В. Условия труда и профессиональный риск здоровью работников цеха по производству противоопухолевых лекарственных средств // Журнал Гродненского государственного медицинского университета. 2022. Т. 20. № 5. С. 526–530. doi: 10.25298/2221-8785-2022-20-5-526-530
4. Milovanović A, Jakovljević B, Milovanović J, et al. Morbidity patterns of workers employed in pharmaceutical-chemical industry. Srp Arh Celok Lek. 2007;135(3- 4):184–190. (In Serbian.) doi: 10.2298/sarh0704184m
5. Yu WL, Zhou JJ, Zou JF, et al. Investigation of occupational health status of female workers in pharmaceutical industry of Shandong and Gansu provinces. Zhonghua Lao Dong Wei Sheng Zhi Ye Bing Za Zhi. 2011;29(9):650-652. (In Chinese.) doi: 10.3760/cma.j.issn.1001-9391.2011.09.004
6. Гейдан Д.М., Тимофеева С.С. Профессиональные заболевания работников при производстве фармацевтических препаратов // Безопасность-2023. Проблемы техносферной безопасности современного мира. Сборник материалов XXVIII Всероссийской студенческой научно-практической конференции с международным участием. Иркутск: Иркутский национальный исследовательский технический университет, 2023. С. 264–267.
7. Лелюх П. Ю. Причины возникновения профессиональных заболеваний у работников фармацевтического производства и методы их профилактики // Мавлютовские чтения. Сборник материалов XVI Всероссийской молодежной научной конференции: в 6 томах. Т. 4. Уфа: Уфимский государственный авиационный технический университет, 2022. С. 189–191.
8. Василькевич В.М. Богданов Р.В., Дроздова Е.В. Актуальные вопросы гигиенического регламентирования и создания безопасных условий труда на предприятиях по производству фармацевтических препаратов // Медицина труда и пром. экология. 2020. № 10. С. 640–644.
9. Джангозина Д.М. Темиреева К.С., Аманжол И.А. и др. Факторы производственной деятельности, влияющие на условия труда фармацевтических работников // Международный журнал экспериментального образования. 2009. № 3. С. 31–33.
10. Бахонина Е.И., Матузов Г.Л., Фазылова Л.И., Хайбуллина Р.Р. Особенности труда и проявления профессиональных заболеваний работников фармацевтических производств // Электронный научный журнал «Нефтегазовое дело». 2024. № 3. С. 92-105. doi: 10.17122/ogbus-2024-3-92-105
11. Gathuru IM, Buchanich JM, Marsh GM, Dolan DG. Health hazards in the pharmaceutical industry. Pharmaceut Reg Affairs. 2015;4(3):145. doi: 10.4172/2167-7689.1000145
12. Goossens A, Hulst KV. Occupational contact dermatitis in the pharmaceutical industry. Clin Dermatol. 2011;29(6):662- 668. doi: 10.1016/j.clindermatol.2011.08.011
13. Семёнова В.Н., Степанов А.Э., Крашенина Г.И. и др. Гигиеническое нормирование – современное состояние и проблемы. В электронном научном журнале: Universum: медицина и фармакологии; 2023. №7(100). Доступно по: https://7universum.com/ru/med/archive/item/15673. Ссылка активна на 28.08.2024.
14. Хамидулина Х.Х., Тарасова Е.В. Современные подходы к гармонизации гигиенического нормирования химических веществ с международными // В сб.: Республиканская научно-практическая конференция с международным участием, посвященная 90-летию НИИИ санитарии, гигиены и профессиональных заболеваний «Инновационные подходы в решении санитарногигиенических и медико-биологических проблем здоровья населения». Ташкент, 2024. С. 207–208.
15. Dorne JL, Ragas AM, Frampton GK, Spurgeon DS, Lewis DF. Trends in human risk assessment of pharmaceuticals.Anal Bioanal Chem. 2007;387(4):1167-1172. doi: 10.1007/s00216-006-0961-9
16. PubChem. Articaine hydrochloride. Accessed September 9, 2023. https://pubchem.ncbi.nlm.nih.gov/compound/Articaine-hydrochloride#datasheet=LCSS
17. Василькевич В.М., Евтерева А.А., Чернышова Е.В. О результатах первичной токсикологической оценки фармацевтической субстанции артикаина гидрохлорид // Вестник Витебского государственного медицинского университета. 2024. Т. 23. № 2. С. 59–68. doi:10.22263/2312-4156.2024.2.59
18. Матичин А.А., Кательникова А.Е., Крышень К.Л. Особенности отбора бронхоальвеолярного лаважа у лабораторных животных. Лабораторные животные для научных исследований. 2019. № 4. С. 37–43. doi: 10.29296/2618723X-2019-04-06
19. Панкова В.Б., Федина Я.А., Накатис И.Н., Лавренова Г.В. Заболевания верхних дыхательных путей, вызванные воздействием промышленных аэрозолей // Российская ринология. 2016. Т. 24. № 4. С. 30–36. doi: 10.17116/rosrino201624430-36
20. Лаврентьева Н.Е. Профессиональные заболевания органов дыхания у фармацевтических работников // Врач-аспирант. 2012. Т. 55. № 6. С. 363–368.
Об авторах
А. А. ЕвтереваБеларусь
Евтерева Антонина Александровна – научный сотрудник лаборатории промышленной токсикологии
ул. Академическая, д. 8, г. Минск, 220012
В. М. Василькевич
Беларусь
Василькевич Вадим Михайлович – ведущий научный сотрудник лаборатории промышленной токсикологии, канд. мед. наук
ул. Академическая, д. 8, г. Минск, 220012
С. И. Сычик
Беларусь
Сычик Сергей Иванович – директор, канд. мед. наук, доцент
ул. Академическая, д. 8, г. Минск, 220012
С. Н. Рябцева
Беларусь
Рябцева Светлана Николаевна – заведующий лабораторией Центра морфологических исследований, канд. мед. наук, доцент
ул. Академическая, д. 28, г. Минск, 220072
Рецензия
Для цитирования:
Евтерева А.А., Василькевич В.М., Сычик С.И., Рябцева С.Н. Анализ специфической респираторной токсичности фармацевтической субстанции артикаина гидрохлорид при хронической ингаляционной экспозиции. Здоровье населения и среда обитания – ЗНиСО. 2024;32(10):52-60. https://doi.org/10.35627/2219-5238/2024-32-10-52-60
For citation:
Evtereva A.A., Vasilkevich V.M., Sychik S.I., Ryabtseva S.N. Specific Respiratory Toxicity of the Pharmaceutical Substance Articaine Hydrochloride Following Chronic Inhalation Exposure. Public Health and Life Environment – PH&LE. 2024;32(10):52-60. (In Russ.) https://doi.org/10.35627/2219-5238/2024-32-10-52-60









.png)



























