Перейти к:
Маркеры местного и системного воспаления при диарейном синдроме при новой коронавирусной инфекции COVID-19
https://doi.org/10.35627/2219-5238/2023-31-10-62-70
Аннотация
Введение. Известно, что фекальный кальпротектин является биомаркером воспалительного повреждения кишечника. Повышение его уровня отмечается также при инфекции COVID-19, что связано с патогенным действием вируса на эпителий кишечника с привлечением компонентов неспецифического звена иммунитета.
Цель исследования: оценить маркеры местного и системного воспаления и их взаимосвязь при диарейном синдроме при новой коронавирусной инфекции COVID-19.
Материалы и методы. Проанализированы данные 90 историй болезни пациентов в возрасте от 35 до 70 лет с лабораторно верифицированной SARS-CoV-2-инфекцией. Пациенты (n = 90) были разделены на три группы в зависимости от уровня фекального кальпротектина: первая группа соответствовала уровню фекального кальпротектина более 200 мкг/г (n = 30), вторая – от 50 до 200 мкг/г (n = 30) и третья – до 50 мкг/г (n = 30).
Результаты. У пациентов с уровнем кальпротектина более 200 мкг/г в 1,5 раза чаще встречалось тяжелое течение заболевания, объем поражения легких составил более 50 % (p < 0,05), продолжительность лихорадки и диареи сохранялась до 14,8 ± 0,5 (p < 0,05) и 8,7 ± 0,4 дня (p < 0,05) соответственно.
Заключение. Установлена прямая взаимосвязь маркеров местного и системного воспаления. Клинические проявления новой коронавирусной инфекции COVID-19 коррелируют с выраженностью интестинального воспаления в кишечнике. Выявлена положительная корреляционная связь между уровнями фекального кальпротектина и длительностью диарейного синдрома. Пейзаж условно-патогенной микробиоты кишечника коррелирует с выраженностью воспалительного процесса в кишечнике.
Для цитирования:
Сабитов А.У., Москалёва Ю.Н., Хаманова Ю.Б., Шарова А.А., Чащина А.В., Шмальц Л.А. Маркеры местного и системного воспаления при диарейном синдроме при новой коронавирусной инфекции COVID-19. Здоровье населения и среда обитания – ЗНиСО. 2023;31(10):62-70. https://doi.org/10.35627/2219-5238/2023-31-10-62-70
For citation:
Sabitov A.U., Moskaleva Yu.N., Khamanova Y.B., Sharova A.A., Chashchina A.V., Schmalts L.A. Markers of Local and Systemic Inflammation in the Diarrhea Syndrome Associated with the Coronavirus Disease (COVID-19). Public Health and Life Environment – PH&LE. 2023;31(10):62-70. (In Russ.) https://doi.org/10.35627/2219-5238/2023-31-10-62-70
Введение. Глобальная пандемия коронавируса-19 (COVID-19), вызванная вирусом SARS CoV-2, привела к значительной заболеваемости и смертности во всем мире. В тяжелых случаях, в дополнение к респираторным проявлениям COVID-19, возникают полиорганные нарушения, что делает лечение данной инфекции широко обсуждаемым вопросом [1][2]. В частности, желудочно-кишечный тракт (ЖКТ), наравне с респираторным трактом может служить начальными «входными воротами инфекции» [3]. Результаты ряда исследований [4] подтверждают, что кишечник и легкие – это органы, имеющие сложные гомеостатические связи. Нарушение целостности кишечного барьера вследствие изменения кишечной микробиоты может привести к транслокации возбудителя инфекции COVID-19 из просвета кишечника в легкие через кровеносную и лимфатическую системы [4][5].
Считается, что причиной системного воспаления может служить вторичный выброс цитокинов, вызывающий цитокиновый шторм [1]. Врожденный иммунитет является первой линией защиты от вторгающихся микробов и включает неспецифический иммунный ответ с привлечением нейтрофилов и макрофагов и выработкой цитокинов и хемокинов. Таким образом, в клетке существует система переноса клеточных сигналов, которые в зависимости от вирулентности возбудителя и функционального состояния клеток хозяина, могут выполнять либо защитную функцию, либо приводить к неконтролируемому воспалению [6]. Фекальный кальпротектин (КП) представляет собой кальцийсвязывающий и в первую очередь специфичный для нейтрофилов белок, который выделяется во внеклеточную среду в результате каскада распада нейтрофилов во время острого воспаления. Концентрация фекального КП, на долю которого приходится 60 % цитозольного белка в нейтрофилах, пропорциональна концентрации нейтрофилов в слизистой оболочке кишечника при ее ишемии [7][8].
Таким образом, фекальный КП может являться потенциальным биомаркером повреждения кишечника у пациентов с COVID-19, кроме того, в зависимости от выраженности КП можно предположить о степени обсемененности ЖКТ микроорганизмами и тяжести протекания заболевания. По данным литературы, более высокие уровни фекального кальпротектина связаны с нарушением метаболической активности микробиоты кишечника. Показателями метаболической активности при этом могут служить короткоцепочечные жирные кислоты, которых было достоверно меньше в группе с повышенным уровнем фекального КП (р = 0,649). Вероятно, это является следствием активного воспаления в кишечнике, которое подавляет колонизацию кишечника нормальной флорой. По данным литературы, выявлена положительная связь между нормальным содержанием кальпротектина (<50 мг/г) и средними значениями (25–75 %) маркеров активности облигатной флоры и анаэробным индексом (p < 0,041) [9].
Цель исследования: оценить маркеры местного и системного воспаления и их взаимосвязь при диарейном синдроме при новой коронавирусной инфекции COVID-19.
Материалы и методы. Под наблюдением находились три группы пациентов (n = 90) в возрасте от 35 до 70 лет с диагнозом «Новая коронавирусная инфекция COVID-19», госпитализированных в инфекционный стационар ГАУЗ СО «ГКБ № 40», г. Екатеринбург. Набор клинического материала проводился в период с мая 2021 по январь 2022 года.
Клиническое исследование выполнено в соответствии с Хельсинкской декларацией Всемирной медицинской ассоциации «Этические принципы проведения научных медицинских исследований с участием человека» с поправками 2000 г.1, Правилами клинической практики в Российской Федерации2. Все пациенты подписывали добровольное информированное согласие на обработку персональных данных и сведений, составляющих врачебную тайну3. Исследование было одобрено на совместном заседании ученого совета и ЛЭК ФГБОУ ВО «УГМУ» Минздрава России4.
Критериями включения в исследование были: подтвержденная инфекция COVID-19 (выявление РНК SARS-CoV-2 с применением методов амплификации нуклеиновых кислот), присутствие клинической картины желудочно-кишечных симптомов, наличие информированного согласия на обработку персональных данных, участие в исследовании.
Критериями исключения были: возраст старше 70 лет, сопутствующая патология: заболевания органов ЖКТ, опорно-двигательного аппарата, хроническая болезнь почек, беременность, ВИЧ-инфекция, онкогематологические и лимфопролиферативные заболевания, кишечная и клостридиальная инфекции.
Пациенты были разделены на три группы в зависимости от концентрации фекального КП, соответствующего уровню интестинального воспаления кишечника: первая группа (n = 30) имела концентрацию фекального КП более 200 мкг/г, вторая (n = 30) – 50–200 мкг/г, третья (n = 30) – менее 50 мкг/г.
При поступлении пациентов в стационар был проведен комплекс лабораторно-диагностических мероприятий, включающий сбор анамнеза, физикальное обследование, исследование концентрации фекального КП, исследование носоглоточной слизи методом полимеразной цепной реакции, пульсоксиметрия с измерением SpO2 для выявления дыхательной недостаточности и оценки выраженности гипоксемии, электрокардиография в стандартных отведениях, общий анализ крови с определением уровня эритроцитов, гемоглобина, гематокрита, лейкоцитов, тромбоцитов, лейкоцитарной формулы, биохимический анализ крови (мочевина, креатинин, электролиты, глюкоза, аланинаминотрансфераза (АЛТ), аспартатаминотрансфераза (АСТ), билирубин, альбумин, креатинфосфокиназа (КФК), лактатдегидрогеназа (ЛДГ), С-реактивный белок (СРБ)), коагулограмма, анализ на иммунный статус с фенотипированием лимфоцитов (СD3+, СD4+, СD8+, NK-клетки), компьютерная томография органов грудной клетки, согласно временным методическим рекомендациям по профилактике, диагностике и лечению СOVID-19 [10, 11].
Критериями оценки эффективности проводимой терапии являлись результаты клинических наблюдений и оценка показателей специфического и неспецифического иммунитета.
Базисная терапия COVID-19 включала назначение противовирусной, иммуносупрессивной, гормональной, антикоагулянтной терапии.
Статистическая обработка полученных данных проводилась на персональном компьютере при помощи пакета прикладных программ «AtteStat», версия 12.5, описание количественных признаков проводилось с использованием параметрических и непараметрических методов. Для проверки наличия нормального распределения использовался тест Шапиро − Уилка. Сравнение независимых групп по количественным признакам с нормальным распределением значений проводилось с использованием классического или модифицированного критерия Стьюдента. При сравнении независимых групп с ненормальным распределением значений одного или двух количественных признаков использовался непараметрический метод с помощью U-критерия Манна – Уитни. Сравнение групп по качественным признакам проводилось с использованием критерия хи-квадрат Пирсона. Критический уровень значимости p был принят равным 0,05. Результаты представлены в виде среднего арифметического значения M и ошибки среднего значения m; при ненормальном распределении в виде Me [Q25 – Q75], где Me – медиана, Q25 и Q75 – соответственно нижний (25,0 %) и верхний (75,0 %) квартили.
Результаты. В нашем исследовании во всех трех группах преобладали лица женского пола: в первой группе пациентов (КП более 200 мкг/г) количество женщин составило 76,6 %, во второй группе (КП 50 – 200 мкг/г) – 73,3 %, в третьей группе (КП менее 50 мкг/г) – 80,0 %. Пациенты были сопоставимы по возрасту: средний возраст пациентов первой группы составил 55,7 ± 1,5 года, второй группы – 52,1 ± 1,5 года, третьей группы – 53,8 ± 1,9 года (p < 0,05).
Среди наблюдаемых пациентов группы были сопоставимы по коморбидному фону: на первом месте преобладали пациенты с артериальной гипертензией (АГ) – 86 %, на втором – пациенты с ожирением 30 %, на третьем – с сахарным диабетом – 23 % и меньшую группу составили пациенты с ишемической болезнью сердца (ИБС) – от 3 % до 13 %, (p < 0,05).
Для унифицированной оценки сопутствующей патологии был использован индекс коморбидности Charlson [12]. Группы пациентов были сопоставимы по данному показателю, который составил в трех группах в среднем 1 и 2 балла: в первой группе – 70,0 % (против 66,6 % второй группы, 70,0 % третьей группы, p > 0,05). В первой группе пациентов среднетяжелое и тяжелое течение новой коронавирусной инфекции COVID-19 встречалось в 1,5 раза чаще, чем во второй группе, и в 2,2 раза чаще, чем в третьей группе пациентов (табл. 1).
По данным компьютерной томографии (КТ) органов грудной клетки, в первой группе уровень КТ-1 был у 33 % пациентов, КТ-2 – у 20 %, КТ-3 – у 47 %; во второй группе: КТ-1 был – у 43 % исследуемых, КТ-2 – у 46 %, КТ-3 – у 10 %; в третьей группе: КТ-1 имели 60 %, КТ-2 – 37 % пациентов, КТ-3 – 3,3 % (p < 0,05).
Таким образом, наиболее выраженно легочное поражение наблюдалось в первой группе пациентов в сравнении с другими группами (p < 0,05).
Клинические проявления новой коронавирусной инфекции в первой группе имели следующие особенности: длительный лихорадочный период до 14,8 ± 0,5 дня (p < 0,05), продолжительный диарейный синдром до 8,7 ± 0,4 дня (p < 0,05), болевой синдром в первой группе сохранялся дольше и соответствовал 6,9 ± 0,8 дня, в сравнении со второй и третьей группами (p < 0,05); диспепсические проявления были выражены в первой и второй группах (7,1 ± 0,3 и 4,7 ± 0,4 дня, по сравнению с третьей группой: 3,8 ± 0,3 дня, p < 0,05) (табл. 2).
Манифестация диарейного синдрома отмечалась в ранние сроки заболевания, а именно на 2,8 ± 0,5 дня болезни в первой группе, во второй группе – 4,1 ± 0,3, в третьей – 5,5 ± 0,6 (p < 0,05).
В остром периоде болезни показатели системного иммунного ответа характеризовались нарастанием уровня С-реактивного белка (CРБ) в 12,2 раза в сравнении с нормой в первой группе, во второй группе – в 8,8 раза, в третьей группе – в 3,6 раза (p < 0,05), нейтрофилёзом ((7,4 ± 0,4) × 109 /л против (6,5 ± 0,26) × 109 /л второй группы, (5,8 ± 0,21) × 109 /л третьей группы, p < 0,05), снижением CD3+ (0,68 ± 0,13 против 0,8 ± 0,08 второй группы, 1,03 ± 0,09 третьей группы, p < 0,05), CD4+ (0,57 ± 0,09 против 0,63 ± 0,06 второй группы, 0,85 ± 0,06 третьей группы, p < 0,05), CD8+ (0,14 ± 0,04 против 0,2 ± 0,02 второй группы, 0,33 ± 0,04 третьей группы, p < 0,05), лимфопенией ((1,5 ± 0,11) × 109 /л против (1,8 ± 0,13) × 109 /л второй группы, (2,6 ± 0,09) × 109 /л третьей группы, p < 0,05) (табл. 3).
В период реконвалесценции происходила нормализация уровня нейтрофилов, CD3+ , CD4+ лимфоцитов во всех группах. Обращает на себя внимания сохраняющаяся CD8+ -лимфопения в первой и второй группах в период реконвалесценции, p < 0,05 (табл. 4).
Кроме этого, в разгар заболевания в группе с КП > 200 мкг/г у 63 % больных отмечался уровень С-реактивного белка более 50 мг/л в сравнении с группой с уровнем КП < 50 мкг/г, в которой у 23 % пациентов наблюдались нормальные показатели СРБ (p < 0,05) (табл. 5).
Анализ коррелятивных связей показал взаимосвязь между уровнем КП и количеством дефекаций (r = 0,7, p < 0,001), уровнем С-реактивного белка (r = 0,8, p < 0,001), уровнем нейтрофилов (r = 0,6, p < 0,05) и моноцитов (r = 0,4, p < 0,05), что может свидетельствовать о наличии связи между маркерами системного и локального воспалительного процессов при новой коронавирусной инфекции. Таким образом, КП может выступать доступным и малоинвазивным маркером для оценки системного воспаления при диарейном синдроме при новой коронавирусной инфекции COVID-19.
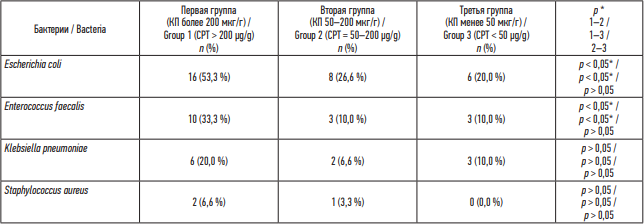
В разгар заболевания кишечная микробиота представлена условно-патогенными микроорганизмами. В первой группе пациентов преобладали Escherichia coli (56,6 против 30,0 % второй группы, 20,0 % третьей группы, p < 0,05), Enterococcus faecalis (36,6 против 13,3 % второй группы, 10,0 % третьей группы, p < 0,05), Klebsiella pneumoniae (20,0 против 10,0 % второй группы, 10,0 % третьей группы, p > 0,05), Staphylococcus aureus (10,0 против 3,3 % второй группы, 0,0 % третьей группы, p > 0,05) (табл. 6). Расчет отношения шансов, выявил, что высокий уровень КП увеличивает тяжесть течения новой коронавирусной инфекции в 3,5 раза (ОШ 3,5 95 % ДИ 0,645–18,981).
Таблица 1. Распределение пациентов по степени тяжести течения новой коронавирусной инфекции, n (%)
Table 1. Distribution of patients by severity of the novel coronavirus disease, n (%)
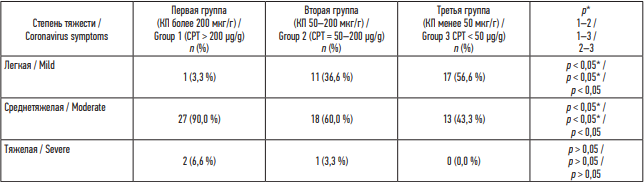
Примечание: * р – при сравнении групп по t-критерию Стьюдента – различия показателей статистически значимы (p < 0,05).
Note: * р – groups are statistically different (p < 0.05 by Student’s t-test).
Таблица 2. Продолжительность ведущих клинических симптомов при новой коронавирусной инфекции COVID-19, в днях
Table 2. Duration of the main clinical symptoms of the novel coronavirus disease (COVID-19), in days
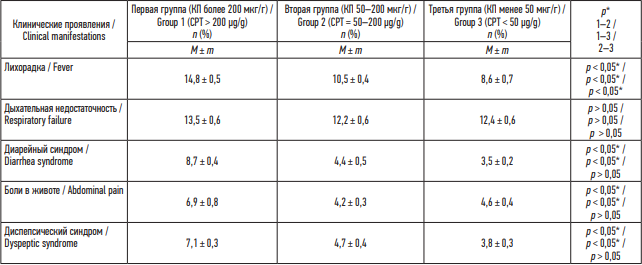
Примечание: * р – при сравнении групп по t-критерию Стьюдента – различия показателей статистически значимы (p < 0,05).
Note: * р – groups are statistically different (p < 0.05 by Student’s t-test).
Таблица 3. Результаты общего анализа крови и иммунограммы, данные на старте
Table 3. Results of a pre-treatment complete blood count and immunogram
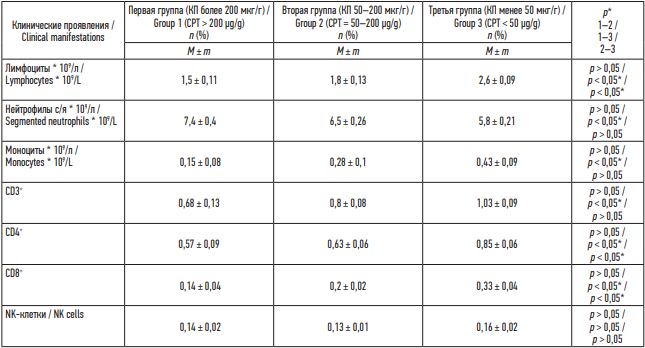
Примечание: * р – при сравнении групп по t-критерию Стьюдента – различия показателей статистически значимы (p < 0,05).
Note: * р – groups are statistically different (p < 0.05 by Student’s t-test).
Таблица 4. Результаты общего анализа крови и иммунограммы, данные после лечения
Table 4. Results of a post-treatment complete blood count and immunogram
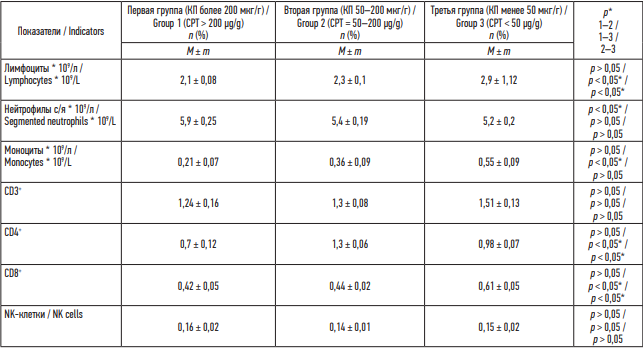
Примечание: * р – при сравнении групп по t-критерию Стьюдента – различия показателей статистически значимы (p < 0,05).
Note: * р – groups are statistically different (p < 0.05 by Student’s t-test).
Таблица 5. Уровень С-реактивного белка в острый период заболевания и уровень фекального кальпротектина, n (%)
Table 5. Levels of C-reactive protein (CRP) and fecal calprotectin (CPT) in the acute phase of the disease, n (%)
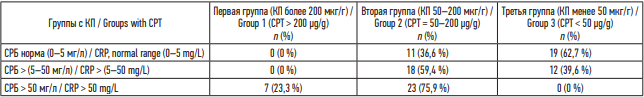
Таблица 6. Состав микробиоты у пациентов с новой коронавирусной инфекцией COVID-19, острый период, n (%)
Table 6. Microbiota composition in patients with the novel coronavirus disease (COVID-19), acute phase, n (%)
Примечание: * р – при сравнении групп по t-критерию Стьюдента, различия показателей статистически значимы (p < 0,05).
Note: * р – groups are statistically different (p < 0.05 by Student’s t-test).
Обсуждение. Известно, что респираторные вирусные инфекции могут изменять состав кишечной микробиоты посредством иммуномодуляции и предрасполагать пациентов к вторичной бактериальной суперинфекции, являющейся основной причиной тяжелого течения у значительного числа пациентов [13].
Клетки воспаления, в том числе нейтрофилы и лимфоциты, проникают в слизистую оболочку кишечника, что нарушает состав микрофлоры [14][15]. Гистологически верифицировано повреждающее действие COVID-19 на энтероциты кишечника, сопровождающееся воспалительной инфильтрацией [11]. Отмечено, что уровень фекального кальпротектина повышается у пациентов, инфицированных SARS-CoV-2, что подтверждает, что SARS-CoV-2 вызывает воспаление в кишечнике [16]. Нарушение регуляции кишечной среды в сочетании с воспалением эпителия увеличивает экспрессию ACE2 в кишечнике, и, таким образом, провоспалительное состояние в кишечном микробиоме становится благоприятным для инфекции SARS-CoV-2 [17][18]. В первой группе с высоким уровнем КП в микробиоте кишечника выявлено преобладание Escherichia coli и Enterococcus faecalis в 2,6 и 3,3 раза больше, чем в группе с низким уровнем КП. Возможно, это связано с тем, что локальный воспалительный процесс оказывает влияние на микробиоту кишечника, активируя факультативную флору, которая, в свою очередь, может способствовать нарушению целостности кишечного барьера, усиливая системное воспаление [19][20].
По данным литературы, уровни фекального кальпротектина были выше у инфицированных COVID-19 с продолжающейся диареей, чем у пациентов с прекратившейся диареей и без нее: 123,2 (± 58,8) против 37,2 (±14,4) и 17,3 (±4,8) мкг/г соответственно (p < 0,001) [21]. В нашем исследовании в группе с уровнем КП более 200 мкг/г диарейный синдром манифестировал в 1,9 раза раньше, чем в группе с уровнем КП менее 50 мкг/г (p < 0,05). Кроме того, лихорадка была продолжительнее в 1,7 раза в группе с уровнем КП более 200 мкг/г, чем в группе с уровнем КП менее 50 мкг/г (p < 0,05). Длительность диареи была в 2,5 раза дольше в группе с уровнем КП более 200 мкг/г, чем в группе с уровнем КП менее 50 мкг/г (p < 0,05). Продолжительность (в днях) абдоминального и диспепсического синдромов была больше в 1,5 и 1,8 раза соответственно в группе с уровнем КП более 200 мкг/г, чем в группе с низким содержанием уровнем КП.
Имеются данные, согласно которым у пациентов с COVID-19 было значительно более низкое количество лимфоцитов СD8+ в крови по сравнению со здоровым контролем [22]. Чрезвычайно высокий уровень продукции провоспалительных цитокинов (IL-6, IL-1β, TNF-α и др.) альвеолярными макрофагами обеспечивает приток большого количества моноцитов и нейтрофилов [23]. В нашем исследовании стартовые показатели моноцитов в группе с уровнем КП более 200 мкг/г в сравнении с группой пациентов с уровнем КП менее 50 мкг/г были ниже нормативных значений в 1,2 раза (p < 0,05) и отмечалось снижение числа CD4+ и CD8+ в 1,4 раза соответственно (p < 0,05). Не исключается, что моноциты рекрутируются в легкие у пациентов с COVID-19 [24], кроме этого, секвенирование одноклеточной РНК (scRNA-seq) показывает, что классические моноциты являются основным источником цитокинов и хемокинов при тяжелой форме COVID-19 [25].
Заключение
1. Клинические проявления новой коронавирусной инфекции COVID-19, протекавшие на фоне выраженного интестинального воспаления, сопровождались серьезными изменениями легких – на КТ органов грудной клетки. Так, в первой группе КТ-3 встречалось в 46,6 % случаев, во второй в 10,0 %, в третьей – в 3,3 % (p < 0,05). Также наблюдалось увеличение продолжительности лихорадки до 14,8 ± 0,5 дня (p < 0,05), диарейного синдрома – до 8,7 ± 0,4 дня (p < 0,05), болевого синдрома – до 6,9 ± 0,8 дня (p < 0,05), диспепсических проявлений – до 7,1 ± 0,3 дня (p < 0,05).
2. Выявлена положительная корреляционная связь между уровнями кальпротектина и длительностью диарейного синдрома: диарейный синдром манифестировал на 2,8 ± 0,5 дня болезни в первой группе, во второй группе – на 4,1 ± 0,3 дня болезни, в третьей – на 5,5 ± 0,6 дня болезни (p < 0,05), а также в группах с разной концентрацией кальпротектина и выраженностью кишечного воспаления (r = 0,7, p < 0,001). При высоком уровне кальпротектина тяжесть клинических симптомов новой коронавирусной инфекции возрастает в 3,5 раза (ОШ 3,5 95 %, ДИ 0,6–18,9).
3. Пейзаж условно-патогенной микробиоты кишечника коррелирует с выраженностью воспалительного процесса в кишечнике: в первой группе пациентов преобладали Escherichia coli (53,3 против 26,6 % второй группы, 20,0 % третьей группы, p < 0,05), Enterococcus facials (33,3 против 10,0 % второй группы, 10,0 % третьей группы, p < 0,05).
1. WMA Declaration of Helsinki – Ethical Principles for Medical Research Involving Human Subjects, 2013.
2. Приказ Минздрава России от 19.06.2003 № 266.
3. Приказ Минздрава России от 12 ноября 2021 г. № 1051н «Об утверждении порядка дачи информированного добровольного согласия на медицинское вмешательство и отказа от медицинского вмешательства, формы информированного добровольного согласия на медицинское вмешательство и формы отказа от медицинского вмешательства». http://publication.pravo.gov.ru/ Document/View/0001202111250019.
4. Протокол № 1/2019 от 25.12.2020.
Список литературы
1. Shafqat A, Shafqat S, Salameh SA, Kashir J, Alkattan K, Yaqinuddin A. Mechanistic insights into the immune pathophysiology of COVID-19; an in-depth review. Front Immunol. 2022;13:835104. doi: 10.3389/fimmu.2022.835104
2. Мороз Е.В., Тарасова Е.С., Агафонова С.Ю., Грачева Е.Н. Патология пищеварительной системы, ассоциированной с COVID-19 // Медицинский вестник ГВКГ им. Н.Н. Бурденко. 2021. № 1 (3). С. 26–36.
3. Gu J, Han B, Wang J. COVID-19: Gastrointestinal manifestations and potential fecal–oral transmission. Gastroenterology. 2020;158(6):1518-1519. doi: 10.1053/j.gastro.2020.02.054
4. Samuelson DR, Welsh DA, Shellito JE. Regulation of lung immunity and host defense by the intestinal microbiota. Front Microbiol. 2015;6:1085. doi: 10.3389/fmicb.2015.01085
5. Новикова В.П., Хавкин А.И., Горелов А.В., Полунина А.В. Ось „легкие-кишечник” и COVID-инфекция // Инфекционные болезни. 2021. Т. 19 № 1. С. 91–96. doi 10.20953/1729-9225-2021-1-91-96
6. Смирнов В.С., Тотолян Арег.А. Врожденный иммунитет при коронавирусной инфекции // Инфекция и иммунитет. 2020. Т. 10. № 2. С. 259–268.
7. Mago S, Vaziri H, Tadros M. The usefulness of fecal calprotectin in the era of the COVID-19 pandemic. Gastroenterology. 2021;160(7):2623-2625. doi: 10.1053/j.gastro.2020.05.045
8. Giuffrè M, Vetrugno L, Di Bella S, Moretti R, Berretti D, Crocè LS. Calprotectin and SARS-CoV-2: A brief-report of the current literature. Healthcare (Basel). 2021;9(8):956. doi: 10.3390/healthcare9080956
9. Вахлова И.В., Федотова Г.В., Боронина Л.Г. Метаболическая активность кишечной микробиоты у детей первого года жизни, перенесших резекцию части кишечника // Российский педиатрический журнал. 2020. Т. 1. № 4. С. 25–35. doi: 10.15690/rpj.v1i4.2196
10. Ferreira C, Viana SD, Reis F. Gut microbiota dysbiosis – immune hyperresponse – inflammation triad in coronavirus disease 2019 (COVID-19): Impact of pharmacological and nutraceutical approaches. Microorganisms. 2020;8(10):1514. doi: 10.3390/microorganisms8101514
11. Magro F, Nuzzo A, Abreu C, et al. COVID-19 in gastroenterology: Where are we now? Current evidence on the impact of COVID-19 in gastroenterology. United European Gastroenterol J. 2021;9(7):750-765. doi: 10.1002/ueg2.12115
12. Yeoh YK, Zuo T, Lui GC, et al. Gut microbiota composition reflects disease severity and dysfunctional immune responses in patients with COVID-19. Gut. 2021;70(4):698-706. doi: 10.1136/gutjnl-2020323020
13. Hanada S, Pirzadeh M, Carver KY, Deng JC. Respiratory viral infection-induced microbiome alterations and secondary bacterial pneumonia. Front Immunol. 2018;9:2640. doi: 10.3389/fimmu.2018.02640
14. Xiao F, Sun J, Xu Y, et al. Infectious SARS-CoV-2 in feces of patient with severe COVID-19. Emerg Infect Dis. 2020;26(8):1920-1922. doi: 10.3201/eid2608.200681
15. Гаус О.В., Беляков Д.Г. Современные взгляды на роль кишечной микробиоты в формировании патологии кишечника // РМЖ. 2022. № 4. С. 10–16.
16. Mazza S, Sorce A, Peyvandi F, Vecchi M, Caprioli F. A fatal case of COVID-19 pneumonia occurring in a patient with severe acute ulcerative colitis. Gut. 2020;69(6):11481149. doi: 10.1136/gutjnl-2020-321183
17. Chan JFW, Kok KH, Zhu Z, et al. Genomic characterization of the 2019 novel human-pathogenic coronavirus isolated from a patient with atypical pneumonia after visiting Wuhan. Emerg Microbes Infect. 2020;9(1):221236. doi: 10.1080/22221751.2020.1719902
18. Долгих Т.И. Поражение желудочно-кишечного тракта при COVID-19. Фекальный трансферрин кальпротектин как лабораторные маркеры повреждения кишечника // Справочник заведующего КДЛ. 2021. № 6. С. 47–56
19. Golonka RM, Saha P, Yeoh BS, et al. Harnessing innate immunity to eliminate SARS-CoV-2 and ameliorate COVID-19 disease. Physiol Genomics. 2020;52(5):217221. doi: 10.1152/physiolgenomics.00033.2020
20. Ермолаева Л.Г., Белозеров С.О., Добродеева А.А. Состояние кишечной микробиоты как прогностический фактор тяжести течения COVID-19 // Заметки ученого. 2020. № 13. С. 32–35.
21. Effenberger M, Grabherr F, Mayr L, et al. Faecal calprotectin indicates intestinal inflammation in COVID-19. Gut. 2020;69(8):1543-1544. doi: 10.1136/gutjnl-2020-321388
22. Zheng M, Gao Y, Wang G, et al. Functional exhaustion of antiviral lymphocytes in COVID-19 patients. Cell Mol Immunol. 2020;17(5):533-535. doi: 10.1038/s41423-020-0402-2
23. Абатуров А.Е. Патогенез COVID-19 //Здоровье ребенка. 2020. Т. 15. № 2. С. 133–144. doi: 10.22141/2224-0551.15.2.2020.200598
24. Sánchez-Cerrillo I, Landete P, Aldave B, et al. COVID-19 severity associates with pulmonary redistribution of CD1c+ DCs and inflammatory transitional and nonclassical monocytes. J Clin Invest. 2020;130(12):6290-6300. doi: 10.1172/JCI140335
25. Vanderbeke L, Van Mol P, Van Herck Y, et al. Monocyte-driven atypical cytokine storm and aberrant neutrophil activation as key mediators of COVID-19 disease severity. Nat Commun. 2021;12(1):4117. doi: 10.1038/s41467-021-24360-w
Об авторах
А. У. СабитовРоссия
доктор медицинских наук, профессор, заведующий кафедрой инфекционных болезней и клинической иммунологии ФГАУ ВО «Уральский государственный медицинский университет»
ул. Репина, д. 3, Свердловская область, г. Екатеринбург, 620028
Ю. Н. Москалёва
аспирант кафедры инфекционных болезней и клинической иммунологии ФГАУ ВО «Уральский государственный медицинский университет»; врач-инфекционист, заведующий приемным отделением инфекционной службы ГАУЗ СО «Городская клиническая больница № 40»
ул. Репина, д. 3, Свердловская область, г. Екатеринбург, 620028
ул. Волгоградская, д. 189, г. Екатеринбург, 620102
Ю. Б. Хаманова
доктор медицинских наук, доцент кафедры инфекционных болезней и клинической иммунологии ФГАУ ВО «Уральский государственный медицинский университет»; врач-иммунолог ГАУЗ СО «Городская
клиническая больница № 40»
ул. Репина, д. 3, Свердловская область, г. Екатеринбург, 620028
ул. Волгоградская, д. 189, г. Екатеринбург, 620102
А. А. Шарова
кандидат медицинских наук, доцент кафедры инфекционных болезней и клинической иммунологии ФГАУ ВО «Уральский государственный медицинский университет»
ул. Репина, д. 3, Свердловская область, г. Екатеринбург, 620028
А. В. Чащина
ординатор 1-го года ФГАУ ВО «Уральский государственный медицинский университет»
ул. Репина, д. 3, Свердловская область, г. Екатеринбург, 620028
Л. А. Шмальц
ординатор 1-го года ФГАУ ВО «Уральский государственный медицинский университет»
ул. Репина, д. 3, Свердловская область, г. Екатеринбург, 620028
Дополнительные файлы
Рецензия
Для цитирования:
Сабитов А.У., Москалёва Ю.Н., Хаманова Ю.Б., Шарова А.А., Чащина А.В., Шмальц Л.А. Маркеры местного и системного воспаления при диарейном синдроме при новой коронавирусной инфекции COVID-19. Здоровье населения и среда обитания – ЗНиСО. 2023;31(10):62-70. https://doi.org/10.35627/2219-5238/2023-31-10-62-70
For citation:
Sabitov A.U., Moskaleva Yu.N., Khamanova Y.B., Sharova A.A., Chashchina A.V., Schmalts L.A. Markers of Local and Systemic Inflammation in the Diarrhea Syndrome Associated with the Coronavirus Disease (COVID-19). Public Health and Life Environment – PH&LE. 2023;31(10):62-70. (In Russ.) https://doi.org/10.35627/2219-5238/2023-31-10-62-70









.png)



























