Перейти к:
Разработка и валидация биоаналитической методики количественного определения гетероциклов (фуран и метилфуран) в крови человека методом хромато-масс-спектрометрией (ГХ-МС)
https://doi.org/10.35627/2219-5238/2023-31-4-7-15
Аннотация
Введение. Фураны входят в перечень основных экополютантов, составляющих ксенобиотический профиль. Высокая канцерогенность и мутагенность фуранов даже при низких концентрациях в организме человека, порядка 10–12–10–15 г/кг, могут создавать реальную угрозу здоровью настоящего и будущих поколений.
Цель исследования: разработка и валидация авторской методики количественного определения потенциально опасных фурана и метилфурана в крови человека для обеспечения контроля за содержанием экзогенных соединений в биологических средах, для выполнения работ по оценке риска здоровью населения при воздействии химических веществ.
Материалы и методы. Разработка методики определения фурана и метилфурана в крови человека основана на принципах: установление хромато-масс-спектрометрических условий анализа; экспериментальная отработка эффективных способов подготовки образца биосреды (кровь) к хромато-масс-спектрометрическому анализу; экспериментальное доказательство пригодности разработанной методики для решения задач по количественному определению фурана и метилфурана в крови.
Результаты. Разработанная методика базируется на жидко-жидкостной экстракции органическим растворителем с целью извлечения и концентрирования аналитов в щелочной среде в течение 5 минут до установления межфазного равновесия и дальнейшем анализе экстракта методом капиллярной газовой хроматографии. Достигнута высокая степень извлечения фурана и метилфурана из образцов крови 98 и 98,5 %. Для идентификации фуранов в биосреде применяли масс-спектрометрическое детектирование с регистрацией спектра масс-ионов.
Выводы. На основании выполненных исследований разработана и валидирована в условиях лаборатории высокочувствительная и специфичная методика газохроматографического определения фурана и метилфурана в крови с масс-спектрометрическим детектированием. Диапазон измеряемых концентраций для фурана и метилфурана составил от 0,0019 до 0,09 мг/дм3. В процессе валидации методики установлены пределы обнаружения (LOD) изучаемых соединений в крови, которые составили для фурана до 0,00011 мкг/см3 и до 0,000021 мкг/см3 для метилфурана.
Ключевые слова
Для цитирования:
Нурисламова Т.В., Мальцева О.А., Попова Н.А., Чинько Т.В. Разработка и валидация биоаналитической методики количественного определения гетероциклов (фуран и метилфуран) в крови человека методом хромато-масс-спектрометрией (ГХ-МС). Здоровье населения и среда обитания – ЗНиСО. 2023;31(9):7-15. https://doi.org/10.35627/2219-5238/2023-31-4-7-15
For citation:
Nurislamova T.V., Mal’tseva О.А., Popova N.А., Chinko Т.V. Development and Validation of a Bioanalytical Method of Measuring Heterocyclic Organic Compounds (Furan and Methylfuran) in Human Blood Using GC-MS. Public Health and Life Environment – PH&LE. 2023;31(9):7-15. (In Russ.) https://doi.org/10.35627/2219-5238/2023-31-4-7-15
Введение. Общий подъем индустриализации, а также агрохимический прогресс в сельском хозяйстве приводят к общей «химизации» среды обитания и, как следствие, к повышению роли химико-аналитического контроля при решении проблем взаимодействия человека с окружающей средой. В этом случае происходит непроизвольное расширение номенклатуры как объектов исследования, так и числа антропогенных ксенобиотиков. Среди них загрязнители, воздействующие на среду обитания на чрезвычайно низком уровне (нижний предел обнаружения – 10–10–10–11 %), таких токсичных соединений, как фураны [1]. Опасность фуранов для человека и окружающей среды обусловлена целым рядом свойств: токсичность, устойчивость к разложению, способность к биоаккумуляции, предрасположенность к атмосферному переносу на большие расстояния. В организм человека из воздуха и с пылью поступает ежедневно 3 пг/день фурана (российская ПДК фурана для атмосферного воздуха – 0,5 пг/м3) и его производных, если рядом есть постоянные источники стойких органических загрязнителей (СОЗ) [2–4].
Фураны входят в перечень основных экополютантов, составляющих ксенобиотический профиль [5]. Высокая канцерогенность и мутагенность фуранов даже при низких концентрациях в организме человека, порядка 10–12–10–15 г/кг, могут создавать реальную угрозу здоровью настоящего и будущих поколений.
Концентрация фуранов по мере перемещения по пищевой цепочке может возрастать в тысячи и десятки тысяч раз. В связи с этим возникает необходимость его качественного и количественного контроля [6][7]. Кроме того, фуран является гетероциклическим органическим промышленным химическим и пищевым загрязнителем. Канцерогенные эффекты фурана объясняются генотоксическими и негенотоксичными механизмами; накопленные данные показали возникновение устойчивого гипометилирования цитозиновой ДНК, гиперметилирования промоторной области в генах-супрессорах опухолей и вилочковой коробке E1 (FOXE1) и деацетилирования гистона H3 в лизинах 9 и 56 в печени при воздействии фурана. Это указывает на то, что эпигенетические изменения не являются случайным событием и играют фундаментальную роль в гепатобилиарном канцерогенезе, связанном с фураном [8–12].
Концентрация фуранов по мере перемещения по пищевой цепочке может возрастать в тысячи и десятки тысяч раз [13][14]. Проведение биомониторинга с использованием современных прецизионных аналитических методик контроля содержания токсичных соединений в биологических средах направлено на совершенствование системы контроля качества, оценки риска и безопасности объектов окружающей среды, что, в свою очередь, будет способствовать сохранению здоровья населения [15][16].
Актуальность разработки методики определения потенциально опасных фурана и метилфурана в крови заключается во внедрении методологии биомониторинга в РФ для повышения объективности оценки вреда здоровью в условиях химического загрязнения окружающей среды на базе существующей системы социально-гигиенического мониторинга в учреждениях Роспотребнадзора во взаимодействии с лечебными учреждениями Минздрава РФ.
Цель исследования – разработка и валидация авторской методики количественного определения потенциально опасных фурана и метилфурана в крови человека для обеспечения контроля за содержанием экзогенных соединений в биологических средах, для выполнения работ по оценке риска здоровью населения при воздействии химических веществ.
Материалы и методы исследования. Предметом исследований являлись биосреда (гемолимфа человека), технологическая разработка хромато-масс-спектрометрической методики: экспериментальном установлении хромато-масс-спектрометрических условий анализа фурана и метилфурана с использованием стандартного образца на капиллярных колонках различной полярности и способы подготовки биопробы (кровь) для химического анализа, изучении степени экстракции методом «введено-найдено», количественного определения и валидации методики. Период разработки методики определения фурана и метилфурана в крови составил январь – июль 2023 г.
Химические материалы и реагенты: фуран и метилфуран (Sigma-Aldrich), массовая доля основного вещества фурана и метилфурана ≥ 99,0 %; гептан нормальный эталонный (ГОСТ 25828-831); газообразный гелий марки «А», в баллонах (ТУ 20.11.11-002-01868373); газообразный азот осч (чистота 99,996 %).
Инструменты и условия анализа: хромато-масс-спектрометрическая система, («ХроматэкКристалл» (Россия)) в составе: хроматограф с отечественным квадрупольным масс-спектрометрическим (масс-селективный) детектором, режим Split ratio азот: воздух – 12,5, температура ионного источника – 200 °С, температура квадрупольного масс-анализатора – 150 °С, ток эмиссии – 70 эВ; кварцевая колонка серии DB-5MS 60 m × 0,250 mm × 0,250 µm.
Этапы исследования:
1 – экспериментальная отработка хромато-масс-спектрометрических условий определения фурана и метилфурана с применением стандартных растворов;
2 – выбор органического растворителя для исследований;
3 – изучение зависимости полноты экстракции фурана и метилфурана из биоматериала (кровь) методами экстракции органическим растворителем;
4 – количественное определение гетероциклов в крови.
Экспериментальная отработка хромато-масс-спектрометрических условий анализа фурана и метилфурана в пробах крови
Регулируя полярность соответствующим подбором неподвижных жидких фаз или используя капиллярные колонки с различными по полярности НЖФ, можно достигать высокой эффективности разделения.
Экспериментально отработаны и подобраны условия разделения фурана, метилфурана и сопутствующих компонентов на кварцевых капиллярах для хроматографических колонок, заполненных неподвижными жидкими фазами с различными характеристиками: полярная цианопропильная фаза, слабополярная фаза с покрытием нитротерефталевой кислотой и DB-5MS 60 m × 0,250 mm × 0,250 µm, на которой было достигнуто разделение фурана и метилфурана. Хроматографическое разделение компонентов пробы основывается на селективности сорбента и термодинамических свойствах аналитов по отношению к хроматографической системе. На селективность оказывает влияние температура, а на эффективность влияет скорость потока газа-носителя. С увеличением температуры снижается селективность, но при этом повышается эффективность. В процессе разделения фурана и метилфурана во времени применяли режим программирования температуры колонки, т. е. температуру капиллярной колонки повышали от 40 до 200 °С со скоростью 40 °С/мин, что позволило разделить и выделить все компоненты биологического образца.
Результаты. В условиях эксперимента были отработаны расход газа-носителя с делением потока азот:воздух и без деления потока азот:воздух. Диапазон сканирования выполнен от 37 до 150 а.е.м. Результаты экспериментально отработанных условий хроматографирования представлены в табл. 1.
Эффективное разделение следовых количеств легколетучих органических соединений (фуран и метилфуран) основано на экспериментально отработанных оптимальных газохроматографических параметрах и вводе пробы в поток газа-носителя с делением потока с коэффициентом деления 12,5 (режим 2, табл. 1). Хроматограмма стандартного раствора фурана и метилфурана при отработанных хромато-масс-спектрометрических условиях анализа представлена на рис. 1.
Использование органического растворителя для экстракции фурана и метилфуран из биологической среды (кровь)
Метод экстракции – процесс изолирования органическими растворителями химических соединений из различных биообъектов [15].
Сложность экстракции фурана и метилфурана из крови обусловлена достаточно высокой степенью связывания данных соединений с белками крови (50–60 %) [17]. Поэтому для изолирования фурана и метилфурана из крови применяли ряд органических полярных и неполярных растворителей и изучали влияние различных факторов на эффективность экстракции фурана и метилфурана из крови: объем экстрагента и биосреды, температуру экстракции, водородный показатель (рН) биосреды, высаливающие агенты.
Выбор органического растворителя. Для выбора экстрагента для извлечения фурана и метилфурана из крови использовали ряд органических растворителей различной полярности и изучали зависимость степени экстракции. Результаты экспериментальных исследований представлены в табл. 2.
Максимальная полнота извлечения фурана и метилфурана 62–86 % (табл. 2) из крови достигнута при использовании в качестве растворителя гептана.
Объем экстрагента. Максимальная степень извлечения фурана и метилфурана из образца крови установлена при уменьшении объема органического растворителя (экстрагента) Vорг. Результаты представлены в табл. 3.
Полученные результаты (табл. 3) показали, что при использовании органического растворителя гептана в объеме 1,0 см3 для экстракции степень извлечения из крови составила для фурана 62,8 % и для метилфурана 86,7 %.
Изучение зависимости степени экстракции фурана и метилфурана из цельной крови и плазмы от объема биоматериала и органических растворителей
Изолирование токсичных соединений методом экстракции проводили из цельной крови. Экспериментально установлена степень извлечения фурана и метилфурана из пробы крови с применением стандартного образца в зависимости от объема органического растворителя и объема крови (табл. 4).
Анализ полученных результатов (табл. 4) показал, что использование 1 см3 экстрагента (гептан) и 2,5 см3 крови, 2 последовательных экстракций в течение 5 минут и центрифугировании пробы крови в течение 10 минут при 5000 об./мин позволило достичь степени экстракции для фурана 77 % и метилфурана 91 %. При использовании плазмы крови полнота извлечения фурана и метилфурана составила для фурана 15 % и для метилфурана 16 %.
Изучение зависимости степени экстракции фурана и метилфурана из крови от высаливающих агентов (электролитов)
Для повышения степени извлечения фурана и метилфурана из проб крови использовали ряд нейтральных солей щелочных и щелочноземельных металлов: сульфат и хлорид натрия, гидрофосфат аммония и смесь солей (4 г MgSO4 безводного, 1 г NaCl, 1 г натрия лимоннокислого трехзамещенного и 0,5 г натрия лимоннокислого двузамещенного, 1,5 водного, общий вес 6,5 г) [18].
Средние значения полноты экстракции фурана и метилфурана из крови с применением нейтральных солей представлены в табл. 5.
При использовании высаливающих агентов удалось достичь извлечение фурана и метилфурана из крови не более 67 % (табл. 5).
Изучение зависимости степени экстракции фурана и метилфурана из крови от рН
Экстракция органических соединений из биосреды зависит в том числе от водородного показателя (рН среды). При экстракции недиссоциированные молекулы переходят в органическую фазу, повышая тем самым полноту извлечения органического соединения из биосреды.
С целью максимального извлечения фурана и метилфурана из крови и установления параметров экстракции в экспериментальных исследованиях применяли и подкисление неорганической кислотой и подщелачивание щелочью щелочноземельных металлов биопробы для разрушения связей фурана и его производных с белками крови. При взаимодействии фурана и его производных с сильными кислотами уменьшается стабильность кольца – фурановое кольцо расщепляется и полимеризуется [19]. Неустойчивость фурана в кислой среде сопровождается сильным осмолением и промежуточным образованием диеновых соединений. Вместе с тем фуран устойчив к действию щелочей щелочноземельных металлов, и поэтому фурановое кольцо не разрушается [20]. Полученные результаты представлены в табл. 6.
Применение в качестве экстрагента гептана (табл. 6) объемом 1 см3 и 10 % р-ра щелочи (NaOH) позволяет повысить степень экстракции фурана и метилфурана из образца крови до 98 %.
Таблица 1. Результаты экспериментально отработанных условий хроматографирования образца крови
Table 1. Results of experimentally worked out conditions for chromatography of a blood sample

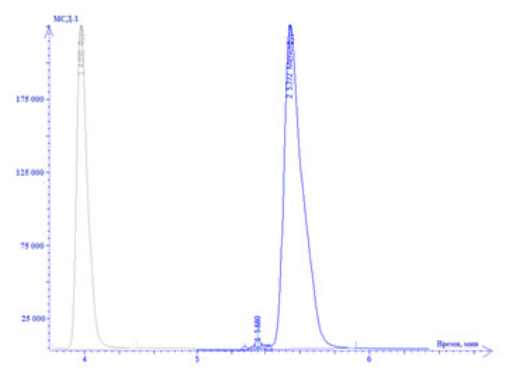
Рисунок. Масс-хроматограмма стандартного раствора фурана (m/z = 68,53) и метилфурана (m/z = 82,81) из крови
Figure. Mass chrom atogram of a standard solution of furan (m/z = 68.53) and methylfuran (m/z = 82.81) from blood
Таблица 2. Зависимость степени извлечения фурана и метилфурана из крови от различной полярности органических растворителей (n = 5, р = 0,95)
Table 2. The relationship between the polarity of organic solvents and the degree of furan and methylfuran extraction from blood (n = 5, p = 0.95)

Таблица 3. Зависимость степени экстракции фурана и метилфурана из крови от объема органического растворителя
Table 3. The relationship between the injected volume of the organic solvent and the degree of furan and methylfuran extraction from blood

Таблица 4. Зависимость степени экстракции фурана и метилфурана из крови от объема органического растворителя и объема крови для анализа
Table 4. The relationship between the volume of the organic solvent and blood sample and the degree of furan and methylfuran extraction from blood

Таблица 5. Зависимость степени экстракции фурана и метилфурана из крови от высаливающих агентов (n = 5, р = 0,95)
Table 5. The relationship between the salting-out agents and the degree of furan and methylfuran extraction (n = 5, p = 0.95)

Таблица 6. Зависимость полноты извлечения фурана и метилфурана из крови от рН среды (n = 2, р = 0,95)
Table 6. The relationship between the pH of the solution and the degree of furan and methylfuran extraction from blood (n = 2, p = 0.95)

Валидационные характеристики биоаналитической методики. С использованием отработанного способа подготовки образцов крови к химическому анализу фурана и метилфурана проведена оценка пригодности (валидация) разработанной методики в деятельности испытательной лаборатории по перечисленным ниже характеристикам: специфичность (specificity); предел обнаружения (detection limit) (LOD); предел количественного определения (quantitation limit) (LOQ); аналитической области (range); линейности (linearity); правильности (trueness) и прецизионности (precision) согласно ГОСТ ИСО/ МЭК 17025-20092.
Основным руководством по валидации методики является драфт-руководство Европейского медицинского агентства (ЕМА) 2009 г.3.
Для доказательства специфичности аналитической методики определения фурана и метилфурана в крови проводили анализ биологической жидкости, к которой предварительно прибавляли стандартный раствор определяемых веществ в таком количестве, чтобы их содержание в пробе находилось в предполагаемом диапазоне концентраций, и летучие органические соединения: этанол, пентан, гексан, бензол, ксилол. В процессе исследований установлено, что определению фурана и метилфурана в крови не мешают летучие органические соединения: этанол, пентан, гексан, бензол, ксилол и др.
Полученные результаты анализа оценивали по соотношению «сигнал/шум» на хромато-масс-спектрометрической системе.
Для определения пределов (LOD) обнаружения фурана и метилфурана в крови проводили эксперимент, заключающийся в том, что готовили стандартные образцы фурана и метилфурана на уровне нижнего диапазона концентраций и вносили стандарт в пробы крови, приготовленные для анализа.
Пределы обнаружения для фурана и метилфурана определяли по хроматограмме, используя величины стандартных отклонений сигнала, и по угловому коэффициенту калибровочного графика. Предел обнаружения (ПО) находили по уравнению:
ПО = 3,3 · S/b,
где S – стандартное отклонение аналитического сигнала; b – коэффициент чувствительности, представляющий собой отношение аналитического сигнала к определяемой величине (тангенс угла наклона калибровочной кривой).
Для фурана предел обнаружения (LOD) составил 0,00011 мкг/см3, для метилфурана = 0,000021 мкг/см3.
Предел количественного определения (LOQ) рассчитывали по уравнению: ПКО = 10 × S / b, где S – стандартное отклонение аналитического сигнала; b – коэффициент чувствительности, представляющий отношение аналитического сигнала к определяемой величине [21–24].
По рекомендациям CITAC за предел определения принимали величину 10 So.
Предел количественного определения LOQ для фурана в крови составил Сlim = 0,0011 мкг/см3. Для метилфурана LOQ в крови составил Сlim = 0,00021 мкг/см3.
Аналитическая область методики. Определение содержания фурана и метилфурана в образцах крови выполняли методом градуировочного графика. Для этого готовили 3 серии шкал стандартов и с помощью программного обеспечения строили градуировку, которая имела линейную зависимость при среднем квадратическом отклонении повторяемости (СКО) не более 10.
Диапазон экспериментальных данных, удовлетворяющих линейной модели, составил 0,0019– 0,09 мг/дм3.
Линейность методики. Линейность разработанной методики в диапазоне измеряемых концентраций проверяли экспериментально измерением аналитических сигналов для 3 серий шкал с различными концентрациями определяемых соединений. Экспериментальные данные обрабатывали методом наименьших квадратов с использованием линейной модели:
y = b × x + a,
где х – количество или концентрация определяемого вещества;
y – величина отклика (сигнал компонента на хроматограмме);
b – угловой коэффициент;
a – свободный член (ОФС «Статистическая обработка результатов химического эксперимента»).
Рассчитаны и представлены величины: угловой коэффициент (b) и коэффициент корреляции (r). Использовали линейные зависимости, отвечающие условию |r| ≥ 0,99 с доверительной вероятностью Р = 99,9 %.
Установленные значения погрешности (и ее составляющих) измерений по разработанной методики представлены в табл. 7.
Установленные показатели, характеризующие составляющие бюджета неопределенности или погрешности измерений (табл. 7), составили: показатель точности для фурана – 12,76 %, для метилфурана – 12,88 %, показатель повторяемости для фурана – 17,89 %, для метилфурана – 16,98 %, показатель внутрилабораторной прецизионности для фурана – 5,98 %, для метилфурана – 6,04 %.
Таблица 7. Значения показателей качества количественного химического анализа фурана и метилфурана в крови, установленных экспериментально
Table 7. Experimentally established quality indicators of the quantitative chemical analysis of furan and methylfuran in blood

Изолирование фурана и метилфурана из крови методом жидкость-жидкостной экстракции
Кровь объемом 2,5 см3 помещали в пробирку объемом 10 см3, пробу подщелачивали 10 % раствором NaOH. Затем добавляли 1 см3 полярный растворитель гептан и экстрагировали в течение 5 минут. Пробу центрифугировали при 5000 об./мин в течение 10 минут и экстракт анализировали методом хромато-масс-спектрометрии.
Обсуждение. Авторская методика включала два этапа исследований:
1 – разработка высокочувствительной и селективной хромато-масс-спектрометрической методики определения токсичных фурана и метилфурана в крови;
2 – валидация разработанной методики в условиях лаборатории.
На основании выполненных исследований разработана и валидирована в условиях лаборатории высокочувствительная и специфичная методика газохроматографического определения фурана и метилфурана в крови с масс-спектрометрическим детектированием. Диапазон измеряемых концентраций фурана и метилфурана в крови составил 0,0019–0,09 мг/дм3 при погрешности 22 %.
Нормы метрологических характеристик (относительной погрешности и относительного стандартного отклонения) для разработанной аналитической методики составляют не более 15 и не более 9,5 % для уровня концентраций, соответствующих пределу количественного определения (ПКО), что соответствует требованиям драфт-руководства ЕМА4.
Выводы
1. Для эффективного извлечения фурана и метилфурана из образцов крови (99 %) применяли полярный растворитель гептан.
2. Полученные результаты позволили заключить, что фуран и метилфуран с высокой степенью извлечения 98 и 98,5 % изолируются из щелочной среды при объеме крови 2,5 см3 и при использовании полярного растворителя гептана объемом 1 см3.
3. Изолирование фурана и метилфурана из крови выполняли методом жидкостной экстракции. Для этого кровь объемом 2,5 см3 помещали в пробирку объемом 10 см3, пробу подщелачивали 10 % раствором NaOH. Затем добавляли 1 см3 полярного растворителя (гептан) и экстрагировали в течение 5 минут до установления межфазного равновесия. Пробу крови центрифугировали при 5000 об./мин в течение 10 минут и фуран и метилфуран определяли в извлечениях методом газовой хроматографии масс-спектрометрии.
4. В процессе валидации методики установлены пределы обнаружения (LOD) изучаемых соединений в крови, которые составили: для фурана – до 0,00011 мкг/см3 и для метилфурана – до 0,000021 мкг/см3.
5. Низкие пределы обнаружения (LOD) фурана и метилфурана в крови достигнуты за счет использования в исследованиях по разработке методики определения:
- современного хромато-масс-спектрометра с квадрупольным масс-спектрометрическим (масс-селективный) детектором («Хроматэк-Кристалл»), технические характеристики которого позволяют измерять концентрации фурана и метилфурана на уровне предела количественного обнаружения;
- высокочувствительного масс-селективного детектора (МСД);
- кварцевой капиллярной колонки серии DB-5MS 60 m × 0,250 mm × 0,250 µm, что обеспечило снижение пределов количественного определения (LOQ) до 0,0011 мкг/см3 для фурана и до 0,00021 мкг/см3 для метилфурана.
Разработанная методика определения потенциально опасных фурана и метилфурана в крови является оригинальной авторской разработкой и вносит практический вклад в решение проблемы профилактики и управления здоровьем с оценкой конкретных химических факторов и определением экспозиции населения.
1. ГОСТ 25828-83. Гептан нормальный эталонный. М.: Стандартинформ, 2009. 5 с.
2. ГОСТ ИСО/МЭК 17025-2009. Межгосударственный стандарт. Общие требования к компетенции испытательных калибровочных лабораторий.
3. Guideline on validation of bioanalytical methods (draft). European Medicines Agency. Committee for medicinal products for human use: London, 2009.
4. Guideline on validation of bioanalytical methods (draft). European Medicines Agency. Committee for medicinal products for human use: London, 2009.
Список литературы
1. Kudryavtseva AD, Shelepchikov AA, Brodsky ES. Free-range chicken eggs as a bioindicator of dioxin contamination in Vietnam, including long-term Agent Orange impact. Emerg Contam. 2020;6:114-123. doi: 10.1016/j.emcon.2020.02.003
2. Famiyeh L, Chen K, Xu J, et al. A review on analysis methods, source identification, and cancer risk evaluation of atmospheric polycyclic aromatic hydrocarbons. Sci Total Environ. 2021;789:147741. doi: 10.1016/j.scitotenv.2021.147741
3. Xu JS, Xu HH, Xiao H, et al. Aerosol composition and sources during high and low pollution periods in Ningbo, China. Atmos Res. 2016;178-179:559-569. doi: 10.1016/j.atmosres.2016.05.006
4. Lee CS, Venkatesan AK, Walker HW, Gobler CJ. Impact of groundwater quality and associated byproduct formation during UV/hydrogen peroxide treatment of 1,4-dioxane. Water Res. 2020;173:115534. doi: 10.1016/j.watres.2020.115534
5. Мешков Н.А, Рахманин Ю.А. Методологические аспекты гигиенической оценки адаптивной реакции организма на влияние факторов профессиональной деятельности в системе оценки риска // Гигиена и санитария. 2021. Т. 100. № 4. С. 387–395. doi: 10.47470/0016-9900-2021-100-4-387-395. EDN QCKYQG.
6. Yang M, Jiang J, Hua L, et al. Rapid detection of volatile organic metabolites in urine by high-pressure photoionization mass spectrometry for breast cancer screening: A pilot study. Metabolites. 2023;13(7):870 doi: 10.3390/metabo13070870
7. Doherty AC, Lee CS, Meng Q, et al. Contribution of household and personal care products to 1,4-dioxane contamination of drinking water. Curr Opin Environ Sci Health. 2023;31:100414. doi: 10.1016/j.coesh.2022.100414
8. Adamson DT, Piña EA, Cartwright AE, et al. 1,4-Dioxane drinking water occurrence data from the third unregulated contaminant monitoring rule. Sci Total Environ. 2017;596-597:236-245. doi: 10.1016/j.scitotenv.2017.04.085
9. Huffman MP, Høie AH, Svendsen C, et al. An in vitro study on the genotoxic effect of substituted furans in cells transfected with human metabolizing enzymes: 2,5-dimethylfuran and furfuryl alcohol. Mutagenesis. 2016;31(5):597-602. doi: 10.1093/mutage/gew025
10. Xing Y, Xing H, Ma Y, Liu Q, Xu S. In vitro and in vivo studies of metabolic activation of marrubiin, a bioactive constituent from Marrubium vulgare. Chem Res Toxicol. 2021;34(9):2157-2165. doi: 10.1021/acs.chemrestox.1c00250
11. Зайцева Н.В., Уланова Т.С., Нурисламова Т.В., Попова Н.А., Мальцева О.А. Количественные показатели нитратов в моче и N-нитрозодиметиламина в крови как маркеры пероральной экспозиции нитратов, поступающих с питьевой водой // Гигиена и санитария. 2018. Т. 97. № 11. С. 1087–1092. doi: 10.47470/0016-9900-2018-97-11-1087-92. EDN: YPXHXN
12. Russo MT, De Luca G, Palma N, et al. Oxidative stress, mutations and chromosomal aberrations induced by in vitro and in vivo exposure to furan. Int J Mol Sci. 2021;22(18):9687. doi: 10.3390/ijms22189687
13. McClure RA, Goering AW, Ju KS, et al. Elucidating the rimosamide-detoxin natural product families and their biosynthesis using metabolite/gene cluster correlations. ACS Chem Biol. 2016;11(12):3452-3460. doi: 10.1021/acschembio.6b00779
14. Nunes J, Martins IL, Charneira C, et al. New insights into the molecular mechanisms of chemical carcinogenesis: In vivo adduction of histone H2B by a reactive metabolite of the chemical carcinogen furan. Toxicol Lett. 2016;264:106-113. doi: 10.1016/j.toxlet.2016.10.018
15. Navada KK, Kulal A. Kinetic characterization of purified laccase from Trametes hirsuta: A study on laccase catalyzed biotransformation of 1,4-dioxane. Biotechnol Lett. 2021;43(3):613-626. doi: 10.1007/s10529-020-03038-1
16. Зайцева Н.В., Май И.В., Кирьянов Д.А., Горяев Д.В. Научное обоснование приоритетных веществ, объектов квотирования и направлений действий по снижению аэрогенных рисков здоровью населения при реализации полномочий санитарной службы Российской Федерации // Анализ риска здоровью. 2022. № 4. С. 4–17. doi: 10.21668/health.risk/2022.4.01
17. Шабунин С.В. Беляев В.И., Бузлама С.В. Экотоксиканты, распространение, профилактика и лечение // Ветеринария. 2014. № 7. С. 3–8. EDN SKOKXJ.
18. Эделев И.С., Обухова Л.М., Андриянова Н.А., Эделев Н.С. Перспективы использования параметров окислительной модификафии белков сыворотки крови для установления длительности агонального периода // Судебная медицина. 2019. Т. 3. С. 28–32. doi: 10.19048/2411-8729-2019-5-3-28-32
19. Коренман Я.И., Шорманов В.К., Мокшина Н.Я., Кривошеева О.А., Голубицкий Г.Б. Выделение, экстракционное концентрирование и определение кофеина при исследовании плазмы крови // Судебно-медицинская экспертиза. 2012. Т. 2. С. 32–35.
20. Gates LA, Lu D, Peterson LA. Trapping of cis-2-butene-1,4-dial to measure furan metabolism in human liver microsomes by cytochrome P450 enzymes. Drug Metab Dispos. 2012;40(3):596-601. doi: 10.1124/dmd.111.043679
21. Zhang Y, Zhang Y. A comprehensive review of furan in foods: From dietary exposures and in vivo metabolism to mitigation measures. Compr Rev Food Sci Food Saf. 2023;22(2):809-841. doi: 10.1111/1541-4337.13092
22. Золотов Ю.А. Перспективы развития аналитической химии // Журнал аналитической химии. 2019. Т. 74. № 9S. С. S3-S4. doi: 10.1134/S0044450219090251. EDNXWMQNU.
23. Мелехин А.О., Толмачева В.В., Шубина Е.Г. и др. Новый дериватизирующий агент для определения метаболитов нитрофуранов в куриных яйцах методом высокоэффективной жидкостной хроматографиитандемной масс-спектрометрии // Журнал аналитической химии. 2021. Т. 76. № 11. С. 1012–1021. doi: 10.31857/S0044450221110086. EDN RHKZJB.
24. Zuma NH, Aucamp J, N’Da DD. An update on derivatisation and repurposing of clinical nitrofuran drugs. Eur J Pharm Sci. 2019;140:105092. doi: 10.1016/j.ejps.2019.105092
Об авторах
Т. В. НурисламоваРоссия
Нурисламова Татьяна Валентиновна – д.б.н., заведующий отделом химико-аналитических методов исследования
ул. Монастырская, д. 82, г. Пермь, 614045
О. А. Мальцева
Россия
Мальцева Ольга Андреевна – к.б.н., научный сотрудник лаборатории методов газовой хроматографии
ул. Монастырская, д. 82, г. Пермь, 614045
Н. А. Попова
Россия
Попова Нина Анатольевна – старший научный сотрудник лаборатории методов газовой хроматографии
ул. Монастырская, д. 82, г. Пермь, 614045
Т. В. Чинько
Россия
Чинько Татьяна Викторовна – младший научный сотрудник лаборатории методов газовой хроматографии
ул. Монастырская, д. 82, г. Пермь, 614045
Дополнительные файлы
Рецензия
Для цитирования:
Нурисламова Т.В., Мальцева О.А., Попова Н.А., Чинько Т.В. Разработка и валидация биоаналитической методики количественного определения гетероциклов (фуран и метилфуран) в крови человека методом хромато-масс-спектрометрией (ГХ-МС). Здоровье населения и среда обитания – ЗНиСО. 2023;31(9):7-15. https://doi.org/10.35627/2219-5238/2023-31-4-7-15
For citation:
Nurislamova T.V., Mal’tseva О.А., Popova N.А., Chinko Т.V. Development and Validation of a Bioanalytical Method of Measuring Heterocyclic Organic Compounds (Furan and Methylfuran) in Human Blood Using GC-MS. Public Health and Life Environment – PH&LE. 2023;31(9):7-15. (In Russ.) https://doi.org/10.35627/2219-5238/2023-31-4-7-15









.png)



























