Перейти к:
Половозрастные особенности биомаркеров экспозиции и негативных эффектов у детей с заболеваниями органов дыхания и коморбидных им состояний, ассоциированных с аэрогенной комбинированной экспозицией химическими факторами
https://doi.org/10.35627/2219-5238/2023-31-3-43-51
Аннотация
Введение. В настоящее время высокоактуальным при оценке нарушений состояния здоровья населения, связанных с воздействием химических факторов риска, является применение системы биомаркеров экспозиции и эффекта. Изучение биомаркеров у чувствительных контингентов с учетом половозрастных особенностей при конкретных видах функциональных нарушений и заболеваний, ассоциированных с аэрогенной химической экспозицией, позволяет повысить эффективность научно-методического обеспечения деятельности органов и организаций Роспотребнадзора при установлении причин и выявлении условий возникновения и распространения риск-ассоциированных неинфекционных заболеваний.
Цель: установление биомаркеров экспозиции и негативных эффектов с учетом пола и возраста у детей с заболеваниями органов дыхания и коморбидных им состояний в условиях аэрогенной комбинированной экспозиции химическими факторами.
Материалы и методы. Объектом исследований являлись система биомаркеров экспозиции (6 веществ) и негативных эффектов (8 показателей), обоснованная в ранее проведенных ФБУН «ФНЦ медико-профилактических технологий управления рисками здоровью населения» медико-биологических исследованиях (в 2021–2022 гг.) по изучению негативного комбинированного аэрогенного воздействия химических веществ на здоровье детей 4–7 лет из зоны экспозиции, сформированной деятельностью хозяйствующих субъектов металлургического профиля; классифицирующие критерии – пол, возраст, органы и системы-мишени, негативные эффекты.
Результаты. Дана детальная характеристика особенностей изменения биомаркеров экспозиции и негативных эффектов у детей с учетом пола и возраста. Обоснованы наиболее информативные возрастные периоды для исследования уровней маркеров экспозиции и эффектов у детей с заболеваниями органов дыхания и коморбидных им состояний, в том числе у мальчиков преимущественно в возрасте 4–5 лет, у девочек – в возрасте 6–7 лет. Установлены общие закономерности изменений уровней биомаркеров в ответ на хроническое аэрогенное воздействие химических факторов (повышение содержания химических веществ в биосредах, превышающих референтные значения; нарастание спектра, выраженности и распространенности изменений относительно физиологической нормы биохимических показателей; нарастание спектра самих негативных эффектов).
Выводы. Полученные результаты исследования могут служить критериальной основой выбора приоритетов для объективизации и повышения точности гигиенических оценок, повышения эффективности предиктивных технологий диагностики, прогнозирования и профилактики рисков здоровью чувствительных к химическому аэрогенному воздействию субпопуляций.
Ключевые слова
Для цитирования:
Землянова М.А., Кольдибекова Ю.В., Горяев Д.В., Пустовалова О.В. Половозрастные особенности биомаркеров экспозиции и негативных эффектов у детей с заболеваниями органов дыхания и коморбидных им состояний, ассоциированных с аэрогенной комбинированной экспозицией химическими факторами. Здоровье населения и среда обитания – ЗНиСО. 2023;31(3):43-51. https://doi.org/10.35627/2219-5238/2023-31-3-43-51
For citation:
Zemlyanova M.A., Koldibekova Yu.V., Goryaev D.V., Pustovalova O.V. Age- and Sex-Specific Features of Biomarkers of Exposure and Adverse Health Effects in Children with Respiratory Diseases and Comorbidities Associated with a Combined Exposure to Airborne Chemicals. Public Health and Life Environment – PH&LE. 2023;31(3):43-51. (In Russ.) https://doi.org/10.35627/2219-5238/2023-31-3-43-51
Введение. Согласно мнению экспертов Всемирной организации здравоохранения, основным инструментом при оценке нарушений состояния здоровья населения, связанных с воздействием химических факторов риска, является применение системы биомаркеров экспозиции и эффекта [1]. Биомаркером экспозиции может выступать количественное содержание экзогенного токсиканта или его метаболита в биологических образцах (например, кровь, моча), являющееся специфическим и позволяющее подтвердить факт экспозиции конкретного химического фактора на организм человека1[2–6]. Применение биомаркеров экспозиции в зонах влияния различных видов промышленных производств дает возможность выполнять приоритизацию химических веществ в зависимости от действующих факторов экспозиции [7] и выявлять группы повышенного риска [8][9]. Биомаркеры негативного эффекта отражают количественные изменения биохимических, физиологических или других параметров организма. С помощью маркеров эффекта на основе установленных причинно-следственных связей в системе «экспозиция – маркер экспозиции – маркер негативного эффекта – негативный ответ (заболевание)» оценивается действие факторов экспозиции на здоровье человека [2][8][10].
Повышение точности оценок экспозиционной химической нагрузки на население при комбинированном воздействии с помощью биомаркеров экспозиции и установление фактического нарушения здоровья на основе биомаркеров негативных эффектов в настоящее время является высокоактуальным для задач повышения эффективности мер, направленных на минимизацию негативных последствий в виде риск-реализованных заболеваний [11–13]. Для выявления субпопуляций, потенциально наиболее чувствительных к воздействию химической экспозиции, характеристики внутренних и внешних факторов, обуславливающих неоднородность профилей химического воздействия, целесообразно учитывать половозрастные особенности обследуемых лиц [14][15]. Исследование содержания химических веществ (металлов, ароматических углеводородов) у подверженного населения в ряде стран позволило выявить различия в экспозиционной нагрузке между возрастными группами [16]. Самая младшая возрастная группа имела значительно более низкую экспозицию, чем старшая, что свидетельствует об увеличении уровня биоаккумуляции химических веществ с возрастом. Это приводит к снижению гомеостатических резервов и систем организма, отвечающих за элиминацию токсикантов [16, 17]. Воздействие химических веществ зависеть от гендерных различий, обуславливающих особенности гомеостаза, например наличие жировых отложений, степень аккумулированных химических веществ в тканях, гормональный фон. Отличительные свойства оказывают влияние на скорость абсорбции, метаболизма, накопления и/или токсиканта [14][18]. Повышенная чувствительность отдельных субпопуляций обуславливает существенное влияние на степень подверженности экспозиционной нагрузки. Наиболее чувствительными к действию химических веществ являются новорожденные и дети, лица пожилого возраста, беременные и кормящие женщины1 [19][20]. Дети младшего возраста (4–7 лет), по сравнению с подростками и взрослыми, в силу анатомо-физиологических особенностей более чувствительны к действию токсикантов. Это обусловлено их повышенной частотой дыхания и скоростью желудочно-кишечной абсорбции, незрелостью системы детоксикационных ферментов и относительно меньшей скоростью экскреции токсикантов [21].
Вместе с тем в настоящее время практически отсутствуют научные данные о маркерах экспозиции и негативных эффектов у чувствительных контингентов, учитывающие определенные половые и возрастные различия при конкретных видах функциональных нарушений и заболеваний, ассоциированных с аэрогенной химической нагрузкой. Анализ материалов, представленных в источниках научной информации, позволил выявить в качестве первоочередной мишени токсического действия большинства химических веществ органы дыхания [10][22][23–25]. Подтверждением этого является повышенная до 3,0 раза распространенность заболеваний органов дыхания у детей, проживающих на территориях с высоким уровнем загрязнения атмосферного воздуха, относительно среднероссийских показателей2. В ряде исследований установлено, что развитие заболеваний органов дыхания в условиях аэрогенной химической экспозиции чаще сочетается с формированием коморбидных им состояний со стороны органов пищеварения [22][23]. Механизм патогенеза связан с усилением окислительной модификации белков эпителиальных клеток и последующим дисбалансом оксидантно-антиоксидантных процессов3 [26–28]. Развитие IgE-зависимых и запуск воспалительных реакций, инициированных окислительными процессами, сопровождается высвобождением медиаторов воспаления, что, в свою очередь, приводит к повреждению механизмов транспорта веществ через мембраны гепатоцитов и клеточных органелл с дальнейшим развитием активации цитолиза [29][30].
Система биомаркеров, обоснованная с учетом детальных половозрастных характеристик, может быть предложена в качестве практического информационно-аналитического инструмента для повышения эффективности научно-методического обеспечения деятельности специалистов службы Роспотребнадзора в части проведения гигиенических оценок и экспертиз при установлении причин и выявления условий возникновения и распространения риск-ассоциированных неинфекционных заболеваний; оценки эффективности медико-профилактических и других регулирующих мер4 [1].
Цель исследования – установление биомаркеров экспозиции и негативных эффектов с учетом пола и возраста у детей с заболеваниями органов дыхания и коморбидных им состояний в условиях аэрогенной комбинированной экспозиции химическими факторами.
Материалы и методы. Объектом исследований являлись обоснованная система биомаркеров экспозиции и негативных эффектов, классифицирующие критерии (пол, возраст, органы и системы-мишени, негативные эффекты), комбинированное аэрогенное воздействие химических веществ.
Анализ и систематизация маркеров экспозиции и негативных эффектов у детей с учетом пола и возраста выполнены на примере риск-реализованных заболеваний органов дыхания и коморбидных им состояний со стороны органов пищеварения, ассоциированных с аэрогенным воздействием химических факторов риска.
Для установления половозрастных особенностей биомаркеров экспозиции и негативных эффектов использовали информационную базу данных, содержащую индивидуальные результаты ранее (в 2021–2022 гг.) проведенных ФБУН «ФНЦ медико-профилактических технологий управления рисками здоровью населения» углубленных медико-биологических исследований детей 4–7 лет (164 человека)5 с доказанными риск-реализованными заболеваниями органов дыхания и коморбидных им состояний со стороны органов пищеварения в условиях аэрогенного комбинированного воздействия химических факторов. Информационная база5 содержала следующие индивидуальные параметры, систематизированные по дате: возраст, пол, вес; величина аэрогенной экспозиции изучаемых химических факторов; концентрация в крови и моче химических веществ, для которых установлена достоверная связь с химическими факторами экспозиции (маркеры экспозиции), значения биохимических и иммунологических показателей негативных эффектов, для которых установлена достоверная связь с маркерами экспозиции (маркеры негативных эффектов); диагнозы (по МКБ-10)6 заболеваний органов дыхания и коморбидных им состояний со стороны органов пищеварения, которые обоснованы как риск-реализованные на основе системы последовательных причинно-следственных связей «химический фактор экспозиции – маркер экспозиции – маркер негативного эффекта – заболевание».
В качестве биомаркеров экспозиции обосновано 6 веществ: в крови повышенные относительно референтных значений уровни марганца, никеля, о-ксилола, бенз(а)пирена, формальдегида; в моче – алюминия; биомаркерами негативных эффектов – 8 показателей: повышенный (относительно физиологической нормы) уровень эозинофилов, нейтрофилов в назальном секрете; повышенное содержание иммуноглобулина Е (IgE) общего, иммуноглобулина G (IgG) специфического к алюминию в сыворотке крови; повышенный уровень малонового диальдегида (МДА) в плазме крови, глутаматдегидрогеназы, аспартатаминотрансферазы (АСАТ) в сыворотке крови; сниженный уровень общей антиоксидантной активности (АОА) плазмы крови.
Классификационную дифференциацию маркеров экспозиции и негативных эффектов выполнили по показателям: пол (мальчики, девочки), возраст (4–5, 6–7 лет), органы и системы-мишени воздействия, риск-реализованные заболевания органов дыхания: хронический ринит (J31.0), хроническая болезнь миндалин и аденоидов (J35.9), астма с преобладанием аллергического компонента (J45.0), хронический тонзиллит (J35.0), аллергический ринит (J30.3), хронический синусит (J32.9); и коморбидные им состояния: диспепсия (K30), болезнь желчевыводящих путей (K83.8, K83.9).
Статистическую значимость различий переменных (р) между сравниваемыми половозрастными независимыми выборками определяли по U-критерию Манна – Уитни (U ≤ 988) при заданной значимости р ≤ 0,057. Статистическую обработку данных осуществляли с помощью пакета программ Statistica 10.
Результаты. Длительная аэрогенная комбинированная экспозиция одновременно оксидами марганца (в среднем 6,21 . 10–5 мг/(кг . день)), никеля (в среднем 2,0 . 10–4 мг/(кг . день)), алюминия (в среднем 7,0 . 10–4 мг/(кг . день)), бенз(а)пиреном (в среднем 6,7 . 10–6 мг/(кг . день)), формальдегидом (в среднем 1,9 . 10–2 мг/(кг . день)), о-ксилолом (в среднем 1,8 . 10–3 мг/(кг . день)) обуславливает в биосредах детей повышенные уровни маркеров экспозиции относительно референтных значений, различающиеся в зависимости от пола и возраста (табл. 1).
Анализ полученных результатов позволил установить, что у мальчиков 6–7 лет в крови идентифицированы бенз(а)пирен, о-ксилол, являющиеся истинными ксенобиотиками, повышенный в 1,4 раза уровень никеля. У мальчиков 4–5 и 6–7 лет в крови выявлен повышенный до 1,4 раза уровень марганца, до 3,4 раза уровень формальдегида, в моче – до 1,6 раза уровень алюминия. В крови девочек 4–5 и 6–7 лет идентифицированы бенз(а)пирен и о-ксилол, а также установлены повышенные до 1,5 раза уровни марганца, никеля и формальдегида.
Оценка содержания маркеров экспозиции в биосредах детей между разными возрастными группами позволила выявить ряд особенностей. У детей к 6–7 годам наблюдается повышение уровней химических веществ в биосредах с максимальным содержанием в крови у мальчиков марганца, никеля, бенз(а)пирена, о-ксилола (р = 0,0001–0,042), у девочек – никеля, бенз(а)пирена, формальдегида (р = 0,012–0,043). Обращает на себя внимание повышенный уровень в крови хрома и формальдегида, в моче алюминия у мальчиков 4–5 лет относительно 6–7 лет (р = 0,0001–0,010). Не меняется с возрастом у девочек содержание в крови марганца, о-ксилола, в моче алюминия.
Сравнительный анализ изменения содержания маркеров экспозиции в биосредах у мальчиков разного возраста относительно девочек и наоборот позволил установить, что у мальчиков 4–5 лет по сравнению с девочками выявлено повышенное в 1,8–4,0 раза содержание в крови хрома и формальдегида; в моче – алюминия и фторид-иона (р = 0,0002-0,005). У девочек 4–5 лет и 6–7 лет по сравнению с мальчиками установлено повышенное до 3,8 раза содержание в крови бенз(а)пирена (р = 0,0001–0,0003).
В целом у мальчиков установлены более низкие ориентировочные максимально недействующие концентрации в крови марганца и никеля в 4–5 лет, бенз(а)пирена в 6–7 лет по сравнению с девочками обеих возрастных групп. У девочек наблюдаются более низкие ориентировочные максимально недействующие концентрации в моче алюминия в 4–5 лет, в крови формальдегида и о-ксилола в 6–7 лет относительно мальчиков обеих возрастных групп.
Исследование и оценка уровней цитологических и биохимических показателей у детей в зависимости от пола и возраста позволил установить ряд особенностей, представленных в табл. 2.
Таблица 1. Уровни маркеров экспозиции у детей с риск-реализованными заболеваниями органов дыхания с учетом пола и возраста
Table 1. Age- and sex-specific levels of exposure markers in children with respiratory diseases related to airborne chemical exposure
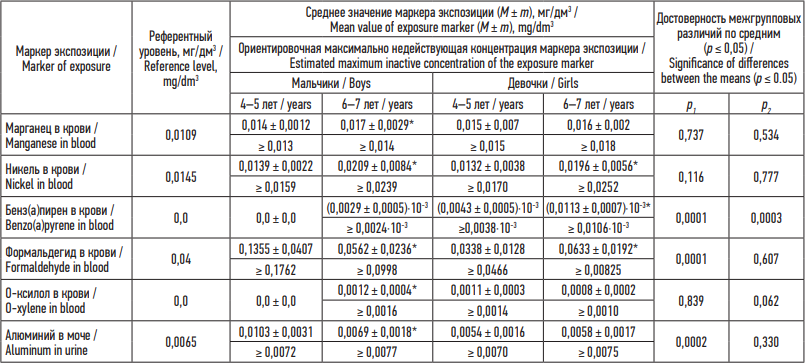
Примечание: * – достоверно различающиеся средние концентрации вещества у детей 6–7 лет относительно 4–5 лет; р1 – достоверность межгрупповых различий по средним между мальчиками и девочками 4–5 лет; р2 – достоверность межгрупповых различий по средним между мальчиками и девочками 6–7 лет.
Note: * – statistically different mean concentrations in children aged 4–5 and 6–7 years; p1 – statistical significance of differences between the means for boys and girls aged 4–5 years; p2 – for boys and girls aged 6–7 years.
Таблица 2. Биомаркеры негативных эффектов у детей с риск-реализованными заболеваниями органов дыхания и коморбидных им состояний с учетом пола и возраста
Table 2. Age and sex-specific biomarkers of adverse health effects in children with respiratory diseases and comorbidities related to airborne chemical exposure
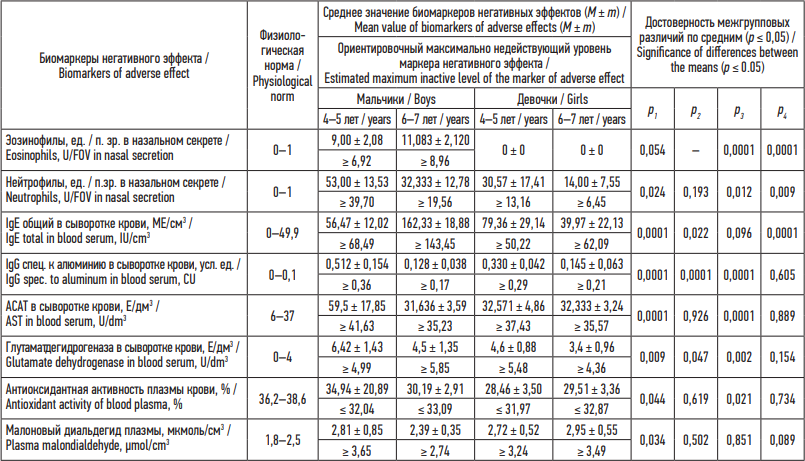
Примечание: р1 – достоверность межгрупповых различий по средним между мальчиками 4–5 и 6–7 лет; р2 – достоверность межгрупповых различий по средним между девочками 4–5 и 6–7 лет; р3 – достоверность межгрупповых различий по средним между мальчиками и девочками 4–5 лет; р4 – достоверность межгрупповых различий по средним между мальчиками и девочками 6–7 лет.
Notes: p1 – statistical significance of differences between the means for boys aged 4–5 and 6–7 years; p2 – for girls aged 4–5 and 6–7 years; p3 – for boys and girls aged 4–5 years; р4 – for boys and girls aged 6–7 years; FOV, field of view.
У мальчиков и девочек с возрастом нарастает спектр и степень выраженности измененных относительно физиологической нормы показателей и спектр самих негативных эффектов. У мальчиков в 4–5 лет развивается местная (повышенный в 1,6 раза уровень нейтрофилов в назальном секрете) и специфическая сенсибилизация (повышенный в 4,0 раза IgG специфический к алюминию в сыворотке крови), сопровождающаяся активацией цитолиза гепатоцитов (повышенные в 1,4–1,8 раза уровни глутаматдегидрогеназы и АСАТ в сыворотке крови) и усилением оксидантных процессов (повышенный в 1,2 раза уровень МДА плазмы крови). К 6–7 годам расширяется спектр показателей местной (повышенный в 1,5 раза уровень эозинофилов в назальном секрете) и общей сенсибилизации (повышенный в 2,8 раза уровень IgE общего в сыворотке крови) на фоне истощения антиоксидантной защиты (сниженное 1,2 раза содержание общей АОА плазмы крови). У девочек в 4–5 лет наблюдается общая (повышенное в 1,9 раза содержание IgE в сыворотке крови) и специфическая сенсибилизация (повышенный в 2,3 раза уровень IgG специфического к алюминию в сыворотке крови) с активацией цитолиза гепатоцитов (повышение в 1,4 раза глутаматдегидрогеназы в сыворотке крови).
Сравнительный анализ изменения уровней маркеров негативных эффектов в биосредах у мальчиков разного возраста относительно девочек позволил установить, что в 4–5 лет наблюдаются достоверно повышенные уровни эозинофилов, нейтрофилов в назальном секрете, IgG специфического к алюминию, глутаматдегидрогеназы и АСАТ в сыворотке крови (р = 0,0001–0,012); в 6–7 лет – повышенное содержание эозинофилов и нейтрофилов в назальном секрете, IgE общего в сыворотке крови (р = 0,0001–0,009). У девочек 4–5 лет относительно мальчиков выявлено лишь достоверное снижения общей АОА плазмы крови (р = 0,021).
В целом у мальчиков в 4–5 и в 6–7 лет установлены повышенные уровни эозинофилов в назальном секрете, не выявленные у девочек в данных возрастных категориях. У мальчиков 6–7 лет относительно девочек обеих возрастных групп установлены более низкие до 1,7 раза уровни IgG специфического к алюминию, АСАТ в сыворотке крови и МДА плазмы крови. У девочек по сравнению с мальчиками обеих возрастных групп установлены в 4–5 лет более низкие до 2,8 раза уровни IgE общего в сыворотке крови и антиоксидантной активности плазмы крови; в 6–7 лет – низкие до 6,2 раза уровни нейтрофилов в назальном секрете и глутаматдегидрогеназы в крови.
Обсуждение. Представленные результаты исследований показывают, что хроническое аэрогенное комбинированное воздействие оксидами марганца, никеля и алюминия, бенз(а)пиреном, формальдегидом и о-ксилолом обуславливает повышенные (до 3,4 раза) относительно референтных значений уровни маркеров экспозиции в биосредах экспонированных детей с градацией по полу и возрасту.
Сравнительный анализ результатов ориентировочных максимально недействующих концентраций маркеров экспозиции позволяет прогнозировать у детей более раннее развитие негативных эффектов со стороны органов дыхания в условиях экспозиции оксидами марганца и никеля у мальчиков и оксидом алюминия – у девочек 4–5 лет; бенз(а)пиреном – у мальчиков, формальдегидом и о-ксилолом – у девочек 6–7 лет.
Оценка уровней маркеров экспозиции у детей в зависимости от пола и возраста позволила установить наиболее информативные возрастные периоды для исследования содержания в биосредах химических веществ. У мальчиков таким возрастным периодом для исследования содержания в крови формальдегида и в моче алюминия является возраст 4–5 лет; для исследования уровней в крови марганца, никеля, бенз(а)пирена, о-ксилола – 6–7 лет. У девочек для оценки содержания в крови никеля, бенз(а)пирена, формальдегида является возраст 6–7 лет.
Установленные результаты сравнительной оценки уровней маркеров негативных эффектов позволяют прогнозировать в условиях химической аэрогенной экспозиции у мальчиков в 4–5 лет более раннее относительно девочек развитие местной сенсибилизации и формирование к 6–7 годам специфической сенсибилизации на фоне индукции системных окислительных процессов; у девочек в 4–5 лет относительно мальчиков – развитие общей сенсибилизации, сопровождающейся истощением антиоксидантной защиты, и усиление к 6–7 годам процесса цитолиза гепатоцитов.
В проведенном исследовании не исключается вероятность изменения изучаемых биохимических показателей, связанных с возможным влиянием иных химических факторов, образа жизни, не изученных в данной работе.
Установленные особенности системы биомаркеров экспозиции и негативных эффектов с учетом пола и возраста могут служить критериальной основой выбора приоритетов для объективизации и повышения точности гигиенических оценок, повышения эффективности предиктивных технологий диагностики, прогнозирования и реализации профилактики рисков здоровью чувствительных к химическому аэрогенному воздействию субпопуляций.
Выводы
1. Систематизация биомаркеров экспозиции и негативных эффектов по уровням детализации характеристик (пол, возраст, органы и системы-мишени) позволила обосновать наиболее информативные возрастные периоды для исследования содержания химических веществ в биосредах у детей с заболеваниями органов дыхания и коморбидных им состояний со стороны органов пищеварения.
2. Информативным возрастным периодом у мальчиков для исследования уровней в крови формальдегида и в моче алюминия является возраст 4–5 лет; для оценки содержания в крови марганца, никеля, бенз(а)пирена и о-ксилола – 6–7 лет.
3. Информативным возрастным периодом у девочек для исследования содержания в крови никеля, бенз(а)пирена, формальдегида является возраст 6–7 лет.
4. В условиях химической аэрогенной комбинированной экспозиции у мальчиков в 4–5 лет прогнозируется более раннее относительно девочек развитие местной сенсибилизации и формирование к 6–7 годам специфической сенсибилизации на фоне индукции системных окислительных процессов; у девочек в 4–5 лет относительно мальчиков – развитие общей сенсибилизации и истощение антиоксидантной защиты с усилением к 6–7 годам процесса цитолиза гепатоцитов.
5. Общими закономерностями изменения уровней маркеров экспозиции и негативных эффектов у детей (мальчиков и девочек) с возрастом (к 6–7 годам) в ответ на длительное хроническое аэрогенное воздействие химических факторов является повышение уровней химических веществ в биосредах относительно референтных значений, нарастание спектра, выраженности и распространенности изменений относительно физиологической нормы биомаркеров негативных эффектов (развитие местной, общей и специфической сенсибилизации), нарастание спектра негативных эффектов (усиление активности цитолиза гепатоцитов, индукция окислительных процессов, истощение общей антиоксидантной активности).
1. Р 2.1.10.1920–04 «Руководство по оценке риска для здоровья населения при воздействии химических веществ, загрязняющих окружающую среду». М.: Федеральный центр госсанэпиднадзора Минздрава России, 2004. 143 с.
2. О состоянии санитарно-эпидемиологического благополучия населения в Российской Федерации: Государственный доклад. М.: Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека. [Электронный ресурс] Режим доступа: https://www.rospotrebnadzor.ru/documents/details.php?ELEMENT_ID=21796 (дата обращения: 16.02.2022).
3. Куценко С.А. Основы токсикологии. СПб.: Военно-медицинская академия им. С.М. Кирова, 2002. 395 с.
4. Постановление Правительства Российской Федерации от 30.06.2004 № 322 «Положение о Федеральной службе по надзору в сфере защиты прав потребителей и благополучия человека» (в ред. Постановления Правительства Российской Федерации от 21.05.2013 № 428).
5. База данных «Результаты лабораторных исследований биосред детского населения («Лаборатория»). Свидетельство о государственной регистрации базы данных № 2010620501 от 19.07.2010 года. (Правообладатель ФБУН «Федеральный научный центр медико-профилактических технологий управления рисками здоровью населения» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека).
6. МКБ-10 – Международная классификация болезней 10-го пересмотра [Электронный ресурс] Режим доступа: http://epid-atlas.nniiem.ru/a01_data_main.html (дата обращения: 22.12.2022).– URL: https://mkb-10.com/ (по состоянию на 14.03.2023 г.).
7. Гланц С. Медико-биологическая статистика. М.: Практика, 1998. 459 с.
Список литературы
1. Биомониторинг человека: факты и цифры. Копенгаген: Европейское региональное бюро ВОЗ, 2015. Доступно по: https://apps.who.int/iris/bitstream/handle/10665/164589/WHO-EURO-2015-3209-42967-60041-rus.pdf?sequence=3&isAllowed=y. Ссылка активна на 13.02.2023.
2. Чуйко Г.М., Томилина И.И., Холмогорова Н.В. Методы биодиагностики в водной экотоксикологии // Токсикологический вестник. 2022. № 5. С. 315–322. doi:10.47470/0869-7922-2022-30-5-315-322
3. Pollock T, Karthikeyan S, Walker M, Werry K, St-Amand A. Trends in environmental chemical concentrations in the Canadian population: Biomonitoring data from the Canadian Health Measures Survey 2007–2017. Environ Int. 2021;155:106678. doi: 10.1016/j.envint.2021.106678
4. Valcke M, Karthikeyan S, Walker M, Gagné M, Copes R, St-Amand A. Regional variations in human chemical exposures in Canada: A case study using biomonitoring data from the Canadian Health Measures Survey for the provinces of Quebec and Ontario. Int J Hyg Environ Health. 2020;225:113451. doi: 10.1016/j.ijheh.2020.113451
5. Chao YS, Wu CJ, Wu HC, et al. Opportunities and challenges from leading trends in a biomonitoring project: Canadian Health Measures Survey 2007–2017. Front Public Health. 2020;8:460. doi: 10.3389/fpubh.2020.00460
6. Faure S, Noisel N, Werry K, Karthikeyan S, Aylward LL, St-Amand A. Evaluation of human biomonitoring data in a health risk based context: An updated analysis of population level data from the Canadian Health Measures Survey. Int J Hyg Environ Health. 2020;223(1):267–280. doi: 10.1016/j.ijheh.2019.07.009
7. Biomonitoring-based indicators of exposure to chemical pollutants. Report of a meeting, Catania, Italy, April 19–20, 2012. WHO Regional Office for Europe; 2012. Accessed February 15, 2023. https://www.who.int/publications/m/item/biomonitoring-based-indicators-of-exposure-to-chemical-pollutants
8. Зайцева Н.В., Землянова М.А., Чащин В.П., Гудков А.Б. Научные принципы применения биомаркеров в медикоэкологических исследованиях (обзор литературы) // Экология человека. 2019. № 9. С. 4–14. doi: 10.33396/1728-0869-2019-9-4-14
9. Nguyen VK, Colacino J, Patel CJ, Sartor M, Jolliet O. Identification of occupations susceptible to high exposure and risk associated with multiple toxicants in an observational study: National Health and Nutrition Examination Survey 1999–2014. Exposome. 2022;2(1):osac004. doi: 10.1093/exposome/osac004
10. Зайцева Н.В., Онищенко Г.Г., Май И.В., Шур П.З. Развитие методологии анализа риска здоровью в задачах государственного управления санитарно-эпидемиологическим благополучием населения // Анализ риска здоровью. 2022. № 3. С. 4–20. doi: 10.21668/health.risk/2022.3.01
11. Онищенко Г.Г. Оценка и управление рисками для здоровья как эффективный инструмент решения задач обеспечения санитарно-эпидемиологического благополучия населения Российской Федерации // Анализ риска здоровью. 2013. С. 4–11.
12. Suk WA. Invited perspective: Integrating data reveals benefits of remediation for children’s exposure to hazardous substances. Environ Health Perspect. 2022;130(3):31301. doi: 10.1289/ehp10594
13. Heacock ML, Amolegbe SM, Skalla LA, et al. Sharing SRP data to reduce environmentally associated disease and promote transdisciplinary research. Rev Environ Health. 2020;35(2):111–122. doi: 10.1515/reveh-2019-0089
14. Willey JB, Pollock T, Thomson EM, et al. Exposure load: Using biomonitoring data to quantify multi-chemical exposure burden in a population. Int J Hyg Environ Health. 2021;234:113704. doi: 10.1016/j.ijheh.2021.113704
15. Холматова К.К., Харькова О.А., Гржибовский А.М. Особенности применения когортных исследований в медицине и общественном здравоохранении // Экология человека. 2016. № 4. С. 56–64.
16. Bushnik T, Wong SL, Holloway AC, Thomson EM. Association of urinary polycyclic aromatic hydrocarbons and obesity in children aged 3–18: Canadian Health Measures Survey 2009–2015. J Dev Orig Health Dis. 2020;11(6):623–631. doi: 10.1017/S2040174419000825
17. Choi J, Knudsen LE, Mizrak S, Joas A. Identification of exposure to environmental chemicals in children and older adults using human biomonitoring data sorted by age: Results from a literature review. Int J Hyg Environ Health. 2017;220(2 Pt A):282–298. doi: 10.1016/j.ijheh.2016.12.006
18. Shin HH, Maquiling A, Thomson EM, Park IW, Stieb DM, Dehghani P. Sex-difference in air pollution-related acute circulatory and respiratory mortality and hospitalization. Sci Total Environ. 2022;806 (Pt 3):150515. doi: 10.1016/j.scitotenv.2021.150515
19. Arbuckle TE, Fraser WD, Fisher M, et al. Cohort profile: the maternal-infant research on environmental chemicals research platform. Paediatr Perinat Epidemiol. 2013;27(4):415–425. doi: 10.1111/ppe.12061
20. Matus PC, Oyarzún MG. Impact of particulate matter (PM 2,5) and children’s hospitalizations for respiratory diseases. A case cross-over study. Rev Chil Pediatr. 2019;90(2):166-174. (In Spanish.) doi: 10.32641/rchped.v90i2.750
21. Landrigan PJ, Goldman LR. Children’s vulnerability to toxic chemicals: a challenge and opportunity to strengthen health and environmental policy. Health Aff (Millwood). 2011;30(5):842–850. doi: 10.1377/hlthaff.2011.0151
22. Маклакова О.А., Зайцева Н.В., Кирьянов Д.А. Методические аспекты оценки риска развития коморбидной патологии в условиях воздействия химических факторов окружающей среды // Анализ риска здоровью. 2020. № 4. С. 54–61. doi: 10.21668/health.risk/2020.4.06
23. Землянова М.А., Зайцева Н.В., Кольдибекова Ю.В., Устинова О.Ю., Кобякова О.А. Обоснование ассоциативных связей показателей негативных эффектов со стороны органов дыхания, системы крови и иммунной системы у детей с повышенным содержанием меди, никеля и хрома в крови // Гигиена и санитария. 2022. № 101 (11). С. 1347–1353. doi: 10.47470/0016-9900-2022-101-11-1347-1353
24. Zeng X, Xu X, Qin Q, Ye K, Wu W, Huo X. Heavy metal exposure has adverse effects on the growth and development of preschool children. Environ Geochem Health. 2019;41(1):309–321. doi: 10.1007/s10653-018-0114-z
25. Ланин Д.В., Зайцева Н.В., Долгих О.В., Дианова Д.Г. Характеристика регуляторных систем у детей при воздействии химических факторов среды обитания // Гигиена и санитария. 2014. № 2. С. 23–26.
26. Челомбитько М.А. Роль активных форм кислорода в воспалении. Мини-обзор // Вестник Московского Университета. Серия 16 биология. 2018. Т. 73. № 4. С. 242–246.
27. Sies H, Berndt C, Jones DP. Oxidative stress. Annu Rev Biochem. 2017;86:715–748. doi: 10.1146/annurev-biochem-061516-045037
28. Moldogazieva NT, Mokhosoev IM, Feldman NB, Lutsenko SV. ROS and RNS signalling: adaptive redox switches through oxidative/nitrosative protein modifications. Free Radic Res. 2018;52(5):507–543. doi: 10.1080/10715762.2018.1457217
29. Зайцева Н.В., Землянова М.А., Лужецкий К.П., Клейн С.В. Обоснование биомаркеров экспозиции и эффекта в системе доказательства причинения вреда здоровью при выявлении неприемлемого риска обусловленного факторами среды обитания // Вестник Пермского Университет. Серия биология. 2016. Т. 4. С. 374–378.
30. Маклакова О.А. Оценка риска развития заболеваний органов дыхания и коморбидной патологии у детей в условиях загрязнения атмосферного воздуха химическими веществами техногенного происхождения (когортное исследование) // Анализ риска здоровью. 2019. № 2. С. 56–63. doi: 10.21668/health.risk/2019.2.06
Об авторах
М. А. ЗемляноваРоссия
Землянова Марина Александровна, д.м.н., профессор, главный научный сотрудник, заведующая отделом биохимических и цитогенетических методов диагностики
ул. Монастырская, д. 82, г. Пермь, 614045
Ю. В. Кольдибекова
Россия
Кольдибекова Юлия Вячеславовна, к.б.н., старший научный сотрудник, заведующая лабораторией исследования метаболизма и фармакокинетики отдела биохимических и цитогенетических методов диагностики
ул. Монастырская, д. 82, г. Пермь, 614045
Д. В. Горяев
Россия
Горяев Дмитрий Владимирович, к.м.н., руководитель
ул. Каратанова, д. 21, г. Красноярск, 660049
О. В. Пустовалова
Россия
Пустовалова Ольга Васильевна, старший научный сотрудник, заведующая лабораторией биохимической и наносенсорной диагностики отдела биохимических и цитогенетических методов диагностики
ул. Монастырская, д. 82, г. Пермь, 614045
Рецензия
Для цитирования:
Землянова М.А., Кольдибекова Ю.В., Горяев Д.В., Пустовалова О.В. Половозрастные особенности биомаркеров экспозиции и негативных эффектов у детей с заболеваниями органов дыхания и коморбидных им состояний, ассоциированных с аэрогенной комбинированной экспозицией химическими факторами. Здоровье населения и среда обитания – ЗНиСО. 2023;31(3):43-51. https://doi.org/10.35627/2219-5238/2023-31-3-43-51
For citation:
Zemlyanova M.A., Koldibekova Yu.V., Goryaev D.V., Pustovalova O.V. Age- and Sex-Specific Features of Biomarkers of Exposure and Adverse Health Effects in Children with Respiratory Diseases and Comorbidities Associated with a Combined Exposure to Airborne Chemicals. Public Health and Life Environment – PH&LE. 2023;31(3):43-51. (In Russ.) https://doi.org/10.35627/2219-5238/2023-31-3-43-51









.png)



























