Перейти к:
Этиологическая структура патогенных лептоспир в природных очагах Прибайкалья
https://doi.org/10.35627/2219-5238/2023-31-3-72-78
Аннотация
Введение. Изучение функционирования природных очагов лептоспирозной инфекции, анализ структуры возбудителей и видового состава животных-носителей – важные части оценки текущей эпизоотической ситуации в природных очагах, необходимые для планирования и организации противоэпидемических мероприятий, включая специфическую профилактику инфекции.
Цель исследования: изучить серогрупповую принадлежность патогенных лептоспир в природных очагах в Прибайкалье.
Материалы и методы. С 2011 по 2021 год проводили зоологические обследования территорий Иркутской области в границах 10 административных районов. Мелких млекопитающих отлавливали в природных стациях в соответствии с методическими документами Роспотребнадзора. Всего было добыто 1255 мелких млекопитающих 36 видов, относящихся к 5 отрядам: грызуны (Rodentia) (74,2 % от всех исследованных особей), насекомоядные (Eulipotyphla) (24,7 %), зайцеобразные (Lagomorpha) (0,6 %), хищники (Carnivora) (0,4 %) и рукокрылые (Chiroptera) (0,2 %). Материал от животных исследован бактериологическим, микроскопическим и серологическим методами.
Результаты. Получено 2,3 % позитивных проб от всех исследованных животных. Основные носители возбу-дителей инфекции в Прибайкалье – представители отряда насекомоядных: тундряная бурозубка (Sorex tundrensis Merriam, 1900) и грызунов: полевка-экономка (Alexandromys oeconomus Pallas, 1776), водяная полевка (Arvicola amphibius Linnaeus, 1758), длиннохвостый суслик (Urocitellus undulatus Pallas, 1779), ондатра (Ondatra zibethicus Linnaeus, 1766), узкочерепная полевка (Lasiopodomys gregalis Pallas, 1779). Определены серогруппы выявленных лептоспир: Icterohaemorrhagiae, Grippotyphosa, Javanica, Australis, Pomona, Sejroe, Autumnalis, титры антител варьировали от 1:20 до 1:640.
Заключение. В Прибайкалье природные очаги лептоспирозной инфекции имеют широкое распространение. В сравнении с результатами исследований прошлого столетия – относительное количество серопозитивных животных незначительно увеличилось, серопейзаж возбудителей претерпел изменения.
Ключевые слова
Для цитирования:
Киселева Е.Ю., Корзун В.М., Бренёва Н.В., Борисов С.А., Тимошенко А.Ф., Шаракшанов М.Б., Будаева С.Е., Балахонов С.В. Этиологическая структура патогенных лептоспир в природных очагах Прибайкалья. Здоровье населения и среда обитания – ЗНиСО. 2023;31(3):72-78. https://doi.org/10.35627/2219-5238/2023-31-3-72-78
For citation:
Kiseleva E.Yu., Korzun V.M., Breneva N.V., Borisov S.A., Timoshenko A.F., Sharakshanov M.B., Budaeva S.E., Balakhonov S.V. Etiological Structure of Leptospira interrogans in Natural Foci of the Baikal Region. Public Health and Life Environment – PH&LE. 2023;31(3):72-78. (In Russ.) https://doi.org/10.35627/2219-5238/2023-31-3-72-78
Введение. Природные очаги лептоспирозов разной степени эпидемической опасности широко распространены во всем мире; случаи заражения людей зарегистрированы в Европе, Азии, Америке, Африке, Австралии [1–9].
Природный очаг лептоспирозной инфекции – это сложный биоценотический комплекс, включающий популяции возбудителя болезни и резервуарных хозяев, например позвоночных животных. Этиологическим агентом при лептоспирозах служат патогенные бактерии рода Leptospira, который включает более 300 сероваров. Носителями патогенных лептоспир являются дикие млекопитающие из различных отрядов и семейств. Наибольшее значение имеют сумчатые, насекомоядные и грызуны [10–14]. По мнению Н.П. Свешниковой1 , с сумчатыми напрямую связана эволюция возбудителя, поскольку это древний отряд низшего подкласса млекопитающих, а его представители являются резервуарами многих сероваров. Считают, что становление паразитических форм лептоспир произошло в тропической части Восточного полушария, отсюда с сумчатыми они распространились по всему свету1. Фауна Прибайкалья включает 10 видов насекомоядных и 32 грызунов [15], многие из которых активно вовлекаются в эпизоотический процесс при лептоспирозах.
Установлено, что лептоспиры одной и той же серогруппы встречаются у разных животных, кроме этого, один зверек может быть носителем различных серогрупп лептоспир. Вместе с тем имеются убедительные данные о наличии связей тех или иных серогрупп лептоспир с определенными видами животных, в частности, лептоспиры Grippotyphosa чаще обнаруживаются у серых полевок, Pomona – полевой мыши, Bataviae – мыши-малютки, Javanica – бурозубок. Основными хозяевами лептоспир серогруппы Icterohaemorrhagiae считают серых крыс, однако они могут быть резервуарами и других серовариантов возбудителей: Canicola, Pomona, Bataviae. Восприимчивость животных к лептоспирам неодинакова, в связи с этим роль представителей животного мира в сохранении и распространении лептоспирозной инфекции неравноценна [10–12].
Одним из основных факторов, обеспечивающих устойчивость паразитарной системы, является способность замещать одного хозяина другим или изменять видовой состав носителей инфекции. Таким трансформациям подвержен в том числе и эпизоотический процесс при лептоспирозах [10].
Выявление «преобладающего» сероварианта среди возбудителей и основного носителя инфекции, оценка оперативной эпизоотической ситуации на территории необходимы для планирования противоэпидемических мероприятий, в том числе специфической профилактики инфекции [16–19].
Цель исследования: изучить серогрупповую принадлежность патогенных лептоспир в природных очагах в Прибайкалье.
Материалы и методы. В период с 2011 по 2021 г. было проведено эпизоотологическое обследование некоторых территорий Прибайкалья в границах десяти административных районов Иркутской области (Жигаловский, Заларинский, Зиминский, Иркутский, Нижнеудинский, Нукутский, Ольхонский, Тулунский, Усть-Илимский, Эхирит-Булагатский) и в г. Иркутске. Для добычи мелких млекопитающих использовали давилки Геро, живоловки, капканы и конуса на ловчих канавках; полевые работы проводили в соответствии с методическими документами Роспотребнадзора 2 3. Рукокрылых отлавливали общепринятыми методами4.
Видовую принадлежность животных определяли общепринятыми методами [20–23] в соответствии с современной классификацией по А.А. Лисовскому и соавт. [24]. Всего было изучено 1255 особей мелких млекопитающих 36 видов.
Лабораторные исследования осуществляли бактериологическим (посев на жидкие питательные среды), микроскопическим (микроскопия в темном поле), серологическим (реакция микроагглютинации – РМА) методами. Бактериологические посевы делали из почек зверьков, отловленных живыми, поскольку это повышает вероятность изоляции возбудителя [10]. Для проведения анализа у животных брали фильтр-отпечаток крови из сердца (для РМА) и почку (для микроскопии и посева). В качестве антигена в серологическом исследовании применяли линейку эталонных штаммов лептоспир (7–10-дневные культуры)5 [10].
Посев коркового вещества почки на жидкие питательные среды Ферворта – Вольфа и Элленгаузена – МакКалоха в модификации Джонсона – Харриса – EMJH (Becton Dickinson, США) проводили сразу после вскрытия животного, всего – 461 пробирка. Препараты почек животных просматривали в «темнопольный» микроскоп на 7, 14, 21-е сутки инкубации при 28 °С. Принадлежность выделенных штаммов к серогруппам определяли в РМА, используя «Набор сывороток групповых агглютинирующих лептоспирозных» («Армавирская биофабрика», г. Армавир).
Статистическая обработка полученных результатов проведена стандартными методами вариационной статистики6 с использованием лицензионного программного обеспечения Statistica 10.0 MS Excel.
Результаты. Отлов животных осуществляли преимущественно на увлажненных участках местности. Население мелких млекопитающих на обследованной территории разнообразно. Добыты животные 36 видов, от общего числа отловленных зверьков грызуны составили 74,2 %, насекомоядные – 24,7 %, зайцеобразные – 0,6 %, хищники – 0,4 %, рукокрылые – 0,2 %. В отловах преобладала полевка-экономка (Alexandromys oeconomus Pallas, 1776) – 23,3 % от всех добытых особей.
Специфические антитела к возбудителям лептоспирозов обнаружены в 29 из 1255 проб, что составило 2,3 ± 0,42 %. Положительные пробы выявлены при исследовании материала от 14 видов: от полевки-экономки (Alexandromys oeconomus Pallas, 1776) в девяти пробах, от длиннохвостого суслика (Urocitellus undulatus Pallas, 1779) – в трех, от ондатры (Ondatra zibethicus Linnaeus, 1766) – в трех, от тундряной бурозубки (Sorex tundrensis Merriam,1900) – в двух, от водяной полевки (Arvicola amphibius Linnaeus, 1758) – в двух, от узкочерепной полевки (Lasiopodomys gregalis Pallas, 1779) – в двух, по одной положительной пробе от крупнозубой бурозубки (Sorex daphaenodon Thomas, 1907), малой бурозубки (Sorex minutus Linnaeus, 1766), белки обыкновенной (Sciurus vulgaris Linnaeus, 1758), лесной мышовки (Sicista betulina Pallas, 1779), красносерой полевки (Craseomys rufocanus Sundevall, 1846), красной полевки (Myodes rutilus Pallas, 1779), восточноазиатской мыши (Apodemus peninsulae Thomas, 1907) и домовой мыши (Mus musculus Linnaeus, 1758).
В РМА определены агглютинины к патогенным лептоспирам семи серогрупп: Icterohaemorrhagiae, Grippotyphosa, Javanica, Pomona, Australis, Sejroe, Autumnalis (табл. 1). При этом три первые серогруппы встречаются существенно чаще. Титры антител у обследованных животных варьировали от 1 : 20 до 1 : 640. В одном случае при исследовании пробы от малой бурозубки (Sorex minutus Linnaeus, 1766) были выявлены антитела одновременно к четырем различным сероварам лептоспир (Icterohaemorrhagiae, Javanica, Grippotyphosa, Autumnalis), что свидетельствует о возможности одновременной циркуляции в организме зверька возбудителей нескольких сероваров.
В табл. 2 отражены серогруппы патогенных лептоспир, выявленные в РМА среди определенных видов зверьков. Полученные данные показывают, что в циркуляцию серогрупп Icterohaemorrhagiae, Grippotyphosa, Javanica вовлечен широкий круг носителей. При этом Icterohaemorrhagiae обнаруживается чаще всего у длиннохвостого суслика (Urocitellus undulatus Pallas, 1779), Grippotyphosa – у полевки-экономки (Alexandromys oeconomus Pallas, 1776). По серогруппам Australis, Pomona, Sejroe, Autumnalis имеются только единичные находки. Среди представителей отрядов хищников и рукокрылых серопозитивных проб не выявлено.
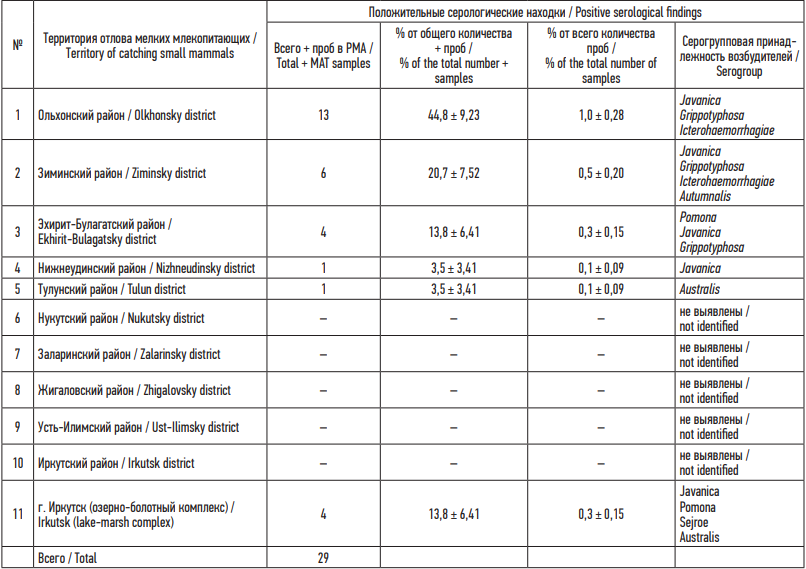
Наибольшее количество положительных результатов было получено от животных, отловленных в границах Ольхонского района – 44,8 ± 9,23 % от общего числа положительных проб, из Зиминского района – 20,7 ± 7,52 %, из Эхирит-Булагатского района – 13,8 ± 6,41 %, из Нижнеудинского и Тулунского районов – по 3,5 ± 3,41 %. Большой процент положительных проб в Ольхонском районе вероятно связан с климатогеографическими характеристиками обследованной территории. Этиологическая структура возбудителей лептоспирозов, циркулирующих в природных очагах, расположенных на территории Ольхонского района, представлена серогруппами Javanica, Grippotyphosa и Icterohaemorrhagiae; в Зиминском – Javanica, Grippotyphosa, Icterohaemorrhagiae и Autumnalis; в Эхирит-Булагатском – Pomona, Javanica и Grippotyphosa; в Нижнеудинском – Javanica; в Тулунском – Australis; в г. Иркутске – Javanica, Pomona, Sejroe и Australis. В Нукутском, Заларинском, Жигаловском, Усть-Илимском и Иркутском районах серопозитивных проб не выявлено (табл. 3).
Неопровержимым доказательством циркуляции возбудителей лептоспирозов в природе является изоляция культур патогенных лептоспир от диких мелких млекопитающих. При бактериологическом посеве на жидкие питательные среды материала от зверьков (кусочек почечной ткани) были выделены три штамма микроорганизмов рода Leptospira – из них два (4-I, 5-I) от бурозубки тундряной (Sorex tundrensis Merriam,1900) и один (108-I) от водяной полевки (Arvicola amphibius Linnaeus, 1758). Эти животные были отловлены в черте г. Иркутска на территории озерно-болотного комплекса. Принадлежность изолированных культур к серогруппе Javanica определили в РМА с коммерческими антисыворотками (титр реакции штаммов: 4-I – 1 : 8000, 5-I – 1 : 4000, 108-I – 1 : 25000).
Таблица 1. Этиологическая структура патогенных лептоспир, циркулирующих среди мелких млекопитающих Прибайкалья по результатам РМА
Table 1. Etiological structure of Leptospira interrogans circulating among small mammals of the Baikal Region according to microscopic agglutination test (MAT) results
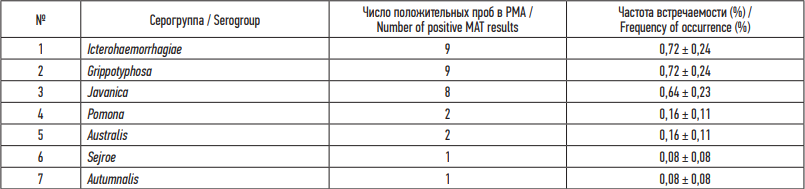
Таблица 2. Носители патогенных лептоспир среди мелких млекопитающих Прибайкалья
Table 2. Carriers of Leptospira interrogans among small mammals of the Baikal Region
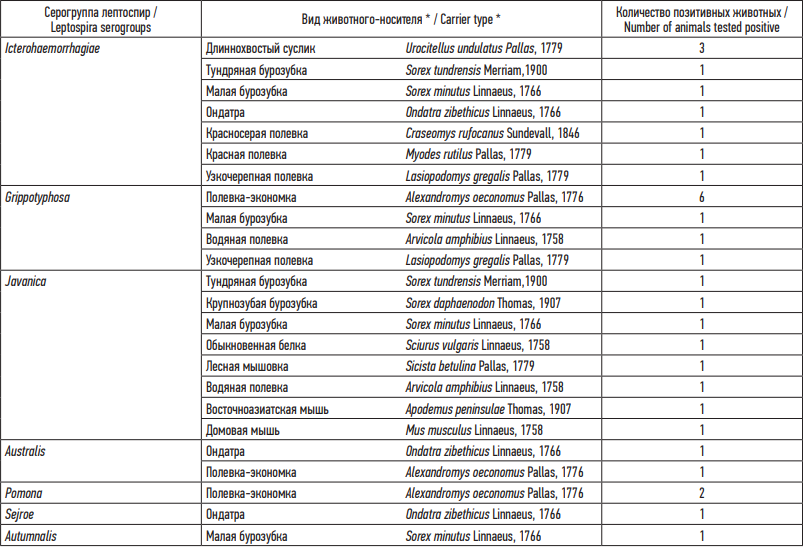
Примечание:* – видовая принадлежность животных приведена по А.А. Лисовскому и соавт. (2019) [24].
Note: * The species of animals are given according to Lisovsky et al. (2019) [24].
Таблица 3. Серологические находки по административным районам Иркутской области
Table 3. Serological findings by administrative districts of the Irkutsk Region
Обсуждение. Считаем интересным сравнить полученные результаты с исследованиями данной территории, выполненными в прошлом столетии. Г.А. Некипелова с коллегами проводила обследование Прибайкалья с 1968 по 1972 год7. Было отловлено 1026 мелких млекопитающих 12 видов. Бактериологическим методом выделили четыре штамма патогенных лептоспир, серологическим методом установили семь видов мелких млекопитающих Прибайкалья, участвующих в циркуляции патогенных лептоспир в тот временной период. У четырех видов животных-носителей: полевка-экономка (Alexandromys oeconomus Pallas, 1776), узкочерепная полевка (Lasiopodomys gregalis Pallas, 1779), домовая мышь (Mus musculus Linnaeus, 1758), длиннохвостый суслик (Urocitellus undulatus Pallas, 1779) антитела обнаружены и в ходе наших исследований.
Видовой состав обследованных нами мелких млекопитающих включал 36 таксонов против 12 таковых в работе Г.А. Некипеловой и соавт.7 На наш взгляд, количественное преимущество позволило выявить вдвое больше видов животных-носителей, вовлекающихся в циркуляции патогенных лептоспир в Прибайкалье.
На основании серологических исследований доля инфицированности мелких млекопитающих в 1968–1972 гг. составляла 1,9 %, что незначительно отличается от показателя, полученного в наших исследованиях, – 2,3 ± 0,42 %. Кроме того, в пробах от диких животных в 1970-е годы были обнаружены антитела к лептоспирам пяти серогрупп (Pomona, Hebdomadis, Tarassovi и реже Icterohaemorrhagiae, Grippotyphosa). По результатам наших исследований с высокой долей вероятности можно говорить об изменении серопейзажа возбудителей лептоспирозов в природных очагах – в настоящее время он представлен патогенными лептоспирами семи серогрупп: Icterohaemorrhagiae, Javanica, Grippotyphosa и реже Australis, Pomona, Sejroe, Autumnalis.
Заключение. На основании результатов проведенных исследований проанализирована текущая эпизоотическая ситуация по лептоспирозам в Прибайкалье. Установлено, что природные очаги этой инфекции широко распространены в регионе. Выявлены виды мелких млекопитающих, вовлеченных в эпизоотический процесс. По сравнению с данными 60–70-х годов прошлого века относительное количество животных, имеющих антитела к патогенным лептоспирам, незначительно увеличилось, при этом этиологическая структура возбудителей изменилась.
1. Свешникова Н.П. О палеогенезе лептоспирозов // Зоологический журнал. 1971. Т. 50. Вып. 9.
2. МР 3.1.0211–20 «Отлов, учет и прогноз численности мелких млекопитающих и птиц в природных очагах инфекционных болезней». Москва, 2020. 44 с.
3. МР 3.1.7.0250–21 «Тактика и объемы зоологических работ в природных очагах инфекционных болезней». Москва, 2021. 15 с.
4. Методические рекомендации по лабораторным и полевым исследованиям арбовирусов. Утверждены заместителем Министра здравоохранения СССР П.Н. Бургасовым № 1186-74 от 27.09.1974. Москва, 1975. 88 с.
5. Ананьин В.В. Лептоспирозы людей и животных. М.: Медицина, 1971.
6. Закс Л. Статистическое оценивание. Москва: Статистика, 1976.
7. Некипелова Г.А. Лептоспирозы в южной части Восточной Сибири. Вопросы инфекционной патологии // Тезисы докладов итоговой научной конференции Иркутского НИИЭМ. Иркутск, 1972. № 2. С. 228–232.
Список литературы
1. Ананьина Ю.В. Лептоспирозы людей и животных: тенденции распространения и проблемы профилактики // Эпидемиология и вакцинопрофилактика. 2010. № 2. С. 13–16.
2. Adler B, de la Peña Moctezuma A. Leptospira and leptospirosis. Vet Microbiol. 2010;140(3-4):287-296. doi: 10.1016/j.vetmic.2009.03.012
3. Asante J, Noreddin A, El Zowalaty ME. Systematic review of important bacterial zoonoses in Africa in the last decade in light of the 'One health' concept. Pathogens. 2019;8(2):50. doi: 10.3390/pathogens8020050
4. Delmas B, Jabot J, Chanarielle P, et al. Leptospirosis in ICU: A retrospective study of 134 consecutive admissions. Crit Care Med. 2018;46(1):93-99. doi: 10.1097/CCM.0000000000002825
5. Dhewantara PW, Mamun AA, Zhang WY, et al. Epidemiological shift and geographical heterogeneity in the burden of leptospirosis in China. Infect Dis Poverty. 2018;7(1):57. doi: 10.1186/s40249-018-0435-2
6. Epelboin L, Bourhy P, Le Turnier P, et al. [Leptospirosis in French Guiana and the Guiana shield: Current knowledge in 2016]. Bull Soc Pathol Exot. 2017;110(3):165-179. (In French.) doi: 10.1007/s13149-017-0559-9
7. Ludwig B, Zotzmann V, Bode C, Staudacher DL, Zschiedrich S. Lethal pulmonary hemorrhage syndrome due to Leptospira infection transmitted by pet rat. IDCases. 2017;8:84-86. doi: 10.1016/j.idcr.2017.04.016
8. Li JM, Li LM, Shi JF, et al. Prevalence of Leptospira in murine in China: A systematic review and meta-analysis. Front Vet Sci. 2022;9:944282. doi: 10.3389/fvets.2022.944282
9. Žele-Vengušt D, Lindtner-Knific R, Mlakar-Hrženjak N, Jerina K, Vengušt G. Exposure of free-ranging wild animals to zoonotic Leptospira interrogans Sensu Stricto in Slovenia. Animals (Basel). 2021;11(9):2722. doi: 10.3390/ani11092722
10. Бренева Н.В. Балахонов С.В. Вопросы эндемичности и энзоотичности лептоспирозов // Журнал микробиологии, эпидемиологии и иммунобиологии. 2019. № 5. С. 118-125. doi: 10.36233/0372-9311-2019-5-118-125. EDN NTRRNB.
11. Городин В.Н., Мойсова Д.Л., Бахтина В.А., Зотов С.В. Тренды современного лептоспироза // Эпидемиология и инфекционные болезни. 2018. Т. 23. № 2. С. 93–100. doi: 10.18821/1560-9529-2018-23-2-93-100. EDN XTSOTJ.
12. Дмитриев П.П. Избранные главы медицинской зоологии. Позвоночные животные в природных очагах болезней человека: От чумы до COVID-19. 2-е изд., испр. и доп. Москва : ЛЕНАНД, 2021. 196 с.
13. Киселева Е.Ю., Корзун В.М., Борисов С.А. и др. Современная эпизоотологическая ситуация по лептоспирозам в Прибайкалье // Acta Biomedica Scientifica (East Siberian Biomedical Journal). 2021. Т. 6. № 5. С. 57–67. doi: 10.29413/ABS.2021-6.5.6. EDN DJKRVU.
14. Соболева Г.Л., Ананьина Ю.В., Непоклонова И.В. Актуальные вопросы лептоспироза людей и животных // Российский ветеринарный журнал. 2017. № 8. С. 14–18.
15. Попов В.В. Наземные позвоночные Иркутской области. Распространение и охрана // Байкальский центр полевых исследований «Дикая природа Азии». Иркутск, 2015.
16. Транквилевский Д.В., Квасов Д.А., Мещерякова И.С. и др. Вопросы организации мониторинга природных очагов инфекций опасных для человека. Планирование, проведение и анализ результатов полевых наблюдений // Здоровье населения и среда обитания. 2014. № 8 (257). С. 38–44. EDN QOMBDP.
17. Транквилевский Д.В. Об инфицированности мелких млекопитающих возбудителями зоонозов в Российской Федерации // Здоровье населения и среда обитания. 2016. Т. 10. № 283. С. 53–56. EDN WWKQYP.
18. Транквилевский Д.В., Царенко В.А., Жуков В.И. Современное состояние эпизоотологического мониторинга за природными очагами инфекций в Российской Федерации // Медицинская паразитология и паразитарные болезни. 2016. № 2. С. 19–24.
19. Никитина А.А., Корякина Л.П. Этиологическая структура лептоспир, циркулирующих в популяциях сельскохозяйственных животных в Якутии // Вестник НГАУ. 2022. № 3 (64). С. 111–117. doi: 10.31677/2072-6724-2022-64-3-111-117. EDN BERLAN.
20. Громов И.М., Гуреев А.А., Новиков Г.А. и др. Определители по фауне СССР. вып. 82. Млекопитающие фауны СССР. Часть 1. Москва ; Ленинград : Изд-во Акад. наук СССР. [Ленингр. отд-ние], 1963. С. 639.
21. Громов И.М., Поляков И.Я. Полевки (Microtinae). Фауна СССР. Млекопитающие. Т. III. Вып. 8. Ленинград: Наука Ленингр. отд-ние, 1977. 502 с.
22. Попов В.В. Млекопитающие Иркутской области (аннотированный список) // Байкальский зоологический журнал. 2011. № 1(6). С. 69-78. EDN REUSJV.
23. Юдин Б.С. Насекомоядные млекопитающие Сибири. Определитель. АН СССР. Новосибирск : Наука. Сиб. отд-ние, 1971. 171 с.
24. Лисовский А.А., Шефтель Б.И., Савельева А.П. и др. Млекопитающие России: список видов и прикладные аспекты // Сборник трудов Зоологического музея МГУ. Т. 56. М: Товарищество научных изданий КМК, 2019.
Об авторах
Е. Ю. КиселеваРоссия
Киселева Евгения Юрьевна, к.м.н., врач-бактериолог отдела биологического и технологического контроля
ул. Трилиссера, д. 78, г. Иркутск, 664047
В. М. Корзун
Россия
Корзун Владимир Михайлович, д.б.н., заведующий зоолого-паразитологическим отделом
ул. Трилиссера, д. 78, г. Иркутск, 664047
Н. В. Бренёва
Россия
Бренёва Наталья Владимировна, к.м.н., ведущий научный сотрудник отдела эпидемиологии
ул. Трилиссера, д. 78, г. Иркутск, 664047
С. А. Борисов
Россия
Борисов Сергей Анатольевич, лаборант-исследователь зоолого-паразитологического отдела
ул. Трилиссера, д. 78, г. Иркутск, 664047
А. Ф. Тимошенко
Россия
Тимошенко Александр Федорович, зоолог отделения особо опасных инфекций микробиологической лаборатории лабораторного отдела
ул. Трилиссера, д. 51, г. Иркутск, 664047
М. Б. Шаракшанов
Россия
Шаракшанов Мунко Баярович, врач-эпидемиолог лаборатории природно-очаговых вирусных инфекций
ул. Трилиссера, д. 78, г. Иркутск, 664047
С. Е. Будаева
Россия
Будаева Софья Евгеньевна, младший научный сотрудник отдела эпидемиологии
ул. Трилиссера, д. 78, г. Иркутск, 664047
С. В. Балахонов
Россия
Балахонов Сергей Владимирович, д.м.н., профессор, директор
ул. Трилиссера, д. 78, г. Иркутск, 664047
Дополнительные файлы
Рецензия
Для цитирования:
Киселева Е.Ю., Корзун В.М., Бренёва Н.В., Борисов С.А., Тимошенко А.Ф., Шаракшанов М.Б., Будаева С.Е., Балахонов С.В. Этиологическая структура патогенных лептоспир в природных очагах Прибайкалья. Здоровье населения и среда обитания – ЗНиСО. 2023;31(3):72-78. https://doi.org/10.35627/2219-5238/2023-31-3-72-78
For citation:
Kiseleva E.Yu., Korzun V.M., Breneva N.V., Borisov S.A., Timoshenko A.F., Sharakshanov M.B., Budaeva S.E., Balakhonov S.V. Etiological Structure of Leptospira interrogans in Natural Foci of the Baikal Region. Public Health and Life Environment – PH&LE. 2023;31(3):72-78. (In Russ.) https://doi.org/10.35627/2219-5238/2023-31-3-72-78









.png)



























