Перейти к:
Ассоциативные связи показателей негативных эффектов со стороны органов дыхания, крови и иммунной системы с повышенным содержанием меди, никеля и хрома в крови
https://doi.org/10.35627/2219-5238/2022-30-11-54-61
Аннотация
Введение. Актуальной гигиенической проблемой в регионах с интенсивным промышленным освоением остается стабильное присутствие загрязняющих веществ в атмосферном воздухе и его постоянное влияние на здоровье населения, обуславливающее дополнительные случаи общесоматических заболеваний со стороны критических органов и систем, их хронизация.
Цель: обоснование ассоциативных связей биомаркерных показателей негативных эффектов со стороны органов дыхания, крови и иммунной системы с повышенным содержанием меди, никеля и хрома в крови для задач раннего выявления и профилактики негативных последствий, связанных с аэрогенным комбинированным воздействием оксидов меди, никеля и хрома (на примере взрослого экспонированного населения).
Материалы и методы. Проведена гигиеническая оценка качества атмосферного воздуха селитебной застройки, анализ общей и первичной популяционной заболеваемости за период 2016–2020 гг. Выполнено исследование состояния здоровья женщин фертильного возраста, проживающих в зоне аэрогенного комбинированного воздействия оксидов никеля, хрома и меди, и сравнительно неэкспонированных (порядка 5 тыс. химико-аналитических, общеклинических и иммунобиохимических исследований, проведенных в 2022 г.).
Основные результаты. Установлены ассоциативные связи повышенного содержания меди, никеля и хрома в крови с изменением показателей негативных эффектов. Биомаркерами неспецифической и специфической сенсибилизации, хронического воспаления, сопровождающихся дисбалансом гуморального и клеточного звена иммунитета, являются гиперпродукция эозинофилов в назальном секрете, лимфоцитов в крови, IgG специфического к меди, снижение фагоцитарного индекса и числа; нарушения гомеостаза железа – снижение ферритина; индукции окислительных процессов – повышение малонового диальдегида; истощение системы антиоксидантной защиты – снижение общей антиоксидантной активности.
Выводы. Полученные результаты исследования целесообразно использовать для раннего выявления и последующего обоснования адресных мер профилактики негативных последствий со стороны органов дыхания, крови и отдельных нарушений, вовлекающих иммунный механизм, этиопатогенетически связанных с аэрогенным комбинированным воздействием изучаемых оксидов.
Ключевые слова
Для цитирования:
Землянова М.А., Кольдибекова Ю.В., Горяев Д.В., Ухабов В.М. Ассоциативные связи показателей негативных эффектов со стороны органов дыхания, крови и иммунной системы с повышенным содержанием меди, никеля и хрома в крови. Здоровье населения и среда обитания – ЗНиСО. 2022;1(11):54-61. https://doi.org/10.35627/2219-5238/2022-30-11-54-61
For citation:
Zemlyanova M.A., Koldibekova Yu.V., Goryaev D.V., Uhabov V.M. Associations between High Blood Levels of Copper, Nickel and Chromium and Indicators of Their Adverse Effects on Respiratory Organs, Blood and the Immune System. Public Health and Life Environment – PH&LE. 2022;1(11):54-61. (In Russ.) https://doi.org/10.35627/2219-5238/2022-30-11-54-61
Введение. Проблема стабильного присутствия загрязняющих веществ в атмосферном воздухе и его постоянного влияния на здоровье населения России, как и во всем мире, является чрезвычайно актуальной гигиенической проблемой [1]. На протяжении ряда десятилетий в городах и населенных пунктах РФ интенсивного промышленного освоения наблюдается высокая концентрация и стабильное функционирование промышленных хозяйствующих субъектов, значительные массы выбросов которых обуславливают высокое загрязнение атмосферного воздуха в жилой застройке [2]. При этом в зоне экспозиции нередко оказывается большое количество населения, в том числе из контингентов, наиболее восприимчивых к воздействию химических компонентов аэрогенной нагрузки (например, женщины фертильного возраста) [2][3]. Спектр загрязняющих веществ, вносящих существенный вклад в загрязнение атмосферного воздуха селитебной территории, помимо общераспространенных соединений, значительно расширяется за счет специфических примесей (включая оксиды хрома (VI), никеля и меди), характерных для конкретных видов производств, в том числе металлургического профиля1 , и относящихся к чрезвычайно и высоко опасным (1-й и 2-й класс) [4][5]. Обобщение данных научной литературы свидетельствует, что первоочередными (центральными) мишенями токсического действия оксидов меди, никеля и хрома являются органы дыхания и система крови2 . Основным механизмом развития негативных эффектов со стороны данных систем является индукция свободно радикального перекисного окисления липидов клеточных мембран [6] с формированием гиперчувствительности на фоне неспецифического воспаления [7]. В ряде научных публикаций отмечается, что медь, никель и хром при поступлении в организм связываютсяс белками и выполняют функцию адъювантов, вызывая усиление иммунного ответа с последующим развитием хронического воспаления, в том числе дыхательных путей [8–10]. Вследствие реализации токсических свойств этих загрязняющих примесей при ингаляционном поступлении в организм подверженных лиц могут развиваться дополнительные случаи общесоматических заболеваний органов дыхания, иммунной системы, крови, их хронизация [11].
В связи с этим особую значимость для населения из контингента, наиболее восприимчивого к многокомпонентному воздействию изучаемых оксидов металлов, имеет разработка адекватных подходов к раннему выявлению и профилактике заболеваний органов дыхания и системы крови с вовлечением иммунных механизмов с учетом выявленных негативных эффектов.
Цель: обоснование ассоциативных связей биомаркерных показателей негативных эффектов со стороны органов дыхания, крови и иммунной системы с повышенным содержанием меди, никеля и хрома в крови для задач раннего выявления и профилактики негативных последствий, связанных с аэрогенным комбинированным воздействием оксидов меди, никеля и хрома (на примере взрослого экспонированного населения).
Материалы и методы. Объектом исследования являлось состояние здоровья экспонированных женщин фертильного возраста (83 человека, 21–48 лет), проживающих в зоне аэрогенного комбинированного воздействия оксидов никеля, хрома и меди, и сравнительно неэкспонированных (23 женщины аналогичного возраста). Исследование состояния здоровья женщин проведено в 2022 г.
Критериями формирования выборки из зоны экспозиции (группа наблюдения) являлись: постоянное проживание в селитебной застройке, находящейся в зоне влияния компонентов выбросов в атмосферный воздух от источников металлургического производства (в том числе оксидов никеля, хрома и меди); период проживания в зоне экспозиции не менее 3 лет; возраст – 21–48 лет; отсутствие воздействия вредных химических факторов производственной среды; отсутствие инфекционных заболеваний в течение 1 месяца, предстоящего углубленному обследованию, и соматических заболеваний в стадии обострения; наличие рационального питания и организации режима дня; удовлетворительный уровень материального обеспечения и гигиенических условий проживания.
Критериями формирования выборки группы сравнения являлись: проживание в селитебной застройке с отсутствием или существенно более низким уровнем аэрогенной экспозиции, формируемой изучаемыми металлами; период проживания на территории не менее 3 лет; отсутствие воздействия вредных химических факторов производственной среды; медико-биологические, социально-экономические, санитарно-бытовые критерии, аналогичные критериям формирования выборок взрослых группы наблюдения. Территория сравнения характеризуется климатогеографическими условиями, аналогичными территории наблюдения.
Гигиеническая оценка качества атмосферного воздуха по содержанию оксидов меди, никеля и хрома (VI) в жилой застройке проведена по данным о средних концентрациях за период 2016–2020 гг. из среднесуточных, полученных в точках наблюдения в ходе социально-гигиенического мониторинга. Концентрации изучаемых веществ в атмосферном воздухе оценивали относительно среднесуточных предельных допустимых концентраций в соответствии ГН 2.1.6.3492–173 .
Анализ общей и первичной популяционной заболеваемости взрослого населения за период 2016–2020 гг. болезнями органов дыхания, системы крови, кроветворных органов и возникновения отдельных нарушений, вовлекающих иммунный механизм (в случаях заболеваний на 1000 взрослого населения), осуществляли по данным государственной статистической отчетности – Форма 12 «Сведения о числе заболеваний, зарегистрированных у пациентов, проживающих в районе обслуживания медицинской организации».
Концентрацию меди, никеля и хрома в крови определяли в соответствии с действующими в РФ методическими указаниями МУК 4.1.3230–14 «Измерение массовых концентраций химических элементов в биосредах (кровь, моча) методом масс-спектрометрии с индуктивно связанной плазмой с использованием масс-спектрометра с индуктивно связанной аргоновой плазмой»4 . С учетом ожидаемых негативных эффектов проведены исследования изменений показателей, характеризующих негативные эффекты со стороны органов дыхания (неспецифическая сенсибилизация – эозинофилы, нейтрофилы и индекс эозинофилии в назальном секрете; воспалительные процессы лимфопролиферативной природы – относительное число эозинофилов, лимфоциты, моноциты в крови, эозинофильно-лимфоцитарный индекс), системы крови (гематокрит, гемоглобин, цветной показатель, средняя концентрация гемоглобина внутри эритроцита, средний объем эритроцита и тромбоцитов, анизоцитоз эритроцитов, тромбоциты, ретикулоциты, железо, общая и ненасыщенная железосвязывающие способности (ОЖСС и НЖСС), трансферрин, ферритин), гуморальных (IgE общий, сывороточные иммуноглобулины А, М, G, специфические иммуноглобулины G и E) и клеточных механизмов (показатели фагоцитоза в крови) иммунной системы, оксидантно-антиоксидантных процессов (малоновый диальдегид (МДА) и общая антиоксидантная активность в плазме крови (АОА)). В рамках настоящего исследования проведено порядка 5000 химических, общеклинических и иммунобиохимических анализов, выполненных в 2022 г.
Статистическую обработку данных при соответствии случайных величин анализируемых показателей закону нормального распределения выполняли с использованием параметрических методов статистики, рассчитывали статистические параметры: математическое ожидание – среднее значение (M), ошибка репрезентативности (m), двухвыборочный критерий Стьюдента (t ≥ 2) при оценке статистической достоверности (р) межгрупповых различий и критерий Фишера (F ≥ 3,96) при оценке различия дисперсий при заданном критерии значимости р ≤ 0,05. Моделирование причинно-следственных связей между концентрацией химических веществ в крови и изменением лабораторного показателя выполняли методом нелинейного регрессионного анализа. Оценку достоверности параметров и адекватности модели проводили на основании однофакторного дисперсионного анализа по критерию Фишера (F > 3,96), коэффициенту детерминации (R2 ) и t-критерию Стьюдента (t > 2) при заданном уровне значимости р ≤ 0,055 .
Результаты. В атмосферном воздухе жилой застройки за анализируемый период установлено повышенное содержание относительно предельно допустимых концентраций оксида никеля (от 1,3 до 1,8 ПДКсс) и оксида меди (от 1,2 до 1,8 ПДКсс). При этом в атмосферном воздухе стабильно регистрируется присутствие хрома (VI) в диапазоне 0,01–0,03 ПДКсс.
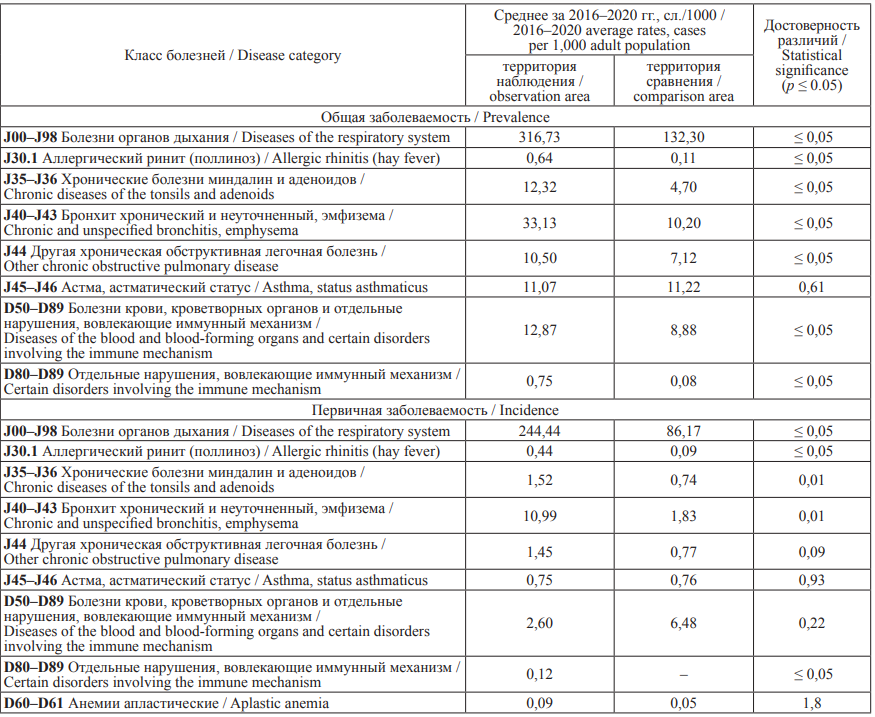
Анализ общей и первичной заболеваемости взрослого населения территории наблюденияотносительно территории сравнения показал достоверное превышение болезней органов дыхания в 2,4–2,8 раза, в том числе в виде аллергического ринита – в 4,8–5,7 раза, хронической болезни миндалин и аденоидов – в 2,1–2,6 раза, хронического бронхита – в 3,3–6,0 раза, хронической обструктивной легочной болезни – в 1,5 раза, болезней крови, кроветворных органов и отдельных нарушений, вовлекающих иммунный механизм, – в 1,5–9,3 раза (р ≤ 0,05) (см. табл. 1).
Таблица 1. Показатели общей и первичной заболеваемости взрослого населения болезнями органов дыхания,
крови, кроветворных органов и отдельными нарушениями, вовлекающими иммунный механизм, сл./1000
(данные государственной статотчетности)
Table 1. Incidence and prevalence rates of respiratory diseases, diseases of the blood and blood-forming organs and certain disorders
involving the immune mechanism per 1,000 adult population (state statistical reporting data)
В крови женщин группы наблюдения установлены повышенные в 1,3–1,4 раза уровни никеля (0,0052 ± 0,0011 мкг/см3 ) и хрома (0,0075 ± 0,0010 мкг/см3 ) относительно данных показателей в группе сравнения (р = 0,002–0,047) и в 5,0–7,5 раза относительно референтных уровней (RfL никеля и хрома в крови – 0,001 мкг/см3 )6 . Средняя концентрация меди в крови (1,0177 ± 0,0475 мкг/см3 ) также достоверно превысила уровень аналогичного показателя в группе сравнения и референтное значение показателя (RfL меди в крови – 0,9 мкг/см3 [11]) (р = 0,018).Частота регистрации проб крови с повышенным содержанием исследуемых металлов в группе наблюдения относительно группы сравнения составила 40,7–48,2 %.
Сравнительный анализ результатов общеклинических и иммунобиохимических исследований позволил выделить у женщин группы наблюдения комплекс показателей, изменение которых достоверно отличается от физиологической нормы и аналогичных показателей в группе сравнения, и отражает развитие негативных эффектов со стороны органов дыхания, иммунной системы и системы крови. В группе наблюдения относительно физиологической нормы установлено повышение уровня эозинофилов в назальном секрете (р = 0,001) в 30,6 % случаев, лимфоцитов крови (р = 0,0001) – в 84,7 % случаев, специфического иммуноглобулина к меди (р = 0,0001) – в 66,3 % случаев, МДА плазмы крови (р = 0,009) – в 33,8 % случаев, а также снижение моноцитов крови (р = 0,0001) – в 96,5 % случаев, АОА в плазме крови (р = 0,0001) – в 79,8 % случаев. Остальные изучаемые показатели у женщин группы наблюдения находились в диапазоне физиологически оптимальных значений (см. табл. 2).
Таблица 2. Сравнительный анализ общеклинических, иммунобиохимических показателей у обследованных женщин
Table 2. Comparative analysis of general clinical, immune, and biochemical parameters in the examined women
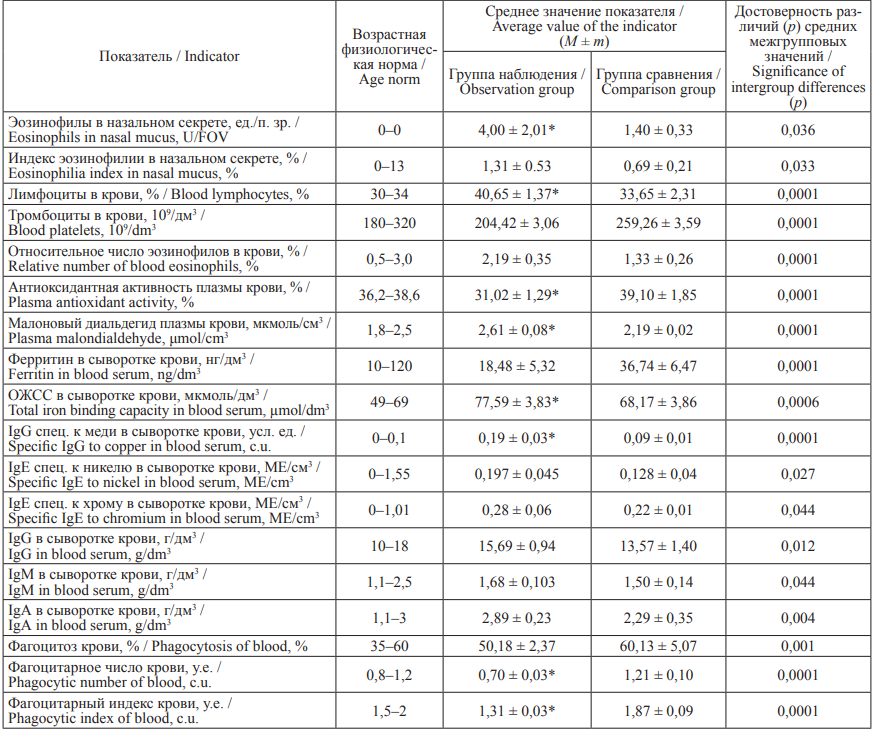
Примечание: * – показатель достоверно отличается от возрастной физиологической нормы (р ≤ 0,05).
Notes: * the indicator is significantly different from the age norm (р ≤ 0.05).
В группе наблюдения относительно группы сравнения выявлено достоверное повышение в 2,9 раза эозинофилов в назальном секрете (р = 0,036), в 1,9 раза – среднего значения индекса эозинофилии (р = 0,033), в 1,6 раза – относительного числа эозинофилов в крови (р = 0,0001), в 1,2 раза – уровня лимфоцитов в крови (р = 0,0001), в 1,2 раза – МДА в плазме крови (р = 0,0001), в 1,1 раза – ОЖСС в сыворотке крови (р = 0,0006), в 2,1 раза – IgG специфического к меди (р = 0,0001), в 1,5 раза – IgE специфического к никелю (р = 0,027), в 1,3 раза – IgE специфического к хрому, в 1,2– 1,3 раза – иммуноглобулинов А, М, G в сыворотке крови (р = 0,004–0,044). У взрослых группы наблюдения относительно группы сравнения выявлено снижение в 1,9 раза ферритина в сыворотке крови (р = 0,0001), в 1,3 раза – тромбоцитов в крови (р = 0,0001), в 1,7 раза – фагоцитарного числа (р = 0,0001), в 1,4 раза – индекса фагоцитоза (р = 0,0001) и в 1,2 раза – процента фагоцитоза в крови (р = 0,001).
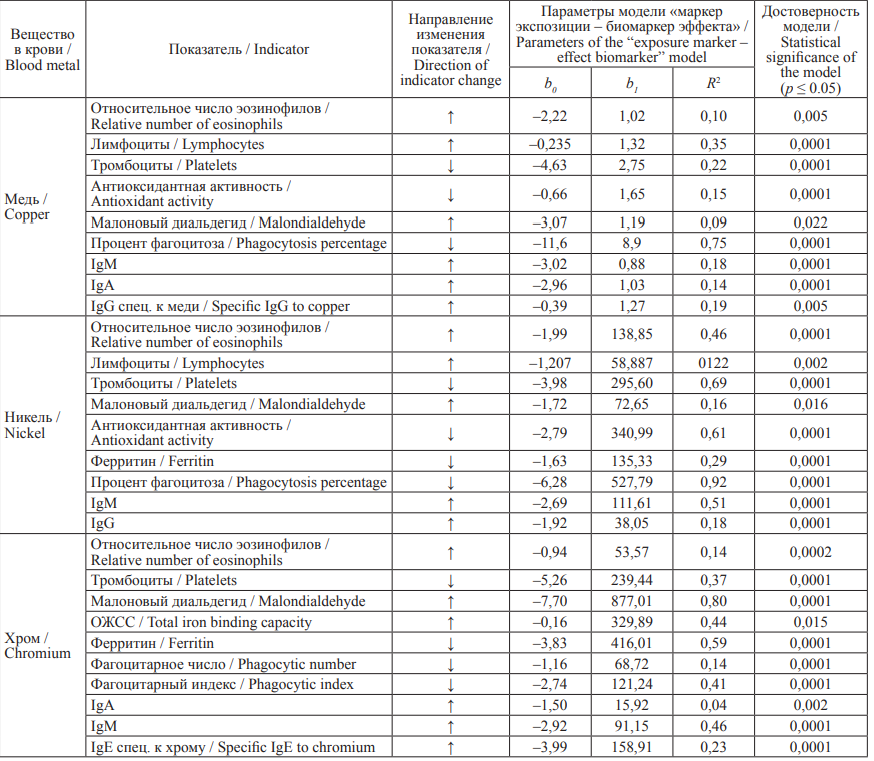
Анализ полученных моделей зависимости изменения исследуемых общеклинических и иммунобиохимических показателей от содержания меди, никеля и хрома в крови обследуемых лиц позволил выделить достоверные, адекватные и биологически правдоподобные причинно-следственные связи, представленные в табл. 3.
Таблица 3. Модели зависимости изменения общеклинических и иммунобиохимических показателей
от содержания меди, никеля и хрома в крови
Table 3. Models of the relationship between blood levels of copper, nickel, and chromium and changes in general clinical,
immunological, and biochemical parameters
Обсуждение. В настоящем исследовании у женщин фертильного возраста, подвергающихся хроническому аэрогенному воздействию оксидов меди, никеля и хрома, доказательством факта экспозиции изучаемых токсикантов является повышенное до 1,4 раза содержание в крови меди, никеля и хрома относительно группы сравнения, до 7,5 раза относительно референтных уровней. При этом кровь является той биологической средой, которая адекватно отражает предшествующую химическую7 [12].
По данным экспериментальных исследований оксиды меди, никеля и хрома даже в концентрациях ниже предельно допустимых значений в атмосферном воздухе способны выступать раздражителями слизистой оболочки верхних отделов дыхательных путей [13][14] и опосредовать воспалительные реакции в эпителии [14]. Оксиды металлов продуцируют ряд цитокинов и интерлейкинов, способствующих искажению иммунного ответа организма [15], с последующим развитием неспецифической реактивности слизистой оболочки полости носа [16]. Установлено, что однократное ингаляционное воздействие изучаемых химических веществ приводит к снижению частоты биения ресничек респираторного тракта, следствием чего может являться нарушение мукоцилиарного клиренса [16]. В свою очередь, снижение эффективности мукоцилиарного клиренса в научной литературе рассматривается в качестве одного из ключевых механизмов формирования воспалительных и структурных изменений эпителия слизистой оболочки бронхов [17]. Выявленные в настоящемисследовании изменения общеклинических и иммуно-биохимических показателей крови могут свидетельствовать о развитии воспалительно-пролиферативных процессов слизистой верхних и нижних дыхательных путей. Процесс усиливается индукцией окислительной активности и сопровождается дисбалансом клеточного и гуморального звена иммунитета [6][18]. Установленная достоверная связь между повышенным уровнем относительного числа эозинофилов и лимфоцитов крови, а также неспецифических и специфических иммуноглобулинов и концентрацией меди, никеля и хрома в крови подтверждается повышенной до 2,8 раза популяционной распространенностью общей и первичной заболеваемости болезней органов дыхания в виде аллергического ринита, хронической болезни миндалин и аденоидов, хронического бронхита.
Ингаляционное воздействие изучаемых химических веществ вызывает нарушения не только со стороны органов дыхания и иммунной системы, но и может приводить к изменению ряда гематологических показателей, что представлено в настоящем исследовании. Хром, медь и никель являются прооксидантными металлами. В основе повреждающего действия данных химических веществ на мембраны эритроцитов лежит индукция процессов перекисного окисления посредством генерации активных форм кислорода [18]. В свою очередь, интенсификация перекисного окисления липидов приводит к неспецифической дезорганизации структуры мембраны эритроцитов, сопровождающейся снижением осмотической и кислотной резистентности эритроцитов, [19] влекущей за собой нарушение гомеостаза железа [20][21]. Процесс подтверждается повышенным уровнем ОЖСС и, напротив, снижением ферритина в сыворотке крови. Кроме этого, в научной литературе подчеркивается, что избыток внутриклеточных активных форм кислорода снижает дифференцировку клеток в мегакариоцитарном ростке, что может повлечь за собой нарушение продукции тромбоцитов [22–24]. Несмотря на то что уровни сывороточного ферритина и тромбоцитов крови взрослых группы наблюдения находились в диапазоне физиологических значений, обращает на себя внимание достоверная зависимость снижения уровней данных показателей от повышенного содержания меди, никеля и хрома в крови. Перечисленные факты могут свидетельствовать, что одной из возможных причин повышения уровня общей заболеваемости болезнями крови является хроническая аэрогенная экспозиция меди, никеля и хрома.
В проведенном исследовании не исключается вероятность изменения лабораторных показателей, а также показателей заболеваемости, связанная с возможным влиянием иных факторов (наследственность, половозрастные особенности, вредные привычки), не изученных в данной работе. Однако установленные модели зависимости изменения уровня отдельных изучаемых лабораторных показателей от повышенного содержания меди, никеля и хрома в крови не исключают возможного повышения частоты возникновения аллергического ринита, хронической болезни миндалин и аденоидов, хронического бронхита, болезней крови, кроветворных органов и отдельных нарушений, вовлекающих иммунный механизм, при повышенной концентрации изучаемых веществ в крови.
Заключение. Выполненные исследования позволили установить ассоциативные связи между изменением уровня показателей негативных эффектов со стороны органов дыхания, системы крови, кроветворных органов и отдельных нарушений, вовлекающих иммунный механизм, и повышенным содержанием меди, никеля и хрома в крови. Биомаркерами негативных эффектов в виде формирования неспецифической и специфической сенсибилизации, хронического воспаления, сопровождающихся дисбалансом гуморального и клеточного звена иммунитета, являются гиперпродукция эозинофилов в назальном секрете, лимфоцитов в крови, IgG специфического к меди, снижение фагоцитарного индекса и числа; нарушения гомеостаза железа – повышение ОЖСС и снижение ферритина в сыворотке крови; индукции окислительных процессов – повышение МДА в плазме крови; истощение общей антиоксидантной активности организма – снижение АОА в плазме крови. Полученные результаты целесообразно использовать для раннего выявления и последующего обоснования адресных мер профилактики негативных последствий со стороны органов дыхания, системы крови и отдельных нарушений, вовлекающих иммунный механизм, этиопатогенетически связанных с аэрогенным комбинированным воздействием оксидов никеля, хрома и меди
1. Обзор состояния и загрязнения окружающей среды в Российской Федерации за 2021 год. М.: Росгидромет, 2022. 220 с.
2. ГОСТ 12.1.007-76. Вредные вещества. Классификация и общие требования безопасности. 1977 Электронный фонд нормативно-правовых документов [Электронный ресурс] Режим доступа: https://docs.cntd.ru/document/5200233 (дата обращения: 26.04.2022).
3. ГН 2.1.6.3492–17 «Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе городских и сельских поселений». Электронный фонд нормативно-правовых документов [Электронный ресурс] Режим доступа: https://docs.cntd.ru/document/556185926 (дата обращения: 01.11.2022).
4. Определение химических соединений и элементов в биологических средах: Сборник методических указаний. М.: Федеральный центр гигиены и эпидемиологии Роспотребнадзора, 2015. 168 с.
5. Гланц С. Медико-биологическая статистика / Под ред. Н.Е. Бузикашвили и соавт. Москва: Практика, 1998. 459 с.
6. Клиническое руководство по лабораторным тестам; под ред. проф. Норберта У. Тица / перевод с англ. под ред. В.В. Меньшикова. М.: ЮНИМЕД-пресс, 2003. 960 с.
7. Всемирная организация здравоохранения (ВОЗ). Биомониторинг человека: факты и цифры. Копенгаген, 2015. [Электронный ресурс]. Режим доступа: https://www.euro.who.int/ru/health-topics/environment-and-health/health-impactassessment/publications/2015/human-biomonitoring-facts-and-figures (дата обращения: 10.09.2022).
Список литературы
1. Попова А.Ю. Стратегические приоритеты Российской Федерации в области экологии с позиции сохранения здоровья нации // Здоровье населения и среда обитания. 2014. № 2 (251). С. 4–7.
2. Клюев Н.Н., Яковенко Л.М. «Грязные» города России: факторы, определяющие загрязнение атмосферного воздуха // Вестник Российского университета дружбы народов. Серия: Экология и безопасность жизнедеятельности. 2018. Т. 26. № 2. С. 237–250. doi: 10.22363/2313-2310-2018-26-2-237-250
3. Beelen R, Raaschou-Nielsen O, Stafoggia M, et al. Effects of long-term exposure to air pollution on natural-cause mortality: an analysis of 22 European cohorts within the multicentre ESCAPE project. Lancet. 2014;383(9919):785-95. doi: 10.1016/S0140-6736(13)62158-3
4. Зайцева Н.В., Жданова-Заплесвичко И.Г., Землянова М.А., Пережогин А.Н., Савиных Д.Ф. Опыт организации и проведения санитарно-эпидемиологических исследований по выявлению и доказательству связи нарушений здоровья населения с качеством атмосферного воздуха в зонах влияния хозяйствующих субъектов // Здоровье населения и среда обитания. 2021. № 1 (334). С. 4–15. doi: 10.35627/2219-5238/2021-334-1-4-l5
5. Май И.В., Зайцева Н.В. Показатели риска и вреда здоровью населения в системе новых механизмов мониторинга и управления качеством воздуха // Здоровье населения и среда обитания. 2022. Т. 30. № 10. С. 7–15. doi: 10.35627/2219-5238/2022-30-10-7-15
6. Marsili R. Flavors and off-flavors in dairy foods. In: McSweeney PLH, McNamara JP, eds. Encyclopedia of Dairy Sciences (Third Edition). Academic Press; 2022:560–578. doi: 10.1016/B978-0-12-818766-1.00301-9
7. Engwa GA, Ferdinand PU, Nwalo FN, Unachukwu MN. Mechanism and health effects of heavy metal toxicity in humans. In: Karcioglu O, Arslan B, eds. Poisoning in the Modern World – New Tricks for an Old Dog? London: IntechOpen; 2019. doi: 10.5772/intechopen.82511
8. Аликина И.Н., Долгих О.В. Иммунологические маркеры формирования бронхиальной астмы у детей в условиях контаминации биосред техногенными химическими факторами // Гигиена и санитария. 2022. Т. 101. № 6. С. 670–674. doi: 10.47470/0016-9900-2022-101-6-670-674
9. Skalny AV, Lima TRR, Ke T, et al. Toxic metal exposure as a possible risk factor for COVID-19 and other respiratory infectious diseases. Food Chem Toxicol. 2020;146:111809. doi: 10.1016/j.fct.2020.111809
10. Газимова В.Г., Шастин А.С., Малых О.Л., Цепилова Т.М., Устюгова Т.С. Некоторые региональные аспекты заболеваемости трудоспособного населения Уральского федерального округа // Здоровье населения и среда обитания. 2021. Т. 29. № 11. С. 7–15. doi: 10.35627/2219-5238/2021-29-11-7-15
11. Тихонова И.В., Землянова М.А., Кольдибекова Ю.В., Пескова Е.В., Игнатова А.М. Гигиеническая оценка аэрогенного воздействия взвешенных веществ на заболеваемость детей болезнями органов дыхания в зоне влияния источников выбросов металлургического производства // Анализ риска здоровью. 2020. № 3. С. 61–69. doi: 10.21668/health.risk/2020.3.07
12. Willey JB, Pollock T, Thomson EM, et al. Exposure Load: Using biomonitoring data to quantify multi-chemical exposure burden in a population. Int J Hyg Environ Health. 2021;234:113704. doi: 10.1016/j.ijheh.2021.113704
13. Roudier J, Balandraud N, Auger I. How RA associated HLA-DR molecules contribute to the development of antibodies to citrullinated proteins: The hapten carrier model. Front Immunol. 2022;13:930112. doi: 10.3389/fimmu.2022.930112
14. Auger I, Balandraud N, Massy E, et al. Peptidylarginine deiminase autoimmunity and the development of anti-citrullinated protein antibody in rheumatoid arthritis: The hapten-carrier model. Arthritis Rheumatol. 2020;72(6):903-911. doi: 10.1002/art.41189
15. Ban M, Langonné I, Goutet M, Huguet N, Pépin E. Simultaneous analysis of the local and systemic immune responses in mice to study the occupational asthma mechanisms induced by chromium and platinum. Toxicology. 2010;277(1-3):29-37. doi: 10.1016/j.tox.2010.08.010
16. Меркулова Е.П., Колесникова С.Н. Хроническая назальная гиперреактивность // Медицинский совет. 2017. № 9. С. 60–64. doi: 10.21518/2079-701X-2017-9-60-64
17. Одиреев А.Н., Чжоу С.Д., Ли Ц., Колосов В.П., Луценко М.Т. Нарушения мукоцилиарного клиренса при бронхиальной астме // Бюллетень физиологии и патологии дыхания. 2010. № 37. С. 15–21.
18. Садрисламова А.Р., Гусева П.М., Корнеева П.М. Иммунодефицитные состояния: патогенез, виды // Молодой ученый. 2022. № 1 (396). С. 39–41.
19. Рыспекова Н.Н., Нурмухамбетов А.Н., Аскарова А.Е., Аканов А.А. Роль тяжелых металлов в развитии анемий (обзор литературы) // Вестник КазНМУ. 2013. № 3 (2). С. 46–51.
20. Орлов Ю.П., Говорова Н.В., Ночная Ю.А., Руднов В.А. Анемия воспаления: особенности, необходимость и возможность коррекции. Обзор литературы // Вестник интенсивной терапии имени А.И. Салтанова. 2019. № 1. С. 20–35. doi: 10.21320/1818-474X-2019-1-20-35
21. Потемина Т.Е., Волкова С.А., Кузнецова С.В., Перешеин А.В. Общие вопросы метаболизма железа и патогенеза железодефицитной анемии // Вестник медицинского института «РЕАВИЗ». Реабилитация, Врач и Здоровье. 2020. № 3 (45). С. 125–137.
22. Shinohara A, Imai Y, Nakagawa M, Takahashi T, Ichikawa M, Kurokawa M. Intracellular reactive oxygen species mark and influence the megakaryocyte-erythrocyte progenitor fate of common myeloid progenitors. Stem Cells. 2014;32(2):548–557. doi: 10.1002/stem.1588
23. Mazzi S, Lordier L, Debili N, Raslova H, Vainchenker W. Megakaryocyte and polyploidization. Exp Hematol. 2018;57:1-13. doi: 10.1016/j.exphem.2017.10.001
24. Mann Z, Sengar M, Verma YK, Rajalingam R, Raghav PK. Hematopoietic stem cell factors: Their functional role in self-renewal and clinical aspects. Front Cell Dev Biol. 2022;10:664261. doi: 10.3389/fcell.2022.664261
Об авторах
М. А. ЗемляноваРоссия
Землянова Марина Александровна – д.м.н., профессор, главный научный сотрудник, заведующий отделом биохимических и цитогенетических методов диагностики
ул. Монастырская, д. 82, г. Пермь, 614045, Российская Федерация
Ю. В. Кольдибекова
Россия
Кольдибекова Юлия Вячеславовна – к.б.н., старший научный сотрудник, заведующий лабораторией исследования метаболизма и фармакокинетики отдела биохимических и цитогенетических методов диагностики
ул. Монастырская, д. 82, г. Пермь, 614045, Российская Федерация
Д. В. Горяев
Россия
Горяев Дмитрий Владимирович – к.м.н., руководитель; главный государственный санитарный врач по Красноярскому краю
ул. Каратанова, д. 21, г. Красноярск, 660049, Российская Федерация
В. М. Ухабов
Россия
Ухабов Виктор Максимович – д.м.н., профессор, заведующий кафедрой общей гигиены
ул. Петропавловская, д. 82, г. Пермь, 614990, Российская Федерация
Рецензия
Для цитирования:
Землянова М.А., Кольдибекова Ю.В., Горяев Д.В., Ухабов В.М. Ассоциативные связи показателей негативных эффектов со стороны органов дыхания, крови и иммунной системы с повышенным содержанием меди, никеля и хрома в крови. Здоровье населения и среда обитания – ЗНиСО. 2022;1(11):54-61. https://doi.org/10.35627/2219-5238/2022-30-11-54-61
For citation:
Zemlyanova M.A., Koldibekova Yu.V., Goryaev D.V., Uhabov V.M. Associations between High Blood Levels of Copper, Nickel and Chromium and Indicators of Their Adverse Effects on Respiratory Organs, Blood and the Immune System. Public Health and Life Environment – PH&LE. 2022;1(11):54-61. (In Russ.) https://doi.org/10.35627/2219-5238/2022-30-11-54-61









.png)



























