Перейти к:
К механизму формирования аутоиммунных патологий, обусловленных воздействием инактивированных Mycobacterium tuberculosis
https://doi.org/10.35627/2219-5238/2021-29-11-76-82
Аннотация
Введение. Высокая устойчивость M. tuberculosis к внешним условиям, наличие резервуаров возбудителя, ряд неблагоприятных социально-экономических факторов и недостаточность гигиенических мероприятий способствуют высокой заболеваемости туберкулезом во всем мире. Основу эффективной профилактики заболевания составляет научное обоснование механизмов его развития, что определило цель исследования: изучение этиопатогенеза аутоиммунных нарушений, ассоциированных с воздействием на организм теплокровных животных термически инактивированных M. tuberculosis.
Методы. На старых крысах линии Вистар определяли стандартными методами гематологические показатели, а также активность лактат- и сукцинатдегидрогеназ (ЛДГ, СДГ) в лимфоцитах (митохондриях) цитобиохимически. Результаты клинико-лабораторных исследований подтверждали рентгенографически.
Результаты. Воспалительный процесс, обусловленный введением термически инактивированных M. tuberculosis (адъювант Фрейнда), достигал максимума на третьей неделе – количество лейкоцитов возрастало на фоне контроля с 9,8 до 11,3 тыс./мкл, нормализуясь к 7-й неделе. К окончанию первой недели отмечалась выраженная иммунная реакция, проявляемая повышенной СОЭ, которая в дальнейшем превысила контрольные показатели на 87–100 %. Развитие аутоиммунной патологии сопровождалось снижением активности клеточного дыхания (гликолиза и окислительного фосфорилирования) на 40 и 77 % соответственно (p < 0,01). Рентгенологически выявлены нарушения в суставном аппарате опытных животных с резорбцией костной ткани.
Выводы. Механизм иммунотоксического M. tuberculosis связан с нарушением энергообеспечения в клетках иммунной системы и изменением их морфофункциональных свойств, что позволяет рекомендовать включение в схемы лечения и профилактики туберкулеза и сочетанных с ним патологий препараты с иммуномодуляторным, антигипоксантным и остеопротекторным механизмом действия для повышения эффективности проводимой терапии.
Ключевые слова
Для цитирования:
Скупневский С.В., Трухина Г.М., Пухаева Е.Г., Бадтиев А.К., Руруа Ф.К., Батагова Ф.Э., Фарниева Ж.Г. К механизму формирования аутоиммунных патологий, обусловленных воздействием инактивированных Mycobacterium tuberculosis. Здоровье населения и среда обитания – ЗНиСО. 2021;29(11):76-82. https://doi.org/10.35627/2219-5238/2021-29-11-76-82
For citation:
Skupnevskiy S.V., Trukhinа G.M., Pukhаevа E.G., Bаdtiev A.K., Ruruа F.K., Bаtаgovа F.E., Fаrnievа Zh.G. On the mechanism of development of autoimmune diseases following exposure to inactivated Mycobacterium tuberculosis. Public Health and Life Environment – PH&LE. 2021;29(11):76-82. (In Russ.) https://doi.org/10.35627/2219-5238/2021-29-11-76-82
Введение. Мировые процессы глобализации и интеграции привели к обострению множества медицинских проблем, среди которых одной из приоритетных является туберкулез – заболевание, обусловливающее, по данным ВОЗ, смертность 1,5 миллиона людей в год [1]. Общая заболеваемость туберкулезом во всем мире составляет 10 млн человек ежегодно. Факторами, значительно усугубляющими характер течения болезни, являются сочетание ее с другими социально значимыми инфекциями (ВИЧ, гепатиты, сифилис и др.) [2][3], формирование множественной (широкой) лекарственной резистентности [4][5], что значительно модифицировало классический патоморфоз и определило его новые особенности – доминирование экссудативно-некротических процессов, развитие инфильтративных форм с массивным распадом тканей и образованием гигантских каверн, наличие выраженных признаков казеозной пневмонии и пр. [6–9]. В Российской Федерации на протяжении 12-летнего периода отмечается неуклонное снижение заболеваемости туберкулезом. В 2019 году показатель заболеваемости составил 41,8 на 100 тыс. населения, наиболее высокая заболеваемость активным туберкулезом продолжает регистрироваться в Сибирском, Дальневосточном и Уральском округах. Причинами неблагополучной эпидемиологической ситуации в субъектах РФ с наиболее высокими показателями заболеваемости являются интенсивные миграционные процессы, несвоевременное направление больных к специалистам-фтизиатрам, недостаточный объем мероприятий по профилактическому осмотру, низкий социально-экономический уровень проживания больных1. Факторами, способствующими распространению инфекции, являются наличие резервуаров возбудителя M. tuberculosis в местах лишения свободы, а также среди сельскохозяйственных животных [10]. Высокая устойчивость туберкулезных микобактерий к внешним условиям обеспечивает им сохранность в почвенной среде, воде (морской, пресноводной, водопроводной, плавательных бассейнов), животноводческих кормах, на поверхности плодовоовощных культур, в домашней и больничной пыли, в местах жизнедеятельности человека и обитания животных [11–15]. Сопутствующие туберкулезу патологии обусловлены воздействием компонентов бактериальной стенки M. tuberculosis, обладающих высокой антигенной активностью, и, способных индуцировать множественные нарушения в организме воспалительного характера. Так, введение теплокровным животным полного адъюванта Фрейнда, представляющего собой водно-масляную эмульсию термически обработанных туберкулезных микобактерий, приводит к разнородным по клиническим проявлениям аутоиммунным заболеваниям, в числе которых ревматоидный артрит, миокардит, энцефаломиелит и др. [16–19]. Раскрытие механизмов воздействия инфекта на организм человека способствует разработке более эффективных способов профилактики и лечения социально значимого заболевания, что определяет актуальность изучения нарушений здоровья, связанных с воздействием M. tuberculosis на иммунную систему и аутоиммунитет.
Цель исследования – изучение этиопатогенеза аутоиммунных нарушений, ассоциированных с воздействием на организм теплокровных животных термически инактивированных M. tuberculosis.
Материалы и методы. Эксперимент выполняли на старых (более 400 г) 16 самцах крыс линии Вистар, разделенных на две равные группы. Крысам опытной группы под общим наркозом (Золетил, Франция) вводили в правую заднюю конечность п/к эмульсию туберкулезных бактерий в форме полного адъюванта Фрейнда (АФ) в объеме 0,1 мл на 200 г массы тела животных. Крысам контрольной группы по той же схеме вводили физиологический раствор.
По истечении 1, 3 и 7 недель у животных под общим наркозом из сердца отбирали кровь, в которой определяли следующие параметры: количество лейкоцитов, скорость оседания эритроцитов (СОЭ), активность ферментов в митохондриях лимфоцитов – лактатдегидрогеназы и сукцинатдегидрогеназы.
Общее количество лейкоцитов подсчитывали под микроскопом, используя камеру Горяева, при малом увеличении 10 × 10. Препараты готовили стандартным способом, используя для окраски ядер лейкоцитов 100 мл 5 % раствор уксусной кислоты и 1 мл 1 % раствора метиленового синего. СОЭ измеряли по стандартному методу Панченкова за период времени 1 ч. Для этого использовали капилляр Панченкова со шкалой от 0 до 100 мм и 5 % раствор цитрата натрия в качестве антикоагулянта.
Активность митохондриальных ферментов определяли цитобиохимическим методом [20], предложенным Кондрашовой М.Н. и соавт. Для этого 10 мкл крови наносили на предметные стекла и с помощью прибора Microscopy Vision (Австрия) готовили мазки. Полученные препараты высушивали и фиксировали в 60 % растворе ацетона в течение 30 с и ополаскивали дистиллированной водой. Активность СДГ определяли как разницу показателей (№ 1 – № 2) интенсивности окраски гранул, полученных при инкубировании клеток крови в растворах следующего состава (рН 7,2 ± 0,01 при t = 37 °C): № 1 – 125 ммоль/л KCl, 10 ммоль/л HEPES, 1 мг/мл нитросинего тетразолия окисленного (НСТ) и 5 ммоль/л янтарной кислоты; № 2 – 125 ммоль/л KCl, 10 ммоль/л HEPES, 1 мг/мл НСТ и 5 ммоль/л малоновой кислоты, используемой в качестве селективного ингибитора СДГ. Активность ЛДГ определяли путем инкубации мазков крови в среде следующего состава (рН 7,2 ± 0,01 при t = 37 °C): 125 ммоль/л KCl, 10 ммоль/л HEPES, 1 мг/мл НСТ, 5 ммоль/л молочной кислоты, 5 ммоль/л малоновой кислоты, 0,5 ммоль/л НАДН. После инкубации (СДГ, ЛДГ) стекла промывали дистиллированной водой, высушивали и окрашивали в 0,05 % растворе нейтрального красного, имеющего сродство к ядрам клеток. Препараты микроскопировали при увеличении 10 × 100 под масляной иммерсией. На каждую крысу исследовалось по 100 клеток, которые для рандомизации отбирались из трех зон стекла: начальной, средней и финишной. Препараты фотографировали и обрабатывали в программе Bio Images (г. Пущино), позволяющей рассчитывать площадные (объемные) характеристики клеток и их компартментов, а также вычислять количество образуемого маркера дыхательной активности митохондрий – диформазана.
Рентгеновские снимки были получены на стационарном ветеринарном аппарате Ecoray Ultra 300V (Корея).
Рассчитывали среднее значение, стандартную ошибку среднего. Проверка нормальности распределения данных осуществлялась по критерию Шапиро – Уилка и при позитивном заключении сравнение гипотез проводилось по критерию Стьюдента в программе Microsoft Excel. Значимыми считались различия при p ≤ 0,05.
Результаты. Введение животным АФ сопровождалось иммунным ответом организма, который проявлялся в виде колебаний в крови численности лейкоцитов (рис. 1).
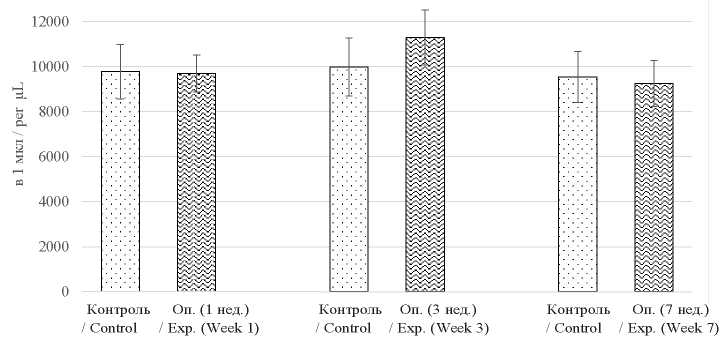
Рис. 1. Динамика общего количества лейкоцитов периферической крови у крыс в условиях индуцированной микобактериями патологии
Fig. 1. White blood cell counts in the rats infected with Mycobacterium tuberculosis
Из графика следует, что воспалительный процесс, обусловленный введением АФ, протекал волнообразно с максимумом на третьей неделе – количество лейкоцитов при этом возрастало на фоне контрольных значений с 9,8 до 11,3 тыс./мкл. К седьмой неделе отмечался плавный спад и содержание лейкоцитов в периферической крови возвращалось к норме (крайний столбец справа).
Косвенным доказательством протекания воспалительных реакций в организме служит тест на определение СОЭ. Тесная корреляция между содержанием белков острой фазы и показателем СОЭ позволяет сделать заключение об активации защитно-приспособительного процесса в виде общего воспаления, сохраняющегося на протяжении всего эксперимента у животных опытной группы (рис. 2).
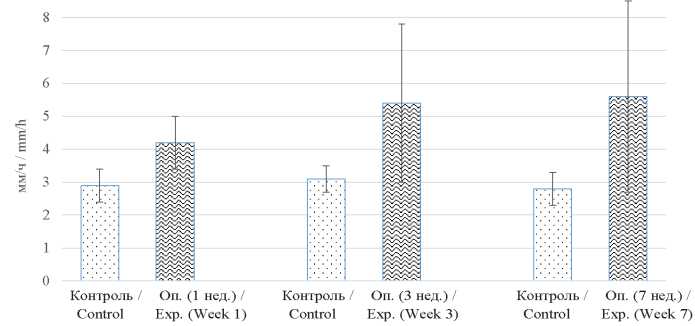
Рис. 2. Скорость оседания эритроцитов у крыс на фоне введения АФ
Fig. 2. Erythrocyte sedimentation rate in rats following CFA administration
Для животных опытных групп оказалось характерным неравномерное сужение суставных щелей, перестройка костной структуры в межвертельной области, где обнаруживаются участки кистовидных просветлений и остеосклероза (рис. 3, а, б). Суставные поверхности в коленных суставах уплощены. В ряде случаев контуры для вертлужной впадины не определяются. У одного животного (рис. 3, а) отмечена резорбция костной ткани, в результате которой произошло рассасывание головки и шейки бедренной кости (справа). У животных контрольной группы грубых изменений в костно-мышечной структуре не выявлено (рис. 3, в, г).
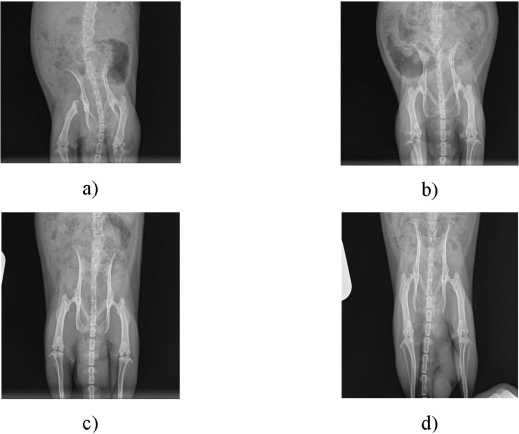
Рис. 3. Результаты радиографических исследований лабораторных животных (а, b – опытные животные; c, d – контрольные)
Fig. 3. X-ray images of experimental animals (a, b – experiment; c, d – control)
На рис. 4 представлены результаты молекулярных исследований воздействия инфекта на активность лактатдегидрогеназы иммунных клеток организма.
Из рисунка видно, что к окончанию первой недели эксперимента активность энергообеспечивающего фермента достоверно снижается у животных опытной группы относительно контрольной на 28 %. С развитием аутоиммунной патологии скорость гликолиза, протекающего внутриклеточно, неуклонно уменьшается и к седьмой неделе разница с контролем достигает 40 % (р = 0,003).
Активность одного из ключевых комплексов клеточного дыхания – сукцинатдегидрогеназы, осуществляющего перенос электронов на энергосопрягающих мембранах митохондрий, отражена в динамике на рис. 5.

Рис. 4. Активность ЛДГ в лимфоцитах крыс
Примечание: * p < 0,05; ** р < 0,01 в сравнении с контролем.
Fig. 4. Enzymatic activity of lactate dehydrogenase in rat lymphocytes
Note: * р < 0.05; ** р < 0.01 compared to controls.
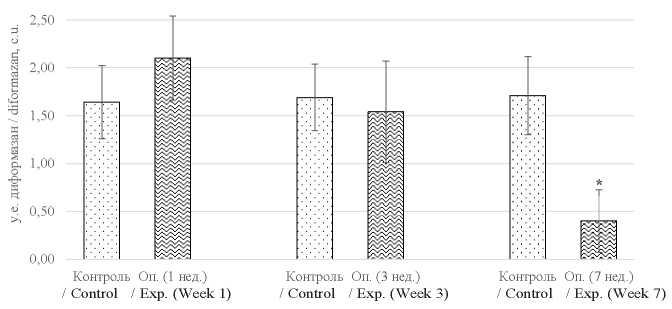
Рис. 5. Энзиматическая активность СДГ в лимфоцитах крыс
Примечание: * p < 0,05 относительно контроля.
Fig. 5. Enzymatic activity of succinate dehydrogenase in rat lymphocytes
Note: * р < 0.05 compared to controls.
Из рисунка видно, что уже к окончанию первой недели после контаминации животных каталитическая активность оксидоредуктазы повышается на 28 % относительно контрольной группы. Следующий за этим спад окислительного фосфорилирования, обусловленный дезактивацией встроенной в митохондриальную мембрану СДГ, приводит к снижению интенсивности клеточного дыхания в 4,3 раза (р = 0,029) и, как следствие, к энергодефициту иммунокомпетентных клеток в условиях формируемой патологии.
Динамика объема лимфоцитов, играющих центральную роль в осуществлении клеточного иммунитета, представлена на рис. 6.
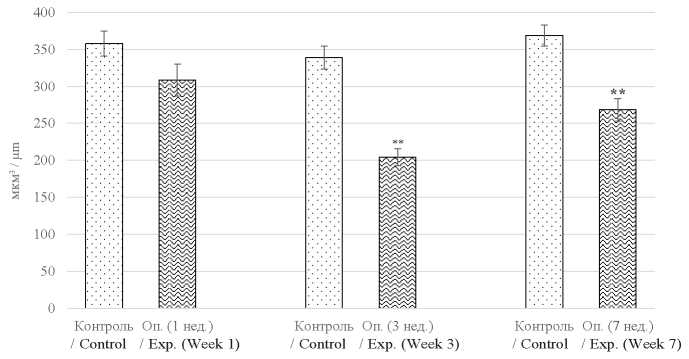
Рис. 6. Вариативность объема лимфоцитов крыс
Примечание: ** р < 0,01 в сравнении с контролем
Fig. 6. Variations in the rat lymphocyte volume
Note: ** р < 0.01 compared to controls.
Из рисунка видно, что средний объем иммунокомпетентных клеток у контрольных животных значительно не изменяется во времени и колеблется в пределах физиологической нормы 340–370 мкм3. При гиперстимуляции иммунной системы инактивированными M. tuberculosis отмечается микроцитоз, выраженность которого максимальна на третьей неделе, а сравнение с интактными животными выявляет различия в 40 % (р = 0,0004).
Обсуждение. Предложенный в 1930 г. Ю. Фрейндом адъювант находит широкое применение в практике лабораторного эксперимента, несмотря на то что механизм его действия раскрыт далеко не полностью [21]. Антигенная стимуляция термически обработанными микобактериями (M. tuberculosis) организма теплокровных животных приводит к дифференцировке лимфоцитов по пути Th1 и характеризуется гиперчувствительностью замедленного типа к аутоантигенам [22]. Генерализация воспалительного процесса вследствие аутоиммунных реакций сопровождается поражением различных органов, в том числе и соединительной ткани. Выявленный случай остеохондропатии головки бедренной кости (рис. 3, а) с деградацией костной ткани определяет костно-мышечную систему в качестве мишени для опосредованного воздействия инфекта.
Согласно полученным результатам, одну из молекулярных основ патогенеза M. tuberculosis-индуцированного аутоиммунного заболевания составляют нарушения, ассоциированные с дисбалансом выработки энергии в лимфоцитах. Прогрессирующее заболевание сопровождается энергодефицитом за счет снижения активности процессов гликолиза в цитозоле клетки и инактивации II дыхательного комплекса электрон-транспортной цепи митохондрий – СДГ. Недостаток энергии может являться причиной выявленного микроцитоза лимфоцитов, минимальный объем которых зарегистрирован на 3-й неделе с момента введения животным АФ. С другой стороны, в этот же период отмечен патологический лейкоцитоз (рис. 1). Продуцирование энергонеобеспеченных иммунокомпетентных клеток может служить причиной их функциональной несостоятельности и обеспечивать повышенную агрессивность аутоиммунных реакций.
Экспериментально выявленные молекулярно-клеточные звенья патогенеза позволяют рекомендовать включение в схемы профилактики и лечения туберкулеза препараты с иммуномодуляторным, антигипоксантным и остеопротекторным механизмом действия для повышения эффективности проводимой терапии.
Выводы
1. Механизм иммунотоксического действия термически инактивированных M. tuberculosis связан с нарушением энергообеспечения в клетках иммунной системы и ингибированием ЛДГ на 40 % у животных опытной группы относительной контрольной, СДГ на 77 % и снижением объема лимфоцитов на 27–40 %.
2. Одной из основных мишеней опосредованного через иммунную систему действия инфекции является опорно-двигательный аппарат, что подтверждается рентгенологически резорбцией к 7-й неделе с момента интоксикации головки и шейки бедренной кости у теплокровных.
1. О состоянии санитарно-эпидемиологического благополучия населения в Российской Федерации в 2019 году: Государственный доклад. Москва: Федеральная служба по надзору в сфере защиты прав потребителей и благо- получия человека, 2020. С. 149–152.
Список литературы
1. World Health Organisation: Tuberculosis. Accessed February 15, 2021. https://www.who.int/health-topics/tuberculosis#tab=tab_1
2. Kwan CK, Ernst JD. HIV and tuberculosis: a deadly human syndemic. Clin Microbiol Rev. 2011;24(2):351–376. doi: 10.1128/CMR.00042-10
3. Bruchfeld J, Correia-Neves M, Källenius G. Tuberculosis and HIV coinfection. Cold Spring Harb Perspect Med. 2015;5(7):a017871. doi: 10.1101/cshperspect.a017871
4. Park M, Satta G, Kon OM. An update on multidrug-resistant tuberculosis. Clin Med (Lond). 2019;19(2):135–139. doi: 10.7861/clinmedicine.19-2-135
5. Jang JG, Chung JH. Diagnosis and treatment of multidrug-resistant tuberculosis. Yeungnam Univ J Med. 2020;37(4):277–285. doi: 10.12701/yujm.2020.00626
6. Аминев Э.Х., Зулькарнаев Т.Р., Аминев Х.К. О влиянии социально-гигиенических, медико-биологических и экологических факторов на заболеваемость туберкулезом // Медицинский вестник Башкортостана. 2013. Т. 8. № 1. С. 5–9.
7. Hunter RL. The pathogenesis of tuberculosis: the early infiltrate of post-primary (adult pulmonary) tuberculosis: a distinct disease entity. Front Immunol. 2018;9:2108. doi: 10.3389/fimmu.2018.02108
8. Hunter RL. The pathogenesis of tuberculosis – the Koch phenomenon reinstated. Pathogens. 2020;9(10):813. doi: 10.3390/pathogens9100813
9. Miggiano R, Rizzi M, Ferraris DM. Mycobacterium tuberculosis pathogenesis, infection prevention and treatment. Pathogens. 2020;9(5):385. doi: 10.3390/pathogens9050385
10. Катола В.Н. К вопросу о заболеваемости туберкулезом в России // Бюллетень физиологии и патологии дыхания. 2017. Вып. 66. С. 29–33. doi: 10.12737/article_5a1f7127250c61.73430341
11. Корначев А.С., Ребещенко А.П., Кальгина Г.А., и др. Оценка результативности мониторинга биологической безопасности труда персонала бюро судебно-медицинской экспертизы в части профилактики внутрибольничного заражения туберкулезом // Инфекция и иммунитет. 2012. Т. 2. Вып. 1-2. С. 222–223.
12. Лискова Е.А., Слинина К.Н., Яшин И.В. Выделение микобактерий из объектов животноводческих помещений // Вестник ветеринарии. 2015. № 4 (75). С. 32–35.
13. Лискова Е.А., Слинина К.Н., Гладкова Н.А. Выделение микобактерий из кормов // Вестн. Алтайского гос. аграр. ун-та. 2017. № 10 (156). С. 135–139.
14. Кисленко В.Н. Экология патогенных микроорганизмов М.: ИНФРА-М, 2016. 226 с.
15. Нуратинов Р.А. Экологические условия существования популяций микобактерий // Юг России: экология, развитие. 2014. Т. 9 (2). С. 18–30.
16. Fontes JA, Barin JG, Talor MV, et al. Complete Freund's adjuvant induces experimental autoimmune myocarditis by enhancing IL-6 production during initiation of the immune response. Immun Inflamm Dis. 2017;5(2):163–176. doi: 10.1002/iid3.155
17. Chung J-I, Barua S, Choi BH, Min B-H, Han HC, Baik EJ. Anti-inflammatory effect of low intensity ultrasound (LIUS) on complete Freund’s adjuvant-induced arthritis synovium. Osteoarthritis Cartilage. 2012;20(4): 314–322. doi: 10.1016/j.joca.2012.01.005
18. Tigno-Aranjuez JT, Jaini R, Tuohy VK, Lehmann PV, Tary-Lehmann M. Encephalitogenicity of complete Freund’s adjuvant relative to CpG is linked to induction of Th17 cells. J Immunol. 2009;183(9):5654–5661. doi: 10.4049/jimmunol.0900645
19. Dubé JY, McIntosh F, Zarruk JG, David S, Nigou J, Behr MA. Synthetic mycobacterial molecular patterns partially complete Freund’s adjuvant. Sci Rep. 2020;10(1):5874. doi: 10.1038/s41598-020-62543-5
20. Кондрашова М.Н., Захарченко М.В., Хундерякова Н.В., Маевский Е.И. Цитобиохимический способ определения активности сукцинатдегидрогеназы, окисления эндогенной янтарной кислоты, сигнального действия микромолярных концентраций янтарной кислоты, его применение для количественной оценки уровня адренергической регуляции в организме, среда и набор для осуществления способа // Патент RU 2364868 C1.
21. Apostуlico JS, Lunardelli VAS, Coirada FC, Boscardin SB, Rosa DS. Adjuvants: classification, modus operandi, and licensing. J Immunol Res. 2016;2016:1459394. doi: 10.1155/2016/1459394
22. Billiau A, Matthys P. Modes of action of Freund’s adjuvants in experimental models of autoimmune diseases. J Leukoc Biol. 2001;70(6):849–860. doi: 10.1189/jlb.70.6.849
Об авторах
С. В. СкупневскийРоссия
Скупневский Сергей Валерьевич – д.б.н., ведущий научный сотрудник лаборатории субклеточных структур отдела молекулярных и клеточных механизмов аутоиммунных заболеваний
ул. Пушкинская, д. 47, г. Владикавказ, 362025, Российская Федерация
Г. М. Трухина
Россия
Трухина Галина Михайловна – д.м.н., проф., заведующая микробиологической лабораторией
ул. Семашко, д. 2, Московская обл., г.п. Мытищи, 141014, Российская Федерация
Е. Г. Пухаева
Россия
Пухаева Елена Георгиевна – младший научный сотрудник лаборатории субклеточных структур отдела молекулярных и клеточных механизмов аутоиммунных заболеваний
ул. Пушкинская, д. 47, г. Владикавказ, 362025, Российская Федерация
А. К. Бадтиев
Россия
Бадтиев Алибек Кирилович – к.б.н., старший научный сотрудник лаборатории субклеточных структур отдела молекулярных и клеточных механизмов аутоиммунных заболеваний
ул. Пушкинская, д. 47, г. Владикавказ, 362025, Российская Федерация
Ф. К. Руруа
Россия
Руруа Фатима Карловна – младший научный сотрудник лаборатории субклеточных структур отдела молекулярных и клеточных механизмов аутоиммунных заболеваний
ул. Пушкинская, д. 47, г. Владикавказ, 362025, Российская Федерация
Ф. Э. Батагова
Россия
Батагова Фатима Эльбрусовна – младший научный сотрудник лаборатории субклеточных структур, аспирант отдела молекулярных и клеточных механизмов аутоиммунных заболеваний
ул. Пушкинская, д. 47, г. Владикавказ, 362025, Российская Федерация
Ж. Г. Фарниева
Россия
Фарниева Жанна Григорьевна – младший научный сотрудник лаборатории субклеточных структур отдела молекулярных и клеточных механизмов аутоиммунных заболеваний
ул. Пушкинская, д. 47, г. Владикавказ, 362025, Российская Федерация
Рецензия
Для цитирования:
Скупневский С.В., Трухина Г.М., Пухаева Е.Г., Бадтиев А.К., Руруа Ф.К., Батагова Ф.Э., Фарниева Ж.Г. К механизму формирования аутоиммунных патологий, обусловленных воздействием инактивированных Mycobacterium tuberculosis. Здоровье населения и среда обитания – ЗНиСО. 2021;29(11):76-82. https://doi.org/10.35627/2219-5238/2021-29-11-76-82
For citation:
Skupnevskiy S.V., Trukhinа G.M., Pukhаevа E.G., Bаdtiev A.K., Ruruа F.K., Bаtаgovа F.E., Fаrnievа Zh.G. On the mechanism of development of autoimmune diseases following exposure to inactivated Mycobacterium tuberculosis. Public Health and Life Environment – PH&LE. 2021;29(11):76-82. (In Russ.) https://doi.org/10.35627/2219-5238/2021-29-11-76-82









.png)



























