Перейти к:
К вопросу обоснования максимальных недействующих концентраций полициклических ароматических углеводородов в крови детей и подростков по критериям их гормонального профиля
https://doi.org/10.35627/22195238/2024-32-12-48-55
Аннотация
Введение. Полициклические ароматические углеводороды (полиарены) как эндокринные дизрапторы влияют на экскрецию гормонов щитовидной железы. Для оценки нарушений функции щитовидной железы при воздействии полиаренов исследуется уровень тиреотропных гормонов в крови.
Цель исследования: изучение зависимостей уровня гормонов щитовидной железы от концентрации полициклических ароматических углеводородов в крови, обоснование их максимальных недействующих концентраций в крови детей и подростков по критериям тиреоидного профиля.
Материалы и методы. В рамках пилотного проекта в 2022–2023 гг. проведены комплексные химико-аналитические и клинико-лабораторные исследования образцов крови детей 4–14 лет (n = 81), анализ проб воздуха на территориях наличия и отсутствия аэрогенных экспозиций. Изучение зависимостей уровня гормонов и антител в сыворотке крови детей и подростков от концентрации ПАУ в крови проводили методом регрессионного анализа. Максимальную недействующую концентрацию маркера экспозиции определяли как верхнюю 95% доверительную границу экспоненциальной модели.
Результаты. На территории наблюдения установлено достоверно более высокое (p ≤ 0,05) содержание полиаренов – в воздухе в 1,7–2,8 раза и в крови детей в 3,5–9,9 раза. Уровень тиреотропного гормона в крови в 1,1–1,4 раза выше нормы и содержание йода ниже нормы в 1,2–3,4 раза в моче детей группы наблюдения. По критерию содержания тиреотропного гормона установлены максимальные недействующие концентрации нафталина, антрацена и пирена в крови детей и подростков.
Обсуждение. Зависимости «маркер экспозиции – маркер ответа» отражают характер действия токсикантов на функцию щитовидной железы. Максимальные недействующие концентрации полиаренов в крови детей и подростков позволяют оценить риск воздействия на здоровье в условиях аэрогенной экспозиции.
Заключение. По критерию экспрессии тиреотропного гормона установлены максимальные недействующие концентрации полиаренов в крови детей 4–14 лет, рекомендуемые в качестве критериев безопасности при хроническом воздействии полиаренов.
Ключевые слова
Для цитирования:
Нурисламова Т.В., Долгих О.В., Карнажицкая Т.Д., Старчикова М.О., Пермякова Т.С. К вопросу обоснования максимальных недействующих концентраций полициклических ароматических углеводородов в крови детей и подростков по критериям их гормонального профиля. Здоровье населения и среда обитания – ЗНиСО. 2024;32(12):48-55. https://doi.org/10.35627/22195238/2024-32-12-48-55
For citation:
Nurislamova T.V., Dolgikh O.V., Karnazhitskaya T.D., Starchikova M.O., Permyakova T.S. On Substantiation of Maximum No-Effect Blood Concentrations of Polycyclic Aromatic Hydrocarbons in Children and Adolescents Based on Their Hormone Profile Criteria. Public Health and Life Environment – PH&LE. 2024;32(12):48-55. (In Russ.) https://doi.org/10.35627/22195238/2024-32-12-48-55
Введение. Одной из основных задач социальной политики Российской Федерации является сохранение населения, укрепление здоровья и повышение благополучия людей1. Современный подход к решению этой задачи основан на методологии анализа риска для здоровья человека, в рамках которой большое внимание уделяется биологическим маркерам, отражающим факт воздействия (экспозиции) и развития эффектов в виде негативных ответных реакций [1].
Полициклические ароматические углеводороды (полиарены, ПАУ) – стойкие органические загрязнители окружающей среды, эндокринные дизрапторы, представляют собой группу органических соединений, состоящих из двух и более конденсированных бензольных колец. Основным источником поступления смеси ПАУ в атмосферный воздух являются высокотемпературные процессы антропогенного и природного происхождения (промышленное производство, сжигание органического топлива, выбросы автотранспорта, приготовление пищи, табакокурение, лесные пожары, вулканическая активность и др.) [2].
Повсеместное присутствие смеси ПАУ в атмосферном воздухе представляет потенциальную угрозу для здоровья человека. Хроническое воздействие низкомолекулярных ПАУ на человека происходит ингаляционным путем. Согласно зарубежным исследованиям, действие ПАУ на человека связано с повышенным уровнем заболеваний, сахарным диабетом, эндокринными расстройствами [3–7].
Щитовидная железа – ключевой орган эндокринной платформы человека. Гормоны трийодтиронин (Т3), тетрайодтиронин (тироксин, Т4), вырабатываемые щитовидной железой, влияют на обмен веществ, функционирование нервной, сердечно-сосудистой и репродуктивной систем, оказывают влияние на рост и развитие [8–9]. Исследования in vitro показали, что ПАУ и гидроксипроизводные ПАУ взаимодействуют с рецептором гормонов щитовидной железы, с белками, транспортирующими тиреоидные гормоны, и ферментами, участвующими в синтезе и инактивации гормонов щитовидной железы [10–12]. Автор Peng F. и соавт. в исследованиях на животных показали, что ПАУ оказывают влияние на уровень гормонов щитовидной железы, различные ПАУ и их гидроксипроизводные могут проявлять агонистическую и антагонистическую активность по отношению к продукции гормонов [13]. Автор Yang Z. и соавт. при изучении зависимости объема щитовидной железы от содержания гидроксилированных полициклических ароматических углеводородов (ОН-ПАУ) в моче обнаружили, что увеличение объема щитовидной железы положительно связано с повышением суммарной концентрации OH-ПАУ в моче [14]. Автор Amber L. и соавт. при оценке связи между содержанием гидроксилированных ПАУ (ОН-ПАУ) в моче и гормонов в сыворотке крови беременных установили положительную ассоциацию между ОН-ПАУ и гормоном T3 и соотношением T3 к T4 [15]. Автор Sobhani P. и соавт. в результате изучения связи метаболитов ПАУ в моче с уровнем гормонов щитовидной железы у детей и подростков обнаружили значительную положительную корреляцию между метаболитами ПАУ в моче и ТТГ в крови (P < 0,05). Автор предположил, что длительное воздействие ПАУ может привести к нарушению функции щитовидной железы [16].
Таким образом, уровень гормонов щитовидной железы в крови может быть применен для оценки эндокринных нарушений в условиях аэрогенной экспозиции полициклическими ароматическими углеводородами. В настоящее время опубликованные работы касаются изолированного или одновременного комбинированного воздействия смесей ПАУ на население, но отсутствуют данные о максимальных допустимых концентрациях ПАУ в крови детей.
Цель исследований – изучение зависимостей уровня гормонов щитовидной железы от концентрации полициклических ароматических углеводородов в крови, обоснование их максимальных недействующих концентраций в крови детей и подростков по критериям тиреоидного профиля.
Материалы и методы. В рамках пилотного проекта в период 2022–2023 гг. проведен анализ полициклических ароматических углеводородов (нафталин (С10Н8, CAS № 91-20-3), 2-метилнафталин (C11H10, CAS № 91-57-6), антрацен (С14Н10, CAS № 120-12-7), 9-метилантрацен (C15H12, CAS № 779-02-2), пирен (C16H10, CAS № 129-00-0), бенз(а)пирен (C20H12, CAS № 50-32-8) в атмосферном воздухе на селитебных территориях вблизи расположения предприятий черной и цветной металлургии (территория наблюдения) и на условно чистой селитебной территории с отсутствием металлургических и других промышленных предприятий (территория сравнения) проводили методом высокоэффективной жидкостной хроматографии с флуориметрическим детектированием (ВЭЖХ/ФЛД). Нижний предел обнаружения ПАУ при отборе разовых проб воздуха составляет 0,00004–0,0001 мкг/м3 с погрешностью определения не более 25 %. Среднесуточные концентрации ПАУ в воздухе рассчитывали как среднее арифметическое разовых проб, отобранных в течение суток.
С целью обоснования максимальных недействующих концентраций ПАУ проведены химико-аналитические и клинико-лабораторные исследования образцов крови детей и подростков в возрасте 4–14 лет (n = 81), проживающих в условиях аэрогенных экспозиций (n = 59) и на условно чистой территории (n = 22).
Изучение зависимостей (y = b0x + b1) уровня гормонов и антител в сыворотке крови детей и подростков от концентрации ПАУ в крови проводили методом регрессионного анализа.
Исследование одобрено Локальным этическим комитетом ФБУН «ФНЦ медико-профилактических технологий управления рисками здоровью населения» (выписка из протокола заседания № 4 от 24.02.2022). От каждого законного представителя ребенка, включенного в выборку, получено письменное добровольное информированное согласие на добровольное участие в биомедицинском исследовании.
В качестве маркеров экспозиции определяли содержание в крови полициклических ароматических углеводородов (нафталин, 2-метилнафталин, антрацен, 9-метилантрацен, пирен, бенз(а)пирен) методом ВЭЖХ/ФЛД на жидкостном хроматографе (Shimadzu, Япония) в соответствии с методикой ФР.1.31.2024.48308. Степень извлечения ПАУ из образцов крови способом жидкостной экстракции ацетонитрилом в присутствии высаливателя с предварительным подщелачиванием проб составляет от 78 % для бенз(а)пирена до 95 % для антрацена. Диапазон измеряемых концентраций нафталина в крови составляет 0,0001–0,01 мкг/см3, 2-метилнафталина 0,00005–0,005 мкг/см3, антрацена и 9-метилантрацена 0,000005–0,0016 мкг/см3, пирена 0,000025–0,011 мкг/см3, бенз(а)пирена 0,000005–0,0019 мкг/см3. Относительная погрешность измерения 30–32 %. Обработку результатов хроматографического анализа проводили с применением программного продукта LabSolution (Shimadzu, Япония). Отбор и анализ биологических проб проводился в период с февраля по май 2023 г.
В качестве маркеров ответа при ингаляционном поступлении полициклических ароматических углеводородов изучены показатели тиреоидного статуса у детей и подростков (содержание свободного тетрайодтиронина (тироксин, Т4 свободный), тиреотропного гормона (ТТГ), антител к тиреопероксидазе (АТ к ТПО), антител к тиреоглобулину (АТ к ТГ) в сыворотке крови) методом иммуноферментного анализа с использованием фотометра Elx808IU (BioTek, США)2. Содержание йода в моче определяли церий-арсенитовым методом на спектрофотометре СФ 5400-ПЭ, (Экрос, Россия) [17]. В качестве физиологической нормы содержания тироидных гормонов и антител в сыворотке крови приняты значения, рекомендуемые в используемых для их определения тестах ООО «ХЕМА»2, физиологическая норма уровня йода в моче не менее 10 мкг/см3 [18]. Исследования проведены в период с февраля по май 2023 г.
Обоснование маркеров ответа выполняли по расчету отношения шансов (Odds Ratio, OR), характеризующего связь между концентрацией ПАУ в крови и вероятностью отклонения маркера ответа от нормы. Критерием наличия связи принимали условие OR > 13.
Установление параметров зависимости показателя отношения шансов от концентрации ПАУ в крови проводили методом построения регрессионной модели в виде экспоненциальной функции OR = ea0–a1x, где OR – эпидемиологический показатель, характеризующий связь ответа с воздействием; x – концентрация ПАУ в крови, мкг/см3; a0, a1 – параметры модели, определяемые методом регрессионного анализа. Достоверность полученной модели оценивали при проведении однофакторного дисперсионного анализа по критерию Фишера (F).
Максимальную недействующую концентрацию определяли исходя из условия OR = 1. В качестве максимальной недействующей концентрации принимали величину, соответствующую верхней 95 % доверительной границе полученной модели при OR =13.
Статистическую обработку полученных данных проводили в 2024 г. с использованием программных продуктов, разработанных специалистами отдела математического моделирования систем и процессов ФБУН «ФНЦ медико-профилактических технологий управления рисками здоровью населения». Качество полученных моделей оценивалось с использованием коэффициента детерминации (R2) и критерия Фишера (F > 3,63). Значимость зависимостей оценивалась по критерию Стьюдента при p ≤ 0,05.
Ограничения исследования. В рамках пилотного проекта приведены результаты исследований концентраций тиреотропных гормонов и антител только для 59 детей, проживающих в селитебной зоне предприятия, и 22 детей в регионе сравнения. При этом не обсуждалось биологическое значение исследуемых показателей «антитела к тиреопероксидазе» и «антитела к тиреоглобулину», гормонов в сыворотке крови. Исследование проводилось в период с февраля по май 2023 года. В другие периоды года гормональный статус детей не оценивался. В дальнейших исследованиях будут учтены возрастные нормы для исследуемых в данном проекте показателей с уточнением сезонности года.
Результаты. Анализ ПАУ в атмосферном воздухе на территориях сравнения и наблюдения показал отсутствие превышений максимально разовых и среднесуточных предельно допустимых концентраций (ПДК)4 по всем изучаемым соединениям. Вместе с тем на территории наблюдения при разовых отборах обнаружено присутствие нафталина, 2-метилнафталина пирена и бенз(а)пирена в 100 % проб в диапазоне концентраций 0,00014 · 10–3 … 0,00075 · 10–3 мг/м3, антрацена и 9-метилантрацена в 25 % проб на уровне нижнего предела обнаружения при разовых отборах 0,00007 · 10–3 мг/м3. На территории сравнения обнаружены пирен и бенз(а)пирен в 25 % проб в диапазоне концентраций 0,00008 · 10–3 … 0,00013 · 10–3 мг/м3. Среднеарифметические значения среднесуточных концентраций ПАУ в атмосферном воздухе территорий наблюдения и сравнения, рассчитанных по результатам анализа разовых проб, представлены в табл. 1. Достоверно более высокие концентрации (р < 0,05) определяемых соединений установлены на территории расположения предприятий металлургической промышленности (территория наблюдения) в 1,7–2,8 раза. Из всех полиароматических углеводородов ориентировались на наименьшую концентрацию, которая будет гарантировать безопасность атмосферного воздуха для здоровья населения, в т. ч. и для детского.
В табл. 2 приведены среднегрупповые концентрации полициклических ароматических углеводородов, обнаруженных в образцах крови детей и подростков групп наблюдения и сравнения (M ± m). В группе наблюдения обнаружены все определяемые ПАУ в диапазоне концентраций от 0,00001 до 0,00681 мкг/см3, присутствующие в 11,8–98,3 % от всех проанализированных проб (n = 59). В группе сравнения обнаружены 3 из 6 определяемых аналитов в диапазоне концентраций от 0,000005 до 0,00031 мкг/см3, присутствующих в 81,8–95,4 % от общего количества проб (n = 22). В группе наблюдения максимальная среднеарифметическая концентрация обнаружена для пирена (0,00137 ± 0,00037) мкг/см3, минимальное содержание (0,0000044 ± 0,0000033) мкг/см3 – для бенз(а)пирена. В группе сравнения максимальная среднеарифметическая концентрация в крови (0,000138 ± 0,000041) мкг/см3 установлена по пирену, минимальная (0,00001 ± 0,000003) мкг/см3 – по антрацену.
Чаще других и в более высоких концентрациях, присутствующим в образцах крови детей и подростков в группах наблюдения и сравнения, обнаружен пирен, что согласуется с результатами аналогичных исследований [19][20]. В целом установлено достоверно более высокое (p < 0,05) содержание антрацена в 3,5 раза, 9-метилантрацена в 5 раз и пирена в 9,9 раза в крови детей и подростков в группе наблюдения по отношению к группе сравнения. Нафталин, 2-метилнафталин и бенз(а)пирен в крови детей группы сравнения не обнаружены ни в одной пробе.
В табл. 3 представлены результаты исследований тиреоидного статуса (ТТГ, Т4 свободный, АТ к ТГ, АТ к ТТГ), а также йодной обеспеченности (йод в моче) у детей и подростков и нормативные значения данных показателей по возрастным группам, представленных в источнике2.
В группе наблюдения установлено более высокое в 1,1–1,4 раза по сравнению с нормой содержание ТТГ у 15 % обследованных детей, диапазон концентраций составил 1,04–5,47 мкМЕ/см3; определено более низкое по сравнению с нормативным показателем в 1,2–3,4 раза содержание йода в моче в 77,8 % проб, диапазон концентраций составил 2,93–13,54 мкг/100 см3. В группе сравнения содержание ТТГ в крови детей выше физиологической нормы в 1,06–1,3 раза установлено в 7,5 % проб, содержание на уровне 0,41–6,88 мкМЕ/см3; определено более низкое в 1,3–1,4 раза содержание йода в моче по отношению к норме в 55 % проб в диапазоне обнаруженных концентраций 6,97–22,33 мкг/100 см3. По остальным показателям полученные значения определены в пределах нормативных рамок.
Сравнение показателей в изучаемых группах детей показало достоверно более высокое (р < 0,05) содержание гормона Т4 свободного в сыворотке крови детей группы наблюдения в 1,2 раза. По остальным показателям достоверных различий между группами наблюдения и сравнения не установлено.
С целью выявления приоритетных для детального исследования причинно-следственных связей проведен предварительный регрессионный анализ зависимостей (y = b0x + b1) между содержанием индивидуальных ПАУ в крови и уровнем гормонов и антител в сыворотке крови детей и подростков. Анализ достоверности полученных аппроксимаций показал статистически значимые модели зависимости повышения концентрации ТТГ от повышения содержания в крови нафталина (R2 = 0,19; F = 6,65; р < 0,05), 2-метилнафталина (R2 = 0,22; F = 11,3; р < 0,01), антрацена (R2 = 0,19; F = 8,20; р < 0,01) и пирена (R2 = 0,13; F = 5,24; р < 0,05). Повышение содержания гормона Т4 свободного в сыворотке крови связан с увеличением концентрации в крови нафталина (R2 = 0,14; F = 6,74; р < 0,05) и 2-метилнафталина (R2 = 0,17; F = 7,62; р < 0,01). Повышение количества антител к тиреоглобулину в сыворотке крови связано с повышением концентрации в крови 2-метилнафталина (R2 = 0,54; F = 10,73; р < 0,01), антрацена (R2 = 0,48; F = 11,21; р < 0,01), 9-метилантрацена (R2 = 0,30; F = 4,77; р = 0,05), пирена (R2 = 0,49; F = 9,43; р < 0,05), при повышении концентрации нафталина в крови содержание АТ к ТГ в сыворотке снижается (R2 = 0,30; F = 5,17; р < 0,05). Повышение количества антител к тиреоидной пероксидазе в сыворотке зависит от увеличения концентрации нафталина в крови (R2 = 0,65; F = 18,7; р < 0,01). Снижение числа АТ к ТПО в сыворотке зависит от повышения содержания 9-метилантрацена (R2 = 0,31; F = 5,04; р < 0,05) и пирена (R2 = 0,44; F = 6,30; р < 0,05) в крови. Анализ содержания йода в моче в зависимости от концентраций ПАУ в крови выявил тенденцию к понижению концентрации йода с повышением всех изучаемых ПАУ в крови, что свидетельствует о недостатке в организме микроэлемента, необходимого для синтеза тироксина. Статистически значимые зависимости не установлены.
По критерию содержания ТТГ в сыворотке крови установлены максимальные недействующие концентрации для нафталина, антрацена и пирена в образцах крови детей и подростков в возрасте 4–14 лет (табл. 4).
Отношение шансов повышения содержания ТТГ в сыворотке с увеличением концентрации нафталина, антрацена, пирена в крови описывается уравнениями вида OR = e-2,97–0,003х, OR = e-2,10–14903х и OR = e-2,31–3172х соответственно. Установлена 95 %-я верхняя доверительная граница максимальных недействующих концентраций нафталина, антрацена и пирена в крови, которая составила 0,000178; 0,000020 и 0,000808 мкг/см3 соответственно. На рисунке показана зависимость показателя отношения шансов (OR) повышения уровня ТТГ с увеличением концентрации пирена в образцах крови обследуемой группы детей.
Таблица 1. Результаты определения ПАУ в атмосферном воздухе на территориях наблюдения и сравнения (при р ≤ 0,05)
Table 1. Results of measuring PAH concentrations in ambient air of the observation and reference areas (at p ≤ 0.05)
|
Наименование вещества / Name of substance |
Среднеарифметические значения среднесуточных концентраций, мг/м3 / Arithmetic mean of average daily concentrations, mg/m3 |
||
|
ПДКмр / ПДКсс / ОБУВ / MAC-max one-time / MACdaily.average / Estimated safe exposure level |
Территория наблюдения / Observation area |
Территория сравнения / Reference area |
|
|
Нафталин / Naphthalene |
0,007 / – / – |
0,00016 × 10–3 |
0 |
|
2-Метилнафталин / 2-Methylnaphthalene |
– / – / 0,02 |
0,00020 × 10–3 |
0 |
|
Антрацен / Anthracene |
– / – / 0,01 |
0,00004 × 10–3 |
0 |
|
9-Метилантрацен / 9-Methylanthracene |
– |
0,00006 × 10–3 |
0 |
|
Пирен / Pyrene |
– / – / 0,001 |
0,00042 × 10–3 |
0,00015 × 10–3 |
|
Бенз(а)пирен / Benzo(a)pyrene |
– / 0,001 × 10–3 / – |
0,00021 × 10–3 |
0,00012 × 10–3 |
Таблица 2. Результаты анализа ПАУ в образцах крови детей и подростков групп наблюдения и сравнения (р ≤ 0,05)
Table 2. Results of measuring blood concentrations of polycyclic aromatic hydrocarbons in children and adolescents from the observation and reference groups (at p ≤ 0.05)
|
Наименование вещества / Name of substance |
Среднегрупповая концентрация ПАУ в крови, мкг/см3 / Mean group concentration of PAHs in blood, μg/cm3 |
|||
|
Группа наблюдения / Observation group |
Группа сравнения / Reference group |
|||
|
M ± m |
% проб с присутствием аналита / % of samples containing the analyte |
M ± m |
% проб с присутствием аналита / % of samples containing the analyte |
|
|
Нафталин / Naphthalene |
0,00035 ± 0,00017 |
57,6 |
0 |
0 |
|
2-Метилнафталин / 2-Methylnaphthalene |
0,00099 ± 0,00015 |
96,6 |
0 |
0 |
|
Антрацен / Anthracene |
0,000035 ± 0,000007 |
98,3 |
0,000010 ± 0,000003 |
81,8 |
|
9-Метилантрацен / 9-Methylanthracene |
0,000195 ± 0,000042 |
96,6 |
0,000039 ± 0,000006 |
95,4 |
|
Пирен / Pyrene |
0,00137 ± 0,00037 |
89,8 |
0,000138 ± 0,000041 |
95,4 |
|
Бенз(а)пирен / Benzo(a)pyrene |
0,0000044 ± 0,0000003 |
11,8 |
0 |
0 |
Таблица 3. Среднегрупповые значения (M ± m) показателей, характеризующих функцию щитовидной железы детей и подростков
Table 3. Mean group values (M ± m) of indicators showing the thyroid function of children and adolescents
|
Показатель / Indicator |
Норма2 / Norm2 |
Группа наблюдения / Observation group |
Группа сравнения / Comparison group |
р* |
|
ТТГ, мкМЕ/см3 / TSH, μIU/cm3 |
0,3–4,0 |
2,74 ± 0,35 |
2,32 ± 0,28 |
>0,05 |
|
Т4 свободный, пмоль/дм3 / Free T4, pmol/dm3 |
10–25 |
15,41 ± 0,83 |
13,13 ± 1,43 |
<0,05 |
|
АТ к ТГ, МЕ/см3 / AT to TG, IU/cm3 |
0–100 |
5,76 ± 1,67 |
7,85 ± 1,28 |
>0,05 |
|
АТ к ТПО, МЕ/см3 / AT to TPO, IU/cm3 |
0–30 |
4,89 ± 0,91 |
4,71 ± 1,23 |
>0,05 |
|
Йод в моче, мкг/100 см3 / Iodine in urine, μg/100 cm3 |
10–50 |
7,54 ± 2,68 |
11,26 ± 3,65 |
>0,05 |
Таблица 4. Параметры математических моделей зависимости «концентрация нафталина, антрацена и пирена в крови – отношение шансов (OR = ea0–a1x) отклонения ТТГ от нормы»
Table 4. Parameters of mathematical models of the relationship between blood concentrations of naphthalene, anthracene, and pyrene and the odds ratio (OR = ea0–a1x) of abnormal TSH levels
|
Маркер экспозиции / Marker of exposure |
Параметры модели / Model parameters |
Критерий Фишера (F) / Fisher’s criterion (F) |
Достоверность (p) / Reliability, (p) |
R2 |
Концентрация ПАУ в крови*, мг/дм3 / PAH concentration in blood, mg/dm3 |
|
|
a0 |
a1 |
|||||
|
Нафталин / Naphthalene |
–2,97 |
0,003 |
34,9 |
<0,05 |
0,59 |
0,000178 |
|
Антрацен / Anthracene |
–2,10 |
14903 |
52,4 |
<0,01 |
0,65 |
0,000020 |
|
Пирен / Pyrene |
–2,31 |
3172 |
20,8 |
<0,01 |
0,50 |
0,000808 |
*– концентрация, соответствующая верхней 95 % доверительной границы модели при OR = l.
* concentration corresponding to the upper 95 % confidence limit of the model at OR = l.
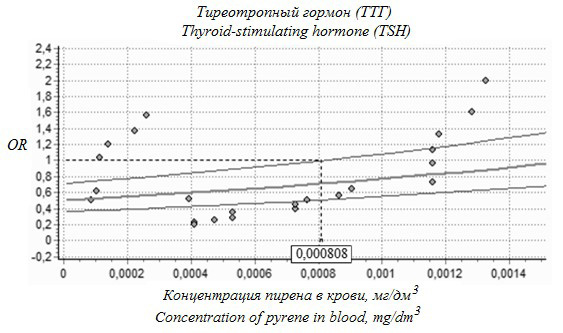
Рисунок. Зависимость показателя отношения шансов (OR) повышения уровня ТТГ с увеличением концентрации пирена в крови
Figure. Relationship between an increase in the blood pyrene concentration and the odds ratio (OR) of an increase in TSH levels
Обсуждение. В период иследований превышений ПДК ПАУ в атмосферном воздухе не установлено, вместе с тем их совместное действие дает эффективность на изменение показателей щитовидной железы. Точный механизм действия ПАУ на щитовидную железу недостаточно изучен. В целом в исследованиях, изучающих связь воздействия ПАУ на уровень гормонов щитовидной железы среди населения, получены различные результаты корреляций в зависимости от состава определяемых в биологических средах (кровь, моча) ПАУ (маркеров экспозиции), возраста, пола и ряда других показателей. Так, результаты исследований Yang S. и соавт. по изучению связей между содержанием метаболитов ПАУ в моче и уровнем гормонов щитовидной железы у подростков и взрослых показали, что у подростков комбинированное воздействие 8 метаболитов ПАУ отрицательно коррелировало с ТТГ, а корреляции ПАУ – ТГ были противоречивыми между подростками и взрослыми [21].
В представленном исследовании по определению содержания индивидуальных ПАУ в образцах крови детей и подростков наблюдалось преобладание пирена над другими соединениями данной химической группы (2-метилнафталина, нафталина, антрацена, 9-метилантрацена, бенз(а)пирена). Полученные результаты согласуются с аналогичными показателями, представленными в публикациях [21][22].
В зарубежных источниках опубликованы отдельные данные о связи между содержанием ПАУ в крови, нарушающих работу эндокринной системы, с уровнем гормонов щитовидной железы в детской и подростковой возрастных группах. Большая часть публикаций посвящена изучению влияния ПАУ на гормональную систему взрослого населения, животных и в условиях in vitro [13][23–28].
В представленном исследовании рассмотрено влияние ряда ПАУ и метилпроизводных ПАУ на функцию щитовидной железы у детей и подростков в возрасте 4–14 лет. Установлено повышение уровня гормона Т4 свободного с повышением концентрации нафталина и 2-метилнафталина в крови. В результате проведенных исследований показано, что тиреотропный гормон ТТГ положительно ассоциируется с нафталином, 2-метилнафталином, антраценом и пиреном. Повышение уровня ТТГ в сыворотке соответствует снижению продукции свободного Т4 при наличии антрацена. Нафталин и 2-метилнафталин усиливают выработку гормона Т4 свободного на фоне повышения уровня ТТГ. Увеличение количества антител к ТПО в представленных исследованиях положительно связано с концентрацией нафталина, снижение АТ к ТПО наблюдается при повышении концентраций 9-метилантрацена и пирена в образцах крови. Повышенный уровень антител к тиреопероксидазе характерен при наличии в организме аутоиммунных заболеваний щитовидной железы. В проведенном исследовании уровень антител к тиреоглобулину повышается с увеличением концентрации 2-метилнафталина, антрацена, 9-метилантрацена и пирена в крови детей. Антитела к тиреоглобулину являются индикатором аутоиммунного поражения щитовидной железы. Высокий уровень в крови АТ к ТПО и АТ к ТГ может быть связан с повышенным риском развития гипотиреоза – снижения выработки тиреоидных гормонов.
Низкий или умеренный уровень корреляции (r в пределах 0,1–0,5) может свидетельствовать о наличии слабой или умеренной связи между признаками, что имеет значение при исследовании сложных явлений, например, в медико-биологических исследованиях. ПАУ, являясь ксенобиотиками, оказывают многоуровневое воздействие на организм через эндокринные, иммунные и биохимические механизмы, что затрудняет фиксирование тесной линейной зависимости. Высокие значения корреляций свидетельствовали бы о прямой связи между содержанием ПАУ и концентрацией гормонов, в то время как существует множество других факторов, которые обуславливают различный гормональный уровень при одних и тех же концентрациях, уменьшая коэффициент корреляции. Обнаруженные в представленной работе значения r от 0,13 до 0,49 согласуются с литературными данными, статистически значимы и типичны для исследований, направленных на выявление потенциальных рисков воздействия ПАУ.
Полученные зависимости согласуются с результатами исследования Kelishadi R. и соавт. по изучению влияния гидроксипроизводных полициклических ароматических углеводородов на гормоны щитовидной железы у детей [29]. Авторы отмечают значительную положительную корреляцию между уровнями метаболитов нафталина, пирена, фенантрена и гормонами Т4 свободным и ТТГ в группе школьников в возрасте 6–18 лет (R2 = 0,42–0,87; р < 0,001). В наших исследованиях положительная корреляция получена между концентрациями нафталина и 2-метилнафталина в крови и Т4 свободным (R2 = 0,14–0,17; р < 0,05), а также между содержанием нафталина, 2-метилнафталина, антрацена и пирена в образцах крови и уровнем ТТГ в сыворотке (R2 = 0,22–0,63; р < 0,05) в группе детей в возрасте 4–14 лет.
Поиск по доступным реферативным базам данных не позволил выявить научную литературу, описывающую у детей связь ПАУ с уровнем антител к гормонам щитовидной железы (АТ к ТПО и АТ к ТГ), которые являются индикаторами аутоиммунного поражения щитовидной железы. В данном исследовании подтверждается связь повышения уровня антител к ТПО с увеличением в крови концентрации нафталина, а также повышения количества антител к ТГ с увеличением в образцах крови 2-метилнафталина, антрацена, 9-метилантрацена и пирена.
В результате проведенных исследований получены максимальные недействующие концентрации нафталина, антрацена и пирена в образцах крови детей по критерию экспрессии тиреотропного гормона. Полученные данные могут быть использованы для оценки риска воздействия полициклических ароматических углеводородов на эндокринную систему детей и подростков в условиях аэрогенного воздействия.
Заключение. Настоящее исследование проведено с целью оценки влияния ПАУ на уровень гормонов щитовидной железы и установления максимальных недействующих концентраций ПАУ в крови по критериям тиреоидного профиля детей и подростков в условиях аэрогенных экспозиций. Получены достоверные регрессионные модели индивидуального воздействия ПАУ, ассоциированного с уровнем показателей тиреоидного профиля (F = 4,77–18,7; p ≤ 0,05). Установлены максимальные недействующие концентрации полициклических ароматических углеводородов в крови детей и подростков по критерию экспрессии тиреотропного гормона. Установленные максимальные недействующие концентрации полициклических ароматических углеводородов в крови могут быть рекомендованы в качестве критериев безопасности при хроническом воздействии в рамках проведения биомониторинга, при оценке рисков здоровью детского населения.
1 Указ Президента Российской Федерации от 7 мая 2024 года № 309 «О национальных целях развития Российской Федерации на период до 2030 года и на перспективу до 2036 года».
2 Тест для определения свободного тироксина в сыворотке (плазме) крови «свТ4-ИФА», кат. № REF K214, ТУ №9398-214-18619450-2011, рег. удостоверение № ФСР 2011/11006 от 09.06.2011 г.; тест для определения тиреотропного гормона в сыворотке (плазме) крови «ТТГ-ИФА» кат. № REF K201, ТУ № 9398-201-18619450-2010, рег. удостоверение, № ФСР 2007/00665 от 25.10.2010 г.; тест для определения аутоантител к тиреопероксидазе в сыворотке (плазме) крови «АТ – ТПО – ИФА», кат. № REF K131, ТУ № 9398-131-18619450-2010, рег. удостоверение № ФСР 2009/04489 от 11.06.2010 г.; тест для определения аутоантител к тиреоглобулину в сыворотке (плазме) крови «АТ-ТГ-ИФА» кат. № REF K132, ТУ № 9398-132-18619450-2010, рег. удостоверение, № ФСР 2008/03115 от 11.06.2010 г.
3 МР 2.1.10.0062–12 «Количественная оценка неканцерогенного риска при воздействии химических веществ на основе построения эволюционных моделей: методические рекомендации». М.: Федеральный центр гигиены и эпидемиологии Роспотребнадзора, 2013. 35 с.
4 СанПиН 1.2.3685–21 «Гигиенические нормативы и требования к обеспечению безопасности и (или) безвредности для человека факторов среды обитания».
Список литературы
1. Онищенко Г.Г., Зайцева Н.В., Май И.В. Анализ риска здоровью в стратегии государственного социально-экономического развития: монография. Пермь, 2024. 738 с.
2. Hussain K, Hoque R, Balachandran S, et al. Monitoring and risk analysis of PAHs in the environment. In: Hussain K, ed. Handbook of Environmental Materials Management. Springer, Cham; 2018:1–35. doi: 10.1007/978-3-319-58538-3_29-2
3. Yin W, Hou J, Xu T, et al. Obesity mediated the association of exposure to polycyclic aromatic hydrocarbon with risk of cardiovascular events. Sci Total Environ. 2018;616–617:841–854. doi: 10.1016/j.scitotenv.2017.10.238
4. Liao D, Xiong S, An S, et al. Association of urinary polycyclic aromatic hydrocarbon metabolites with gestational diabetes mellitus and gestational hypertension among pregnant women in Southwest China: A cross-sectional study. Environ Pollut. 2024;343:123206. doi: 10.1016/j.envpol.2023.123206
5. Park S, Siwakoti RC, Ferguson KK, et al. Associations of urinary polycyclic aromatic hydrocarbon (PAH) metabolites and their mixture with thyroid hormone concentration during pregnancy in the LIFECODES cohort: A repeated measures study. Environ Res. 2024;255:119205. doi: 10.1016/j.envres.2024.119205
6. Mallah MA, Basnet TB, Ali M, et al. Association between urinary polycyclic aromatic hydrocarbon metabolites and diabetes mellitus among the US population: A cross-sectional study. Int Health. 2023;15(2):161–170. doi: 10.1093/inthealth/ihac029
7. Dehghani S, Fararouei M, Rafiee A, Hoepner L, Oskoei V, Hoseini M. Prenatal exposure to polycyclic aromatic hydrocarbons and effects on neonatal anthropometric indices and thyroid-stimulating hormone in a Middle Eastern population. Chemosphere. 2022;286(Pt 1):131605. doi: 10.1016/j.chemosphere.2021.131605
8. Mullur R, Liu YY, Brent GA. Thyroid hormone regulation of metabolism. Physiol Rev. 2014;94(2):355–382. doi: 10.1152/physrev.00030.2013
9. Vondráček J, Pivnička J, Machala M. Polycyclic aromatic hydrocarbons and disruption of steroid signaling: History, recent advances and open questions. Curr Opin Toxicol. 2018;11–12:27–34. doi: 10.1016/j.cotox.2018.12.003 10. Bekki K, Takigami H, Suzuki G, Tang N, Hayakawa K. Evaluation of toxic activities of polycyclic aromatic hydrocarbon derivatives using in vitro bioassays. J Health Sci. 2009;55(4):601–610. doi: 10.1248/jhs.55.601
10. Sun H, Shen OX, Xu XL, Song L, Wang XR. Carbaryl, 1-naphthol and 2-naphthol inhibit the beta-1 thyroid hormone receptor-mediated transcription in vitro. Toxicology. 2008;249(2-3):238–242. doi: 10.1016/j.tox.2008.05.008
11. Song M, Kim YJ, Park YK, Ryu JC. Changes in thyroid peroxidase activity in response to various chemicals. J Environ Monit. 2012;14(8):2121–2126. doi: 10.1039/c2em30106g
12. Peng FJ, Palazzi P, Viguié C, Appenzeller B. Measurement of hair thyroid and steroid hormone concentrations in the rat evidence endocrine disrupting potential of a low dose mixture of polycyclic aromatic hydrocarbons. Environ Pollut. 2022;313:120179. doi: 10.1016/j.envpol.2022.120179
13. Yang Z, Chen S, Zhou S, et al. Association of polycyclic aromatic hydrocarbon internal exposure and urinary iodine concentration with thyroid volume in children. Environ Pollut. 2023;331(Pt 1):121912. doi:10.1016/j. envpol.2023.121912
14. Cathey AL, Watkins DJ, Rosario ZY, et al. Polycyclic aromatic hydrocarbon exposure results in altered CRH, reproductive, and thyroid hormone concentrations during human pregnancy. Sci Total Environ. 2020;749:141581. doi:10.1016/j.scitotenv.2020.141581
15. Sobhani P., Hashemipour M. Relationship of urinary metabolites of polycyclic aromatic hydrocarbons with thyroid hormone levels among a sample of Iranian children and adolescents / Environ Sci Pollut Res Int. 2018. https://elib.mui.ac.ir/multiMediaFile/2428481-4-1.pdf.
16. Wawschinek O, Eber O, Petek W. Bestimmung der Hamjodausscheidung mittels einer modifizierten Cer-Arsenit-methode. Ber OGKC. 1985;8:13–15. (In German.)
17. Дедов И.И., Свириденко Н.Ю., Герасимов Г.А. и др. Оценка йодной недостаточности в отдельных регионах России // Проблемы эндокринологии. 2000. № 4. С. 3–7. doi: 10.14341/probl20004663-7
18. Yang Z, Guo C, Li Q, et al. Human health risks estimations from polycyclic aromatic hydrocarbons in serum and their hydroxylated metabolites in paired urine samples. Environ Pollut. 2021;290:117975. doi: 10.1016/j.envpol.2021.117975
19. Yin S, Tang M, Chen F, Li T, Liu W. Environmental exposure to polycyclic aromatic hydrocarbons (PAHs): The correlation with and impact on reproductive hormones in umbilical cord serum. Environ Pollut. 2017;220(Pt B):1429–1437. doi: 10.1016/j.envpol.2016.10.090
20. Yang S, Sun J, Wang S, Limei E, Zhang S, Jiang X. Association of exposure to polycyclic aromatic hydrocarbons with thyroid hormones in adolescents and adults, and the influence of the iodine status. Environ Sci Process Impacts. 2023;25(9):1449–1463. doi: 10.1039/D3EM00135K
21. Singh V, Patel DK, Ram S, et al. Blood levels of polycyclic aromatic hydrocarbons in children of Lucknow, India. Arch Environ Contam Toxicol. 2008;54(2):348–354. doi: 10.1007/s00244-007-9015-3
22. Jain RB. Association between polycyclic aromatic hydrocarbons and thyroid function among males and females:
23. Data from NHANES 2007–2008. Int J Environ Health Res. 2016;26(4):405–419. doi: 10.1080/09603123.2015.1135311
24. Park S, Siwakoti RC, Ferguson KK, et al. Associations of urinary polycyclic aromatic hydrocarbon (PAH) metabolites and their mixture with thyroid hormone concentration during pregnancy in the LIFECODES cohort: A repeated measures study. Environ Res. 2024;255:119205. doi: 10.1016/j.envres.2024.119205
25. Zhu P, Bian Z, Xia Y, et al. Relationship between urinary metabolites of polycyclic aromatic hydrocarbons and thyroid hormone levels in Chinese non-occupational exposure adult males. Chemosphere. 2009;77(7):883–888. doi: 10.1016/j.chemosphere.2009.08.054
26. Kim MJ, Kim S, Choi S, et al. Association of exposure to polycyclic aromatic hydrocarbons and heavy metals with thyroid hormones in general adult population and potential mechanisms. Sci Total Environ. 2021;762:144227. doi: 10.1016/j.scitotenv.2020.144227
27. Nazzari M, Romitti M, Kip AM, et al. Impact of benzo[a] pyrene, PCB153 and sex hormones on human ESC-derived thyroid follicles using single cell transcriptomics. Environ Int. 2024;188:108748. doi: 10.1016/j.envint.2024.108748
28. Schraplau A, Schewe B, Neuschäfer-Rube F, et al. Enhanced thyroid hormone breakdown in hepatocytes by mutual induction of the constitutive androstane receptor (CAR, NR1I3) and arylhydrocarbon receptor by benzo[a] pyrene and phenobarbital. Toxicology. 2015;328:21-28. doi: 10.1016/j.tox.2014.12.004
29. Kelishadi R, Sobhani P, Poursafa P, et al. Is there any association between urinary metabolites of polycyclic aromatic hydrocarbons and thyroid hormone levels in children and adolescents? Environ Sci Pollut Res Int. 2018;25(2):1962–1968. doi: 10.1007/s11356-017-0577
Об авторах
Т. В. НурисламоваНурисламова Татьяна Валентиновна – д.б.н., доцент, заведующая отделом химико-аналитических методов исследования
ул. Монастырская, д. 82, г. Пермь, 614045
О. В. Долгих
Долгих Олег Владимирович – д.м.н., проф., заведующий отделом иммунобиологических методов диагностики
ул. Монастырская, д. 82, г. Пермь, 614045
Т. Д. Карнажицкая
Карнажицкая Татьяна Дмитриевна – к.б.н., заведующий лабораторией методов жидкостной хроматографии
ул. Монастырская, д. 82, г. Пермь, 614045
М. О. Старчикова
Старчикова Мария Олеговна – н.с. лаборатории методов жидкостной хроматографии
ул. Монастырская, д. 82, г. Пермь, 614045
Т. С. Пермякова
Пермякова Татьяна Сергеевна – н.с. лаборатории методов жидкостной хроматографии
ул. Монастырская, д. 82, г. Пермь, 614045
Дополнительные файлы
Рецензия
Для цитирования:
Нурисламова Т.В., Долгих О.В., Карнажицкая Т.Д., Старчикова М.О., Пермякова Т.С. К вопросу обоснования максимальных недействующих концентраций полициклических ароматических углеводородов в крови детей и подростков по критериям их гормонального профиля. Здоровье населения и среда обитания – ЗНиСО. 2024;32(12):48-55. https://doi.org/10.35627/22195238/2024-32-12-48-55
For citation:
Nurislamova T.V., Dolgikh O.V., Karnazhitskaya T.D., Starchikova M.O., Permyakova T.S. On Substantiation of Maximum No-Effect Blood Concentrations of Polycyclic Aromatic Hydrocarbons in Children and Adolescents Based on Their Hormone Profile Criteria. Public Health and Life Environment – PH&LE. 2024;32(12):48-55. (In Russ.) https://doi.org/10.35627/22195238/2024-32-12-48-55









.png)


























