Перейти к:
Проблемы, связанные с загрязнением окружающей среды антибиотиками на примере тетрациклинов (обзор)
https://doi.org/10.35627/2219-5238/2024-32-3-33-43
Аннотация
Введение. Одним из негативных последствий использования антибиотиков является развитие антибиотикорезистентности. При этом не определен масштаб влияния на данную проблему от попадания антибиотиков в окружающую среду.
Цель исследования: проанализировать имеющиеся данные о распространенности антибиотиков в окружающей среде и связанные с этим проблемами.
Материалы и методы. Применены информационно-аналитические приемы, основанные на сборе и обработке научных статей, представленных в базах Scopus, Elsevier, РИНЦ за 2003-2023 гг., также применялись поисковые запросы в Google Scholar по ключевым словам. Критерием отбора служило наличие в статьях информации об обнаруженных концентрациях антибиотиков в объектах окружающей среды, путях их поступления, а также рассматриваются вопросы негативных последствий от загрязнения. В итоге отобрано 53 публикации, соответствующих критериям.
Результаты. Уровень загрязнения воды и почвы антибиотиками близок к уровню загрязнения пестицидами. Резистентность бактерий возникает из-за субингибирующих концентраций антибиотиков, которые в 200 раз меньше
минимальной ингибирующей концентрации. Существуют исследования, доказывающие влияние на почвенные процессы: снижение почвенного дыхания, изменение скорости нитрификации и денитрификации. В России использование антибиотиков в животноводстве растет на 40% в год, а самыми популярными классами антибиотиков являются пенициллины и тетрациклины. Почва обладает высокой способностью к поглощению антибиотиков, поэтому они быстро накапливаются и медленно разлагаются. Например, период полураспада тетрациклина составляет около 500 дней, а при низком содержании органических веществ в почве риск попадания антибиотика в пищевую цепь и растительную продукцию возрастает.
Заключение. Непрерывный выброс антибиотиков в окружающую среду и их неблагоприятное воздействие на живые организмы вызывает серьезную озабоченность, требующую дальнейшего изучения в контексте нарушения экологического баланса. Также будущие исследования должны быть направлены на разработку и внедрение методов, минимизирующих распространение генов устойчивости к антибиотикам.
Ключевые слова
Для цитирования:
Антропова Н.С., Ушакова О.В., Савостикова О.Н., Филимонова Е.И. Проблемы, связанные с загрязнением окружающей среды антибиотиками на примере тетрациклинов (обзор). Здоровье населения и среда обитания – ЗНиСО. 2024;32(3):33-43. https://doi.org/10.35627/2219-5238/2024-32-3-33-43
For citation:
Antropova N.S., Ushakova O.V., Savostikova O.N., Filimonova E.I. Problems Related to Antibiotic Pollution of the Environment: A Review with a Focus on Tetracyclines. Public Health and Life Environment – PH&LE. 2024;32(3):33-43. (In Russ.) https://doi.org/10.35627/2219-5238/2024-32-3-33-43
Введение. Начиная со второй половины XX века антибиотики нашли широкое применение в разнообразных сферах практической деятельности человека. Как в России, так и в других странах антибиотики стали применяться не только в медицине, но и в пищевой промышленности, животноводстве и птицеводстве для лечения животных и в целях профилактики. В растениеводстве их используют в составе средств фунгицидного и инсектицидного действия [1].
Одним из негативных последствий использования антибиотиков является развитие антибиотикорезистентности. По мнению Всемирной организации здравоохранения (ВОЗ), антибиотикорезистентность является одной из главных угроз общественному здоровью и безопасности в мире1. Согласно официальным отчетам [2], из-за устойчивости к противомикробным препаратам в мире ежегодно умирает 10 миллионов человек [3].
Проблема антибиотикорезистентности рассматривается в качестве глобальной экологической катастрофы рядом общественных организаций, такими как ВОЗ и Центры по контролю и профилактики заболеваний (Centers for Disease Control and Prevention – CDC), что способствует разработке стратегических документов, направленных на предупреждение и сдерживание распространения антибиотикорезистентности [4]. Так, Россия вступила в программу борьбы с микробной антибиотикорезистентностью (МАР) в 2017 г., утвердив Стратегию предупреждения распространения МАР в Российской Федерации (РФ) на период до 2030 г.2 Так же 30 декабря 2020 г. был принят закон № 492-ФЗ «О биологической безопасности в Российской Федерации», где распространение антибиотикорезистентности относится к основным угрозам биологической безопасности. В нем описывается ряд принципов и системных подходов при реализации мероприятий, направленных на обеспечение биологической безопасности, в том числе накладываются ограничения на применение ряда профилактических и терапевтических препаратов.
В то же время не определен масштаб влияния на данную проблему от попадания антибиотиков в окружающую среду. На рынке для ветеринарного применения продаются как минимум 70 % антибиотиков, которые имеют жизненно важное значение для человека [5]. Несоблюдение дозировки, а также сроков выведения из организма животных приводит к попаданию антибиотиков в животноводческую продукцию, воду и почву [6–7].
Понимание масштабов использования антибиотиков, путей их поступления, распространения и поведения в окружающей среде, а также влияния на биоту определило актуальность исследования.
Цель исследования заключается в анализе имеющихся данных о распространенности антибиотиков в окружающей среде и связанных с этим проблемах.
Материалы и методы. Для выполнения данной работы применены информационно-аналитические приемы, основанные на сборе и обработке научных статей, представленных на английском и русском языках в реферативных базах Scopus, PubMed, Elsevier, РИНЦ в период 2003–2023 гг. Также применялись поисковые запросы в Google Scholar, CDC, ВОЗ с использованием комбинации предложенных заголовков и ключевых слов, таких как «загрязнение окружающей среды антибиотиками», «антибиотики в животноводстве» «антибиотики в почве», «проблема антибиотикорезистентности», «обнаружение антибиотиков в объектах окружающей среды».
Первоначально для понимания объемов потребления антибиотиков и процессов законодательного регулирования использования антибиотиков в ветеринарии и медицине был проведен анализ международных и российских документов, содержащих актуальную статистику о мировых и российских продажах антибиотиков в животноводстве. Последние опубликованные отчеты, затрагиваю щие данный вопрос, датируются 2021 годом. Для систематизации информации о связи между использованием антибиотиков в ветеринарии и общественным здравоохранением был проведен поиск информации в базе данных ВОЗ. Найденные документы представлены в статье периодом с 2017 по 2022 г.
Систематический отбор научных исследований осуществлялся по принципу наличия в статьях сведений об обнаруженных концентрациях антибиотиков в окружающей среде за последние 5 лет. Особое внимание было сосредоточено на поиске оригинальных исследований, которые показывают негативные эффекты на почвенную биоту. Статьи, не соответствующие данным критериям, с повторяющимися исследованиями и статьи, которые включали простое упоминание или незначительное обсуждение интересующих вопросов, были исключены.
Из первоначальной выборки, состоящей из 85 источников, 32 были удалены после первичного анализа. В итоге было отобрано 53 публикации, соответствующие указанным критериям.
Результаты. Неконтролируемое поступление антибиотиков в окружающую среду может приводить к возникновению негативного влияния как на биоту, так и на человека. Имеется доказательство того, что бактерии, которые находятся в окружающей среде, представляют собой источник резистентных генов [8]. Так как ряд антибиотиков был синтезирован микроорганизмами окружающей среды, можно предположить, что гены, отвечающие за устойчивость, возникли у микроорганизма, который производил этот антибиотик. В противном случае, если бы такой микроорганизм не обладал генами устойчивости, продуцируемый антибиотик привел бы к его гибели [2]. Также, есть данные, которые свидетельствуют о том, что резистентность у бактерий возникает изза субингибирующей концентрации антибиотиков [9]. Эти субингибирующие концентрации в 200 раз ниже минимальной ингибирующей концентрации, и, по распространенному мнению, при попадании антибиотиков в окружающую среду, быстро разлагаются, не оказывая негативного влияния. Тем не менее они все же могут вызывать селекцию антибиотикорезистентности (вызывать SOS-ответ) и даже вызывать развитие полирезистентных условно-патогенных микроорганизмов [10–11].
Анализ преодоления экологических барьеров на примере популяций сапротрофных и энтеропатогенных бактерий с устойчивостью к некоторым антибиотикам показывает транспорт микроорганизмов от животноводства и сельского хозяйства к человеку по замкнутой пищевой цепи: корм – кишечный тракт крупного рогатого скота – экскременты животных – почва – растения – человек. Желудочно-кишечный тракт человека рассматривается как огромный резервуар бактерий, которые могут получать гены антибиотикоустойчивости [12]. Было получено ограниченное подмножество генов, кодируемых хромосомами бактерий окружающей среды. Эти гены были перемещены в новый организм при помощи элементов переноса генов, независимо от регуляторных и метаболических систем первоначального хозяина. Основной функцией перенесенных генов является обеспечение устойчивости к антибиотикам в новых организмах-носителях [2][13].
Для понимания и прогнозирования процессов эволюции и распространения антибиотикорезистентности необходимо тщательно изучать клинические и экологические места обитания микроорганизмов окружающей среды, в которых возникают гены устойчивости к антибиотикам [2].
Так как основной функцией антибиотиков является воздействие на микроорганизмы, то при попадании в окружающую среду они могут оказывать влияние на микробные сообщества экосистем, играющих ключевую роль в базовых экологических процессах, в особенности почвенных.
Почвенные микроорганизмы выполняют множество жизненно важных процессов и участвуют в поддержании здоровья и качества почвы. Гомеостаз почвы может быть нарушен биотическими и абиотическими факторами, включая воздействие пестицидов, тяжелых металлов и антибиотиков [14].
Множество исследований показывают, что даже низкие концентрации антибиотиков влияют на различные почвенные процессы, например, снижение и изменение реакции почвенного дыхания [15–17], изменение скорости нитрификации, денитрификации [16][18–20] и обмена железа в почве [18][21], а также вызывают изменения в общей активности ферментов, таких как дегидрогеназа, фосфатаза и уреаза [22–27].
Таким образом, перечисленные факторы отрицательно сказываются не только на структуре и функционировании экосистем, но и на здоровье человека. Для ограничения негативного воздействия антибиотиков следует применять ряд мер, одной из которых должен быть контроль за поступлением и содержанием остаточных количеств антибиотиков в объектах окружающей среды.
С каждым годом появляется все больше работ по обнаружению фармацевтических препаратов в окружающей среде и растениях [28–33]. Установлено, что уровень загрязнения воды и почвы антибиотиками приближен к уровню загрязнения пестицидами, и остаточное содержание этих антибиотиков может достигать до 21 мг/кг в твердых веществах, включая почву [34]. В то же время в сточных водах предприятий по производству антибиотиков наблюдалась даже чрезвычайно высокая концентрация 32,0 мг/л [35]. При этом пороговое значение содержания антибиотиков в водной среде, установленное Европейским агентством по оценке лекарственных средств (European Medicines Agency – EMA), составляет 10 нг/л [35].
Лекарственные средства, в том числе антибиотики, имеют различные пути поступления в окружающую среду (рис. 1).
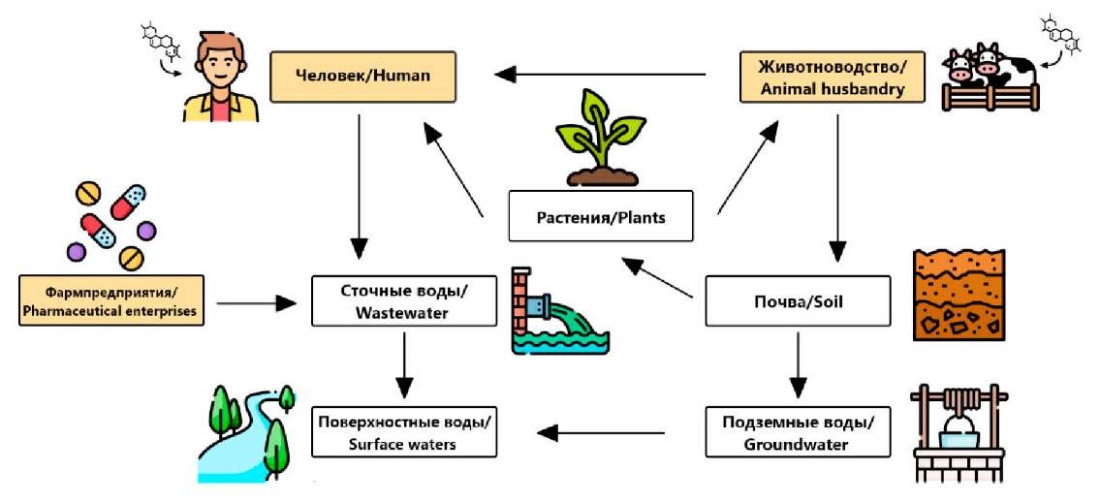
Рис. 1. Пути поступления антибиотиков в окружающую среду
Fig. 1. Entry routes of antibiotics in the environment
В поверхностные воды антибиотики поступают со сточными водами фармацевтических и сельскохозяйственных предприятий, стоками жилищно-коммунального хозяйства и больниц [6].
В загрязнение почвы антибиотиками наибольший вклад вносит сельское хозяйство и животноводство. Для улучшения почвенного состава в сельском хозяйстве могут использовать биосолиды – твердые органические материалы, обогащенные питательными веществами, полученные из бытовых сточных вод путем их фильтрации, в которых также могут быть обнаружены экстрагируемые антибиотики [5]. Но преимущественно в качестве органического удобрения используется навоз животных, в котором содержится большое количество антибиотиков, поскольку до 90 % применяемого препарата выводится из организма без изменения или в виде метаболитов [36].
Согласно отчету ЕМА3 2021 г., в Европейском Союзе наиболее распространенными антибиотиками в ветеринарной медицине являются пенициллины, тетрациклины и сульфаниламиды, составляющие 66,9 % от общего объема продаж (рис. 2). После них идут макролиды, аминогликозиды, линкозамиды, фторхинолоны, полимиксины и плевромутилины. Прочие группы антибиотиков составляют 4,4 % от общего объема продаж. По оценке экспертов Всемирной торговой организации, в России использование антибиотиков в животноводстве ежегодно растет примерно на 35–40 % [37].
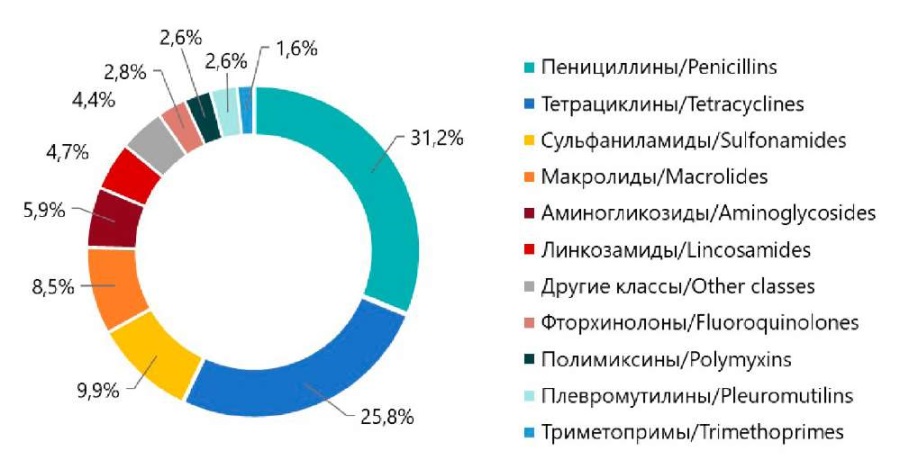
Рис. 2. Доля совокупных продаж классов антибиотиков для сельскохозяйственных животных
в 31 стране Европы в 2021 году
Fig. 2. Class-specific sales percentages of veterinary antibiotics in 31 European countries in 2021
В Европе самым продаваемым классом антибиотиков в 2021 г. являлись пенициллины (рис. 2), однако продажи тетрациклинов превзошли их в 13 странах. В США также чаще всего используются антибиотики тетрациклиновой группы (71 %) [5].
В рамках работы по защите общественного здоровья в 2017 г. ВОЗ составила Руководящие принципы по применению важных в медицинском отношении противомикробных препаратов в продовольственном животноводстве4. В рекомендациях рассматривается применение антибиотиков среди животных для разных целей, а именно: для стимуляции роста, в профилактических целях при отсутствии заболевания, а также в целях лечения и борьбы с клинически диагностированной болезнью. При составлении рекомендаций использовался выпускаемый ВОЗ «Перечень критически важных противомикробных препаратов для лечения человека» (Перечень КВПП ВОЗ)5, в котором все ныне используемые для лечения людей и животных антибиотики распределены по трем категориям – важные, высокой важности и критически важные, исходя из степени их необходимости при терапии.
В 2020 году Европейское агентство по лекарственным средствам представило обновленный документ6 о категоризации антибиотиков в ветеринарии, который основывается на знаниях, полученных при классификации антибиотиков ВОЗ. Пересмотренная классификация включает все классы антибиотиков и учитывает дополнительные критерии, включая наличие альтернативных антибиотиков только в ветеринарии, а также учитывает риск их применения у животных в контексте общественного здравоохранения. Согласно новой классификации, антибиотики разделены на четыре категории от A до D: «А: Avoid – Избегать», «В: Restrict – Ограничивать», «С: Caution – Осторожно» и «D: Prudence – Благоразумно».
По данному перечню самые часто используемые в ветеринарии антибиотики, такие как тетрациклины и сульфаниламиды, относятся к категории D – препараты первой линии. В то же время различные препараты пенициллиновой группы, в зависимос ти от комбинации их с ингибиторами относятся к категориям A – запрещенных к применению, С – применяемые с осторожностью по определенным показаниям и категории D.
Для эффективного мониторинга и контроля за загрязнением окружающей среды необходимо учитывать тот факт, что в распределении антибиотиков различных классов в разных объектах играют роль такие факторы, как химическая структура соединений, их полярность и физико-химические свойства. Также следует отметить, что по отношению к разным антибиотикам отличается сорбционная емкость почв [36] и способность их аккумуляции разными видами сельскохозяйственных культур. Следовательно, целесообразно углубленно изучать антибиотики по отдельным классам, нежели определять их комплексно, как это проводят во многих исследованиях.
Изучение антибиотиков тетрациклиновой группы является перспективным направлением. В течение более пятидесяти лет тетрациклины активно использовались в ветеринарии для стимуляции роста животных, занимают лидирующие позиции в продажах и являются первостепенными препаратами для лечения. И несмотря на то, что с 2006 года в ряде стран вводились запреты на применение антибактериальных препаратов с целью стимуляции роста и повышения продуктивности животных [38], в России только в 2022 году приняли закон, запрещающий добавление антибиотиков в корма без рецепта7, в перечень которого вошли тетрациклины. Это дает возможность изучения кумулятивного эффекта вещества в окружающей среде ввиду его долгого бесконтрольного применения. К тому же при низком содержании органических веществ в почве для антибиотика данной группы установлен наибольший риск попадания в пищевую цепь [5].
Первые представители группы тетрациклинов были открыты в 1945–1949 гг. Бенджамином Дуггаром, выделенные из культуральной жидкости Streptomyces aureofaciens и Streptomyces rimosus, которые были названы ауреомицином (хлортетрациклин) и террамицином (окситетрациклин) [39]. В 1953 году создается полусинтетический антибиотик тетрациклин, который был получен путем комбинирования биологических и химических процессов. Молекула этого антибиотика имела простую структуру, но при этом она сохраняла свои функции.
Антибиотики тетрациклин, окситетрациклин и хлортетрациклин послужили базой для создания новых производных, включая демеклоциклин, ролитетрациклин и метациклин, которые относятся к первому поколению тетрациклинов. Однако недостатком данных антибиотиков было их кратковременное пребывание в организме [40]. Для повышения их эффективности применили различные структурные изменения и было разработано второе поколение полусинтетических производных тетрациклинов. Они имели повышенную антибактериальную активность, более широкий спектр действия, стойкость и лучшую растворимость [39][41]. Третье поколение является полностью синтетическим. Таким образом, удалось создать обширную линейку тетрациклинов, и на данный момент насчитывается примерно 40 природных антибиотиков тетрациклинового ряда и около 3000 синтетических представителей этой группы лекарств8.
Тетрациклины представляют собой кристаллические вещества желтого цвета, которые легко растворяются в щелочах, кислотах, метаноле, пиридине и этиленгликоле, но имеют плохую растворимость в воде, этилацетате, хлороформе и дихлорметане. Присутствие хромофоров в структуре этих соединений обусловливает их окраску. Химические свойства тетрациклинов зависят от наличия различных функциональных групп в их молекулах, таких как кислотные, фенольные, спиртовые, гидроксильные, енольные, карбонильные, аминные и амидные.
и соли с щелочными и щелочноземельными металлами, а также с органическими и неорганическими кислотами7.
Тетрациклины имеют широкий спектр воздействия на грамотрицательные и грамположительные бактерии, риккетсии, хламидии, микоплазмы, боррелии, кампилобактеры и легионеллы. Механизм их действия заключается в ингибировании синтеза белка, связываясь с 30S фракцией бактериальной хромосомы. Это препятствует прикреплению транспортной РНК и доставке аминокислот для образования белков [42]. Тетрациклины отличаются друг от друга по некоторым физико-химическим свойствам, степени антибактериального действия, а также имеют разные особенности всасывания, распределения и метаболизма в организме [38]. Они также различаются по периодам полураспада: доксициклин и миноциклин имеют период полураспада более 15 часов, демеклоциклин – 12 часов, а хлортетрациклин, окситетрациклин и тетрациклин – от 6 до 9 часов [43].
Как описывалось ранее, в окружающую среду тетрациклины попадают с навозом, используемым в качестве органического удобрения, а также со стоками. Хотя некоторые процессы очистки сточных вод могут привести к разрушению антибиотиков, скорость удаления антибиотиков заметно различается. Это может быть связано с различиями в процессах очистки и типах используемой технологии [44–45]. В таблице приведены примеры обнаруживаемых концентраций основных антибиотиков тетрациклиновой группы в различных объектах.
Таблица. Концентрация антибиотиков тетрациклиновой группы в окружающей среде
Table. Concentrations of tetracycline antibiotics measured in the environment
|
Антибиотик / Antibiotic |
Концентрация мкг/кг | мкг/л / Concentration, µg /kg | µg/L |
Объект / Object |
Страна / Country |
Ссылка / Reference |
|
Тетрациклин / Tetracycline |
8 326 |
Осадок сточных вод / Sewage sludge |
Китай / China |
[6] |
|
0,15 |
Поверхностные воды / Surface water |
США / USA |
[29] |
|
|
2 683 |
Почва / Soil |
Китай / China |
[6] |
|
|
0,6–6 |
Сельскохозяйственные поля / Agricultural field |
Дания / Denmark |
[28] |
|
|
199 |
Поле, удобренное навозом / Field fertilized with manure |
Германия / Germany |
[28] |
|
|
44 |
Овощные угодья / Vegetable farmland |
Китай / China |
[28] |
|
|
Хлортетрациклин / Chlortetracycline |
764 000 |
Навоз / Manure |
Китай / China |
[6] |
|
20–30 |
Сельскохозяйственные поля / Agricultural field |
Дания / Denmark |
[28] |
|
|
2–140 |
Поле, удобренное навозом / Field fertilized with manure |
США / USA |
[28] |
|
|
54–532 |
Кориандр / Сoriander |
Китай / China |
[46] |
|
|
41,8 |
Почва / Soil |
Соединенное Королевство / United Kingdom |
[29] |
|
|
Окситетрациклин / Oxytetracycline |
354 000 |
Навоз / Manure |
Китай / China |
[6] |
|
40–500 |
Поле, удобренное навозом / Field fertilized with manure |
Турция / Turkey |
[28] |
|
|
2–4 |
Поле рядом с компостным комплексом / Field adjacent to composting facility |
Южная Корея / South Korea |
[28] |
|
|
23 |
Морковь / Carrot |
Великобритания / Great Britain |
[47] |
|
|
71,7 |
Стоки / Wastewater |
Англия / England |
[29] |
|
|
8700 |
Биосолиды / Biosolids |
Китай / China |
[6] |
|
|
50 000 |
Почва / Soil |
Китай / China |
[6] |
По литературным данным установлено, что в почве антибиотики группы тетрациклинов подавляют урезанную и дегидрогеназную активность [23], изменяют реакции микробного дыхания [17], а такой препарат как окситетрациклин ингибирует восстановления Fe (III) [21] и снижает скорость нитрификации [26].
В почвенной среде антибиотики могут подвергаться различным абиотическим и биотическим процессам, включая трансформацию, деградацию, сорбцию, десорбцию, поглощение растениями, а также перенос в грунтовые воды [6].
На стойкость этих антибиотиков в окружающей среде влияют процессы деградации, в то время как перенос в водные объекты и поглощение растениями зависят от процессов адсорбции и десорбции [48]. На эти процессы влияют физико-химические характеристики антибиотиков (такие, как молекулярная структура, размер, растворимость и гидрофобность), а также характеристики почвы, в основном рН и содержание компонентов, способных задерживать эти поллютанты (органические вещества, глина, некристаллические минералы) [49]. В частности, роль органического вещества имеет большое значение из-за его большого количества рН-зависимых функциональных групп, способных иметь сильно отрицательный заряд, что позволяет адсорбировать положительно заряженные антибиотики посредством электростатических взаимодействий. Кроме того, адсорбция также может происходить посредством водородных связей или через связь с ионами металлов [50–51].
Исследования, проводимые в работах [7] и [48], показали, что почвы с более высоким содержанием органического вещества поглощают 100 % тетрациклинов, при этом десорбция составляет не выше 3 %. Согласно данным исследованиям, можно сделать вывод о том, что при попадании высоких доз антибиотиков в почву с низким содержанием органического вещества, повышается вероятность перехода их в растения или в грунтовые воды.
Разложению тетрациклинов способствует такой абиотический фактор, как фотохимическое превращение (фоторазрушение), которое происходит в основном на поверхности почвы или в воде. В работе [52] исследовали разрушение тетрациклинов в воде при имитации солнечного света. Показано, что в чистой воде при солнечном свете тетрациклин разрушается медленнее окситетрациклина и хлортетрациклина в 2,2 раза. Присутствие бактериальных суспензий, выделенных из почвы и птичьего помета, спровоцировало увеличение распада, которое было связано не с биодеградацией тетрациклинов, а с присутствием гуминовых кислот, адсорбирующих эти антибиотики.
Большой диапазон периодов полураспада в почве – от <1 дня до 9,5 года [6] различных групп фармацевтических препаратов – объясняется именно множественным влиянием всех этих факторов. Примечательно, что даже для антибиотиков из одной группы период полураспада значительно различается. Так, например, по разным исследованиям в окружающей среде период полураспада тетрациклина составляет около 500 дней, хлортетрациклина – 24 дня, окситетрациклина – > 20 дней [53].
Наблюдаемые различия в стойкости, вероятно, обусловлены различиями в составе почв, дозах антибиотиков и условиях, использованных в исследованиях. Однако, основываясь на обзоре литературы, можно сделать вывод, что тетрациклины характеризуются высокими значениями периода полураспада.
Обсуждение. Анализ существующих исследований свидетельствуют, что в разных объектах окружающей среды антибиотики проявляет себя по-разному. На примере антибиотика тетрациклина видно, что при попадании его в воду возможен быстрый распад за счет проникновения солнечного света, а также нахождения в исходной форме, то при попадании антибиотика в почву можно прогнозировать его взаимодействие с почвенным веществом с образованием химических связей. Это влияет как на процессы распада, так и на сложности при его аналитическом определении. При этом все эти исследования показывают, что даже низкие концентрации антибиотиков влияют на различные почвенные процессы, опосредуемые микроорганизмами, несмотря на то, что эффекты являлись непостоянными и определялись тем, как быстро распадались антибиотики.
Существующие на сегодняшний день методы не всегда позволяют провести различие между разложением и сорбцией. Поэтому особое внимание следует уделять методам экстракции (пробоподготовки), так как недостаточные или неправильные процедуры экстракции могут привести к неправильной интерпретации поведения антибиотиков в почве, поскольку антибиотики, которые прочно связаны с частицами почвы, могут ошибочно считаться трансформированными или разложившимися.
Точное количественное определение антибиотиков и продуктов их трансформации имеет первостепенное значение, поскольку имеются данные, свидетельствующие о том, что устойчивость бактерий к антибиотикам может развиваться под воздействием субингибирующих концентраций. Однако это требует применения передовых аналитических методов (например ВЭЖХ-МС/МС), поскольку выделение следовых количеств из сложной матрицы, такой как почва, представляет собой трудную задачу. При этом контроль за попаданием антибиотиков в окружающую среду становится все более значимой проблемой для гигиенических исследований. В России на данный момент отсутствуют аттестованные методики по определению антибиотиков в объектах окружающей среды, которые можно рекомендовать для государственного экологического и санитарно-гигиенического контроля. Также следует отметить, что отсутствие стандартизированных методов анализа затрудняет оценку, которая привела бы к общим выводам о влиянии антибиотиков на биогеохимические циклы в почве.
Непрерывный выброс антибиотиков в окружающую среду и их неблагоприятное воздействие на живые организмы вызывает серьезную озабоченность и требует дальнейшего изучения в контексте нарушения экологического баланса.
Заключение
В результате литературного обзора можно сделать вывод о том, что загрязнение окружающей среды антибиотиками является проблемой, которой, по прогнозам, в ближайшем будущем будет уделяться повышенное внимание, так как потребление антибиотиков по всему миру продолжает расти вместе с распространением антибиотикорезистентности.
Тетрациклины выделяются среди наиболее часто обнаруживаемых антибиотиков в окружающей среде, а также являются лидерами в продажах и потреблении в животноводстве, что делает их перспективными для дальнейших исследований.
Другими проблемами, которые следует принимать во внимание, являются различия в процедурах оценки пределов обнаружения антибиотиков и отсутствие стандартных аналитических методов для мониторинга содержания антибиотиков в окружающей среде.
Также будущие исследования должны быть направлены на разработку и внедрение методов, которые минимизируют распространение генов устойчивости к антибиотикам.
1. World Health Organization. Antimicrobial resistance. 2023. [Электронный ресурс.] Режим доступа: https://www.who.int/news-room/fact-sheets/detail/antimicrobial-resistance (дата обращения: 13.02.2024).
2. Распоряжение Правительства РФ от 25 сентября 2017 г. № 2045-р «Об утверждении Стратегии предупреждения распространения антимикробной резистентности в Российской Федерации на период до 2030 года (с изменениями на 11 сентября 2021 года)».
3. European Medicines Agency (EMA), Sales of veterinary antimicrobial agents in 31 European countries in 2021. Trends from 2010 to 2021 Twelfth ESVAC report. https://www.ema.europa.eu/en/documents/report/sales-veterinary-antimicrobial-agents-31-european-countries-2021-trends-2010-2021-twelfth-esvac_en.pdf (2022).
4. Руководящие принципы ВОЗ по применению важных в медицинском отношении противомикробных препаратов в продовольственном животноводстве: https://apps.who.int/iris/bitstream/handle/10665/259243/WHO-NMH-FOS-FZD-17.5-rus.pdf?sequence=5 (2017)
5. Перечень ВОЗ критически важных противомикробных препаратов для медицинского применения, 6-й пересмотренный вариант, ВОЗ, 2019 https://apps.who.int/iris/bitstream/handle/10665/325038/WHO-NMH-FOS-FZD-19.1-rus.pdf?ua=1
6. European Medicines Agency. Categorisation of Antibiotics Used in Animals Promotes Responsible Use to Protect Public and Animal Health. 2020. https://bit.ly/30ZEuRi.
7. Приказ Министерства сельского хозяйства РФ от 02.11.2022 № 776 «Об утверждении порядка назначения лекарственных препаратов для ветеринарного применения, перечня лекарственных средств для ветеринарного применения, в том числе антимикробных препаратов для ветеринарного применения, отпускаемых по рецепту на лекарственный препарат или по требованию ветеринарной организации или организации (индивидуального предпринимателя), осуществляющей (осуществляющего) разведение, выращивание и содержание животных, формы рецептурного бланка на лекарственный препарат для ветеринарного применения, формы требования ветеринарной организации или организации (индивидуального предпринимателя), осуществляющей (осуществляющего) разведение, выращивание и содержание животных, порядка оформления таких рецептурного бланка и требования, их учета и хранения».
8. Удалова А.Ю. Сорбционное концентрирование антибиотиков тетрациклиновой группы для их последующего определения. Дис. … к.хим.наук. Москва, 2015.
Список литературы
1. Чеснокова С.М., Космачева А.Г. Оценка фитотоксичности и опасности для окружающей среды антибиотиков, используемых в сельском хозяйстве // Инновационные пути решения актуальных. Проблем природопользования и защиты окружающей среды: Материалы докладов Международной научно-технической конференции. / Под редакцией: И.В. Старостина. Том III. Белгород: Белгородский государственный технологический университет им. В.Г. Шухова, 2018. С. 289–295.
2. Tan HM, Lall AC, Keppo J, Chen SL. Evaluation of a new antiresistic strategy to manage antibiotic resistance. J Glob Antimicrob Resist. 2023;33:368-375. doi: 10.1016/j.jgar.2023.03.006
3. Dadgostar P. Antimicrobial resistance: Implications and costs. Infect Drug Resist. 2019;12:3903-3910. doi: 10.2147/IDR.S234610
4. Давидович Н. В. и др. Основные принципы эволюции антибиотикорезистентности у бактерий (обзор литературы) // Клиническая лабораторная диагностика. 2020. Т. 65. № 6. С. 387–393. doi: 10.1882im69-2084-2020-65-6-387-393
5. Лаврухина О.И., Амелин В.Г., Киш Л.К. и др. Определение остаточных количеств антибиотиков в объектах окружающей среды и пищевых продуктов // Журнал аналитической химии. 2022. Т. 77. № 11. С. 969–1015. doi: 10.31857/S004445022211007X
6. Cycoń M, Mrozik A, Piotrowska-Seget Z. Antibiotics in the soil environment – Degradation and their impact on microbial activity and diversity. Front Microbiol. 2019;10:338. doi: 10.3389/fmicb.2019.00338
7. Conde-Cid M, Ferreira-Coelho G, Núñez-Delgado A, et al. Competitive adsorption of tetracycline, oxytetracycline and chlortetracycline on soils with different pH value and organic matter content. Environ Res. 2019;178:108669. doi: 10.1016/j.envres.2019.108669
8. Кудинова А.Г., Соина В.С., Максакова С.А., Петрова М.А. Изучение базовой устойчивости к антибиотикам бактерий, выделенных из различных биотопов // Микробиология. 2019. Т. 88. № 6. С. 695–704. doi: 10.1134/S0026365619050094
9. Циркунова Ж.Ф. и др. Влияние субингибирующих концентраций биоцидов на формирование адаптивной устойчивости клинических изолятов Klebsiella pneumoniae // Иммунопатология, аллергология, инфектология. 2022. № 3. С. 30–39. doi:10.14427/jipai.2022.3.30
10. Berglund B. Environmental dissemination of antibiotic resistance genes and correlation to anthropogenic contamination with antibiotics. Infect Ecol Epidemiol. 2015;5:28564. doi: 10.3402/iee.v5.28564
11. Saima S, Fiaz M, Zafar R, Ahmed I, Arshad M. Dissemination of antibiotic resistance in the environment. In: Hashmi MZ, ed. Antibiotics and Antimicrobial Resistance Genes in the Environment. 2020;1:99-116. doi: 10.1016/B978-0-12-818882-8.00006-1
12. Кожевин П.А., Виноградова К.А., Булгакова В.Г. Почвенная антибиотическая резистома // Вестник Московского Университета. Серия 17. Почвоведение. 2013. № 2. С. 3–10.
13. Martinez JL, Sánchez MB, Martínez-Solano L, et al. Functional role of bacterial multidrug efflux pumps in microbial natural ecosystems. FEMS Microbiol Rev. 2009;33(2):430–449. doi: 10.1111/j.1574-6976.2008.00157.x
14. Orlewska K, Markowicz A, Piotrowska-Seget Z, Smoleń-Dzirba J, Cycoń M. Functional diversity of soil microbial communities in response to the application of cefuroxime and/or antibiotic-resistant Pseudomonas putida strain MC1. Sustainability. 2018;10(10):3549. doi: 10.3390/su10103549
15. Liu F, Ying GG, Tao R, Zhao JL, Yang JF, Zhao LF. Effects of six selected antibiotics on plant growth and soil microbial and enzymatic activities. Environ Pollut. 2009;157(5):1636-1642. doi: 10.1016/j.envpol.2008.12.021
16. Grenni P, Ancona V, Caracciolo AB. Ecological effects of antibiotics on natural ecosystems: A review. Microchem J. 2018;136:25-39. doi: 10.1016/j.microc.2017.02.006
17. Wepking C, Avera B, Badgley B, et al. Exposure to dairy manure leads to greater antibiotic resistance and increased mass-specific respiration in soil microbial communities. Proc Biol Sci. 2017;284(1851):20162233. doi: 10.1098/rspb.2016.2233
18. Toth JD, Feng Y, Dou Z. Veterinary antibiotics at environmentally relevant concentrations inhibit soil iron reduction and nitrification. Soil Biol Biochem. 2011;43(12):2470-2472. doi: 10.1016/j.soilbio.2011.09.004
19. Cui H, Wang SP, Fu J, Zhou ZQ, Zhang N, Guo L. Influence of ciprofloxacin on microbial community structure and function in soils. Biol Fert Soils. 2014;50:939-947. doi: 10.1007/s00374-014-0914-y
20. Yang JF, Ying GG, Liu S, et al. Biological degradation and microbial function effect of norfloxacin in a soil under different conditions. J Environ Sci Health B. 2012;47(4):288-295. doi: 10.1080/03601234.2012.638886
21. Molaei A, Lakzian A, Haghnia G, et al. Assessment of some cultural experimental methods to study the effects of antibiotics on microbial activities in a soil: An incubation study. PLoS One. 2017;12(7):e0180663. doi: 10.1371/journal.pone.0180663
22. Ma T, Pan X, Chen L, et al. Effects of different concentrations and application frequencies of oxytetracycline on soil enzyme activities and microbial community diversity. Eur J Soil Biol. 2016;76:53-60. doi: 10.1016/j.ejsobi.2016.07.004
23. Абрамов Е.Г., Антропова Н.С. Влияние антибиотика тетрациклина гидрохлорида на биотрансформацию мочевины // Гигиена и санитария. 2022. Т. 101. № 5. С. 589–595. doi: 10.47470/0016-9900-2022-101-5-589-595
24. Pinna MV, Castaldi P, Deiana P, Pusino A, Garau G. Sorption behavior of sulfamethazine on unamended and manure-amended soils and short-term impact on soil microbial community. Ecotoxicol Environ Saf. 2012;84:234-242. doi: 10.1016/j.ecoenv.2012.07.006
25. Akimenko YV, Kazeev KS, Kolesnikov SI. Impact assessment of soil contamination with antibiotics (For example, an ordinary chernozem). Am J Appl Sci. 2015;12(2):80-88. doi: 10.3844/ajassp.2015.80.88
26. Liu B, Li Y, Zhang X, Wang J, Gao M. Effects of chlortetracycline on soil microbial communities: Comparisons of enzyme activities to the functional diversity via Biolog EcoPlates™. Eur J Soil Biol. 2015;68:69-76. doi: 10.1016/j.ejsobi.2015.01.002
27. Unger IM, Goyne KW, Kennedy AC, Kremer RJ, McLain JE, Williams CF. Antibiotic effects on microbial community characteristics in soils under conservation management practices. Soil Sci Soc Am J. 2013;77(1):100-112. doi: 10.2136/sssaj2012.0099
28. Kuppusamy S, Kakarla D, Venkateswarlu K, Megharaj M, Yoon YE, Lee YB. Veterinary antibiotics (VAs) contamination as a global agro-ecological issue: A critical view. Agric Ecosyst Environ. 2018;257:47-59. doi: 10.1016/j.agee.2018.01.026
29. Тимофеева С.С., Гудилова О.С. Антибиотики в окружающей среде: состояние и проблемы // XXI век. Техносферная безопасность. 2021. Т. 6. № 3 (23). С. 251–265. doi: 10.21285/2500-1582-2021-3-251-265
30. Geng J, Liu X, Wang J, Li S. Accumulation and risk assessment of antibiotics in edible plants grown in contaminated farmlands: A review. Sci Total Environ. 2022;853:158616. doi: 10.1016/j.scitotenv.2022.158616
31. Jia WL, Song C, He LY, et al. Antibiotics in soil and water: Occurrence, fate, and risk. Curr Opin Environ Sci Health. 2022;32:100437. doi: 10.1016/j.coesh.2022.100437
32. Rashid A, Muhammad J, Khan S, Kanwal A, Sun Q. Poultry manure gleaned antibiotic residues in soil environment: A perspective of spatial variability and influencing factors. Chemosphere. 2023;317:137907. doi: 10.1016/j.chemosphere.2023.137907
33. Wang Y, Dong X, Zang J, et al. Antibiotic residues of drinking-water and its human exposure risk assessment in rural Eastern China. Water Res. 2023;236:119940. doi: 10.1016/j.watres.2023.119940
34. Mousavi L, Tamiji Z, Khoshayand MR. Applications and opportunities of experimental design for the dispersive liquid–liquid microextraction method – A review. Talanta. 2018;190:335-356. doi: 10.1016/j.talanta.2018.08.002
35. Zhang F, Wang J, Tian Y, et al. Effective removal of tetracycline antibiotics from water by magnetic functionalized biochar derived from rice waste. Environ Pollut. 2023;330:121681. doi: 10.1016/j.envpol.2023.121681
36. Wegst-Uhrich S, Navarro DA, Zimmerman L, Aga DS. Assessing antibiotic sorption in soil: A literature review and new case studies on sulfonamides and macrolides. Chem Cent J. 2014;8(1):5. doi: 10.1186/1752-153X-8-5
37. Маилян Э.С. Проблема использования антибиотиков в животноводстве и пути контроля микробной антибиотикорезистентности // БИО. 2021. Т. 255. № 12. С. 4.
38. Ришко О. Тетрациклины: взгляд из прошлого в будущее // Животноводство России. 2019. № 1. С. 36–37.
39. Nelson ML, Levy SB. The history of the tetracyclines. Ann N Y Acad Sci. 2011;1241:17-32. doi: 10.1111/j.1749-6632.2011.06354.x
40. Walsh C. Antibiotics: Actions, Origins, Resistance. Washington, DC: ASM Press; 2003.
41. Мирошникова М. С. Тетрациклиновые антибиотики в животноводстве и ветеринарии // Шаг в науку. 2021. № 2. С. 10–20.
42. Rivas J, Encinas Á, Beltrán F, Graham N. Application of advanced oxidation processes to doxycycline and norfloxacin removal from water. J Environ Sci Health A. 2011;46(9):944-951. doi: 10.1080/10934529.2011.586249
43. Pereira-Maia EC, Pereira-Silva P, de Almeida WB, et al. Tetracyclines and glycylcyclines: An overview. Quím Nova. 2010;33(3):700-706. doi: 10.1590/S0100-40422010000300038
44. Forsberg KJ, Reyes A, Wang B, Selleck EM, Sommer MO, Dantas G. The shared antibiotic resistome of soil bacteria and human pathogens. Science. 2012;337(6098):1107-1111. doi: 10.1126/science.1220761
45. Wu XL, Xiang L, Yan QY, et al. Distribution and risk assessment of quinolone antibiotics in the soils from organic vegetable farms of a subtropical city, Southern China. Sci Total Environ. 2014;487:399-406. doi: 10.1016/j.scitotenv.2014.04.015
46. Fernández-Calviño D, Bermúdez-Couso A, Arias-Estévez M, et al. Competitive adsorption/desorption of tetracycline, oxytetracycline and chlortetracycline on two acid soils: Stirred flow chamber experiments. Chemosphere. 2015;134:361-366. doi: 10.1016/j.chemosphere.2015.04.098
47. Pan M, Chu LM. Fate of antibiotics in soil and their uptake by edible crops. Sci Total Environ. 2017;599-600:500-512. doi: 10.1016/j.scitotenv.2017.04.214
48. Kemper N. Veterinary antibiotics in the aquatic and terrestrial environment. Ecol Indic. 2008;8(1):1-13. doi: 10.1016/j.ecolind.2007.06.002
49. Wang S, Wang H. Adsorption behavior of antibiotic in soil environment: A critical review. Front Environ Sci Eng. 2015;9:565-574. doi: 10.1007/s11783-015-0801-2
50. Okaikue-Woodi FE, Kelch SE, Schmidt MP, Martinez CE, Youngman RE, Aristilde L. Structures and mechanisms in clay nanopore trapping of structurally-different fluoroquinolone antimicrobials. J Colloid Interface Science. 2018;513:367-378. doi: 10.1016/j.jcis.2017.11.020
51. Conde-Cid M, Fernández-Calviño D, Nóvoa-Muñoz JC, et al. Biotic and abiotic dissipation of tetracyclines using simulated sunlight and in the dark. Sci Total Environ. 2018;635:1520-1529. doi: 10.1016/j.scitotenv.2018.04.233
52. Walters E, McClellan K, Halden RU. Occurrence and loss over three years of 72 pharmaceuticals and personal care products from biosolids–soil mixtures in outdoor mesocosms. Water Res. 2010;44(20):6011-6020. doi: 10.1016/j.watres.2010.07.051
53. Scaria J, Anupama KV, Nidheesh PV. Tetracyclines in the environment: An overview on the occurrence, fate, toxicity, detection, removal methods, and sludge management. Sci Total Environ. 2021;771:145291. doi: 10.1016/j.scitotenv.2021.145291
Об авторах
Н. С. АнтроповаРоссия
Антропова Наталья Сергеевна – младший научный сотрудник отдела физико-химических исследований и экотоксикологии.
ул. Погодинская, д. 10, стр. 1, Москва, 191121
О. В. Ушакова
Россия
Ушакова Ольга Владимировна – к.м.н., ведущий научный сотрудник отдела гигиены.
ул. Погодинская, д. 10, стр. 1, Москва, 191121
О. Н. Савостикова
Россия
Савостикова Ольга Николаевна – к.м.н., начальник отдела физико-химических исследований и экотоксикологии.
ул. Погодинская, д. 10, стр. 1, Москва, 191121
Е. И. Филимонова
Россия
Филимонова Екатерина Игоревна – химик отдела физико-химических исследований и экотоксикологии.
ул. Погодинская, д. 10, стр. 1, Москва, 191121
Рецензия
Для цитирования:
Антропова Н.С., Ушакова О.В., Савостикова О.Н., Филимонова Е.И. Проблемы, связанные с загрязнением окружающей среды антибиотиками на примере тетрациклинов (обзор). Здоровье населения и среда обитания – ЗНиСО. 2024;32(3):33-43. https://doi.org/10.35627/2219-5238/2024-32-3-33-43
For citation:
Antropova N.S., Ushakova O.V., Savostikova O.N., Filimonova E.I. Problems Related to Antibiotic Pollution of the Environment: A Review with a Focus on Tetracyclines. Public Health and Life Environment – PH&LE. 2024;32(3):33-43. (In Russ.) https://doi.org/10.35627/2219-5238/2024-32-3-33-43









.png)



























