Перейти к:
Гигиенические и морфологические аспекты применения водного раствора молекулярного водорода в экспериментальной модели поллиноза
https://doi.org/10.35627/2219-5238/2023-31-12-91-98
Аннотация
Введение. Организм человека в процессе взаимодействия с окружающей средой подвергается воздействию многочисленных факторов химической и биологической природы. Аллергические реакции, развивающиеся в условиях подобных взаимодействий, имеют всё большую распространенность, взаимодействующие вещества усиливают действие друг друга и усугубляют проявления аллергии. Регистрация повышенного количества пыльцы растений в результате постепенного увеличения температуры воздуха приводит к неутешительным прогнозам распространения аллергического ринита (поллиноза). Оценка данных социально-гигиенического мониторинга в разделах качества питьевой воды и пищевых продуктов показала значимость таких загрязнителей как нитраты и нитриты. Взаимодействие пыльцевых и нитратных агентов не было изучено и представляет интерес с точки зрения возможных эффектов их комбинированного воздействия.
Цель исследования: оценка морфологических изменений количественного состава тучных клеток при применении водного раствора молекулярного водорода в экспериментальной модели поллиноза, отягощенной воздействием химических агентов.
Материалы и методы. Для экспериментального моделирования аллергического ринита были выбраны самцы крыс линии Wistar. Воздействие пыльцевых и химических агентов осуществлялось в течение 55 дней на 34 группы по 6 животных в каждой. Для оценки морфологических изменений в тканях слизистой полости носа были применены окрашивание раствором Гимза и комбинированная методика окрашивания (патент № 2781558 от 13.10.2022 г.). Ограничения исследования: не были включены группы сравнения способов введения водного раствора, обогащенного молекулярным водородом, по отношению к физиологическому раствору.
Результаты. Морфологическая оценка микропрепаратов, полученных от экспериментальных животных, выявила количественные и качественные изменения в группах изолированного и комбинированного воздействия пыльцевых и химических агентов, а также подтвердила лечебное и профилактическое действие водного раствора, обогащенного молекулярным водородом.
Заключение. Комбинированное воздействие аллергенов пыльцы и нитратов/нитритов приводит к значительной активации тучных клеток в сравнении с группой контроля и группами изолированного воздействия веществ. Лечебные и профилактические эффекты молекулярного водорода приводят к снижению количества дегранулирующих форм тучных клеток.
Ключевые слова
Для цитирования:
Красникова А.А., Самодурова Н.Ю., Шишкина В.В., Герасимова О.А., Самойленко Т.В., Есауленко Д.И., Горюшкина Е.С., Антакова Л.Н. Гигиенические и морфологические аспекты применения водного раствора молекулярного водорода в экспериментальной модели поллиноза. Здоровье населения и среда обитания – ЗНиСО. 2023;31(12):91-98. https://doi.org/10.35627/2219-5238/2023-31-12-91-98
For citation:
Krasnikova A.A., Samodurova N.Yu., Shishkina V.V., Gerasimova O.A., Samoilenko T.V., Esaulenko D.I., Goryushkina Y.S., Antakova L.N. Hygienic and Morphological Aspects of Using the Aqueous Solution of Molecular Hydrogen in an Experimental Model of Hay Fever. Public Health and Life Environment – PH&LE. 2023;31(12):91-98. (In Russ.) https://doi.org/10.35627/2219-5238/2023-31-12-91-98
Введение. Пандемия аллергических заболеваний считается расплатой человечества за стремительный цивилизационный прогресс [1]. Множественные факторы урбанизации лимитируют адаптационные возможности организма человека, делая его подверженным воздействию аллергических агентов. Аллергический ринит от пыльцы растений занимает лидирующее место в структуре аллергопатологии. Заболевание вносит изменения в повседневную рабочую, учебную, бытовую деятельность [2–4]. Прямые и косвенные затраты здравоохранения на лечение аллергического ринита характеризуются ростом год от года [5–7].
Барьерные ткани организма содержат мощный пул клеток, защищающих организм от воздействия различных пыльцевых и химических агентов (ХА), одни из которых – тучные клетки (ТК) [8–9]. Аккумулируя огромное количество химических агентов, окружающая среда через различные объекты жизнедеятельности человека способствует поступлению их в организм.
На территории Воронежской области заболеваемость поллинозами выше среди детского и подросткового населения. К территориям с высоким риском заболеваемости отнесены 8 районов [10].
Воздействие аллергенных компонентов вызывает активацию многочисленных воспалительных элементов и влечет за собой дисфункцию эпителиальных клеток, вследствие чего выделяются активные формы кислорода (АФК), эффекты которых усугубляются от воздействия ХА [11–12].
В качестве маркера оценки воздействия поллютантов на слизистую носа животных в эксперименте нами были выбраны тучные клетки (ТК).ТК обнаруживаются практически во всех органах человека, особенно велико их количество в местах, контактирующих с окружающей средой [13]. ТК являются дирижерами состояния специфического тканевого микроокружения [14]. Во время дегрануляции ТК происходит высвобождение медиаторов, которые несомненно играют важную роль в патогенезе развития реакции гиперчувствительности [15]. Поиск новых эффективных методов влияния на функциональную активность ТК как с терапевтическим, так и профилактическим эффектами представляют особый интерес. В частности, известные биологические эффекты молекулярного водорода (Н2) позволяют рассматривать водород в качестве эффективного молекулярного агента [16–17].
Цель исследования: морфологическая оценка количественного состава ТК при изолированном и комбинированном воздействии пыльцевых и химических агентов, а также морфологическое обоснование применения водного раствора, обогащенного молекулярным водородом для вторичной профилактики поллиноза.
Материалы и методы. Экспериментальное моделирование поллиноза с последующим воздействием ХА и водного раствора (ВР) Н2 проводилось на базе НИИ экспериментальной биологии и медицины ФГБОУ ВО «ВГМУ им. Н.Н. Бурденко» Минздрава России. В эксперименте продолжительностью 55 дней приняли участие 204 половозрелых самца крыс (34 группы, n = 6) линии Wistar массой (200 ± 10) грамм. Период исследования с 18.05.2022 по 11.07.2022. После поступления животных из питомника в НИИ ЭБМ в течение 7 дней происходила их адаптация к условиям содержания.
Экстракты аллергенов (ЭА) березы повислой и амброзии поллынолистной были выбраны, как наиболее распространенные пыльцевые аллергены Воронежской области [18–19]. Применялись медицинские иммунобиологические препараты производства АО «НПО «Микроген», Россия, концентрация 10 000 PNU.
В эксперименте применялось изолированное, а также комбинированное воздействие пыльцевых и ХА. Согласно проведенным экспериментальным исследованиям, моделирование аллергического ринита осуществлялось в два этапа [20–24]. Проведена базовая и интраназальная стимуляция растворами ЭА.
Введение растворов ЭА пыльцы представлено в таблице.
В качестве ХА были использованы нитрат и нитрит натрия производства ООО «Предприятие “РОД”» и АО «База № 1 химреактивов», Россия. Нитратное загрязнение питьевой воды и пищевых продуктов на территории Воронежской области, по данным социально-гигиенического мониторинга, является актуальной проблемой [25–26]. ХА были разведены в физиологическом растворе NaCl до 2 мл для внутрижелудочного введения. Расчет дозы ХА, вводимой экспериментальным животным, определялся на основании публикаций с аналогичными исследованиями [27–29]. По итогам предварительного химического воздействия была определена необходимая экспериментальная доза, приводящая к регистрации метгемоглобина в крови, – 34 ± 1,65 мг NaNO3 и 1,2 ± 0,12 мг NaNO2. За действующим веществом следовал период воздействия ВР Н2, который готовили c использованием картриджа aquela 8.0 (производитель Aquelablue). Введение ВР Н2 осуществлялось в группах животных № 2, 5 интраназально, в группах № 8, 11, 33 внутрижелудочно, в группах № 14, 17, 20, 23, 26, 29 интраназально и внутрижелудочно (таблица). Для доказательства положительного профилактического эффекта ВР Н2, в эксперименте были выделены группы, в которых после основных блоков введения пыльцевых и химических агентов следовал период без воздействия. В экспериментальных группах, где производилось ВР Н2, и в группах с периодом без воздействия после периода интраназальной стимуляции ЭА проводилась поддерживающая сенсибилизация. В группе контроля (ГК) № 31 осуществлялось интраназальное воздействие физиологического раствора (таблица).
После завершения экспериментального воздействия на следующие сутки животные подвергались передозировке ингаляционным наркозом (Изофлуран). Вывод был осуществлен на 15-й день эксперимента в группах № 7, 10, 32, на 28-й день в группах № 1, 4, на 29-й день в группах № 8, 9, 11, 12, 33, 34, на 42-й день в группах № 2, 3, 5, 6, 13, 16, 19, 22, 25, на 55-й день в группах № 14, 15, 17, 18, 20, 21, 23, 24, 26, 27, 29–31. Для морфологического исследования производился забор участка слизистой оболочки. Подготовленные срезы окрашивали гематоксилином и эозином, идентификация ТК осуществлялась окрашиванием раствором Гимза. Оценивали общее количество ТК, дегрануляцию, межклеточное взаимодействие и наличие свободнолежащих гранул.
Для функциональной характеристики ТК был использован запатентованный способ окрашивания триптаза-позитивных тучных клеток с докрашиванием раствором Май – Грюнвальда1. Морфометрический анализ проводился на микроскопе ZEISS AxioImager. A2. Использовалась программа Statistica 12.0. Для оценки достоверности различий использован параметрический критерий Стьюдента для независимых числовых выборок.
Результаты. Выявлено, что в процессе базовой стимуляции в течение первых 14 дней у животных экспериментальных групп симптомы не наблюдались. После начала интраназального введения ЭА пыльцы у животных всех групп отмечались симптомы аллергического ринита до 30–37 дня эксперимента.
ТК слизистой оболочки ГК характерно располагались периваскулярно и вокруг клеток жировой ткани, преимущественно либо без признаков дегрануляции, либо слабой выраженности. При воздействии ЭА и ХА происходила активная миграция ТК в локусы воздействия и увеличение численности клеточной популяции с признаками их активации и высвобождения медиаторов (рис. 2). Оценка микропрепаратов, окрашенных раствором Гимза, показала достоверное увеличение количества ТК с метахромазией до 3 раз во всех исследуемых группах по отношению к ГК (p < 0,05) (рис. 1).
В группе воздействия ХА количество ТК также достоверно превышало значения ГК (p < 0,05) (рис. 1), однако выявить характерные особенности при данном окрашивании не удалось.
В связи с этим особый интерес представляла комбинированная оценка секретома, позволившую визуализировать метахроматично окрашенные и триптаза-позитивные ТК в одном микропрепарате (рис. 3). Наполненность метахроматичных ТК риптаза-позитивными гранулами на 1/3 и 2/3 отмечена при воздействии ЭА пыльцы березы и амброзии, по сравнению с ГК (рис. 3). Отмечалась активизация секреции и высвобождения триптазы ТК с заполнением гранул триптазой на 1/3, 2/3 и 3/3 цитоплазмы в группе с комбинированным воздействием, особенно, в группах с комбинацией введения ЭА амброзии и ХА (↑протеазы в 2,9 раза) (рис. 2, 3).
Воздействие ВР Н2, приводило к снижению степени дегрануляции ТК, снижению активации ТК и уменьшению их количества на 5–30 % в группах с различными комбинациями ЭА и ХА (p < 0,05) (рис. 1).
Таблица. Алгоритм экспериментального воздействия
Table. Algorithm of experimental exposures
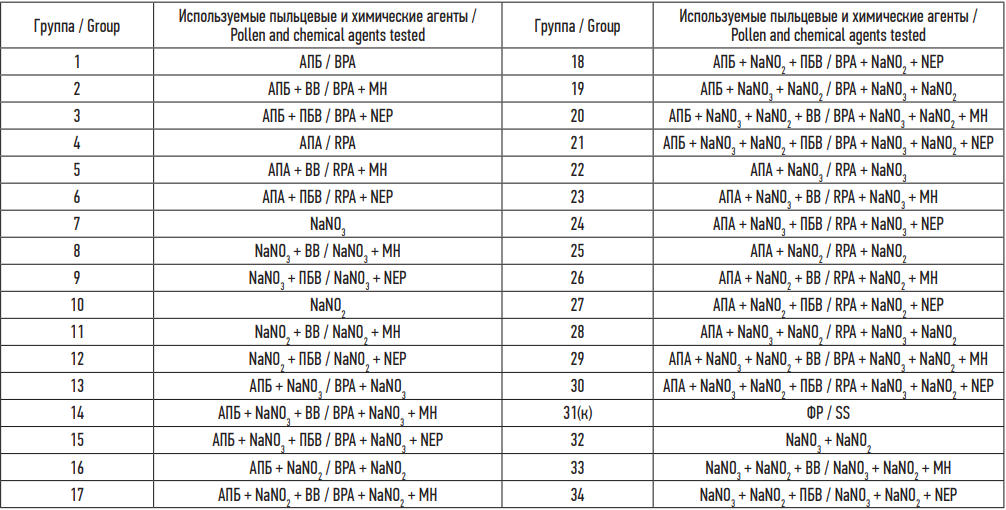
Примечание: АПБ – Экстракт аллергена пыльцы березы; АПА – Экстракт аллергена пыльцы амброзии; NaNO3 – Водный раствор нитрата натрия; NaNO2 – Водный раствор нитрита натрия; NaNO3 + NaNO2 – Водный раствор нитрата и нитрита натрия; ВВ – Водный раствор молекулярного водорода; ПБВ – Период без воздействия; ФР – Физиологический раствор.
Notes: BPA, birch pollen allergen extract; RPA, ragweed pollen allergen extract; NaNO3, aqueous solution of sodium nitrate; NaNO2, aqueous solution of sodium nitrite; NaNO3 + NaNO2, aqueous solution of sodium nitrate and sodium nitrite; MH, aqueous molecular hydrogen solution; NEP, null exposure period; SS, saline solution.
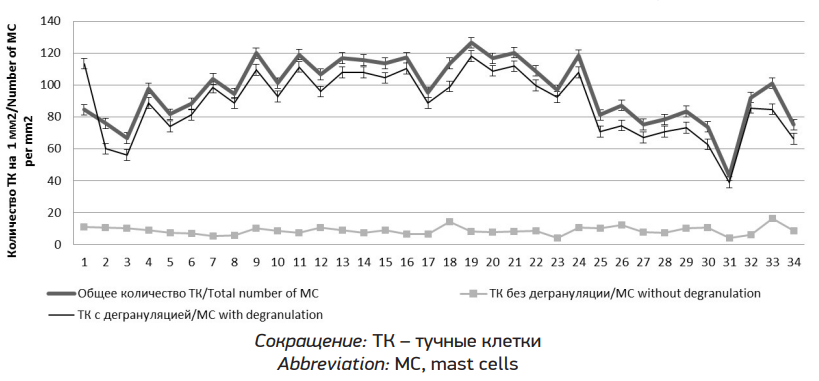
Рис. 1. Анализ представительства ТК в слизистой оболочке носовой полости по экспериментальным группам
Fig. 1. Analysis of mast cell representation in the nasal mucosa by experimental groups
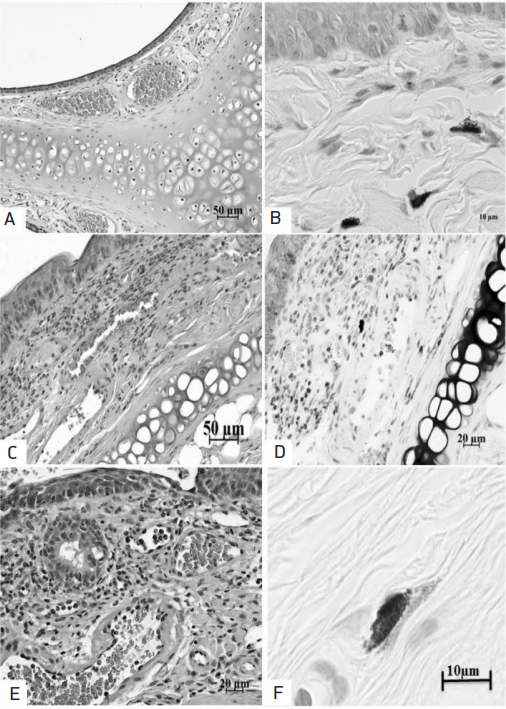
Рис. 2. Слизистая оболочка полости носа крыс линии Wistar в условиях физиологической нормы (А, B), воздействия ЭА (C, D) и комбинированного воздействия ЭА и ХА (E, F). А – собственная пластинка слизистой оболочки; B – мукозная популяция ТК с признаками умеренной и выраженной дегрануляционной активности; C – проявление реакции на воздействие ЭА пыльцы березы; D – рекрутированные нейтрофилы и эозинофилы амплифицируют и поддерживают воспалительный фон; E – краевое стояние гранулоцитов, инфильтрация стромы гранулоцитарными и лимфоцитарными клеточными представителями в ответ на воздействие ЭА пыльцы березы и нитрата натрия; F – ТК (базофильное окрашивание) в солокализации с эозинофилом (розовый цвет гранул). Методика окрашивания гематоксилином и эозином (А, C, E) и раствором Гимзы (B, D, F). Масштабный отрезок А, C – 50 мкм, D, E – 20 мкм и B, F – 10 мкм
Fig. 2. The nasal mucosa of Wistar rats under conditions of physiological norm (A, B), exposure to allergen extracts (C, D), and combined exposure to allergens and chemical pollutants (E, F). Image A shows the lamina propria of the mucous membrane; B – mucosal population of mast cells with signs of moderate and severe degranulation activity; C – manifestation of the reaction to birch pollen allergen exposure; D – recruited neutrophils and eosinophils amplify and maintain the inflammatory background; E – marginal standing of granulocytes, infiltration of the stroma by granulocytic and lymphocytic cellular representatives in response to exposure to the birch pollen allergen extract and sodium nitrate; E – mast cells (basophilic staining) co-localized with eosinophil (pink color of granules). Method of staining with hematoxylin and eosin (A, C, E) and Giemsa solution (B, D, F). Scale bar A, C, 50 µm; D, E, 20 µm; and B, F, 10 µm
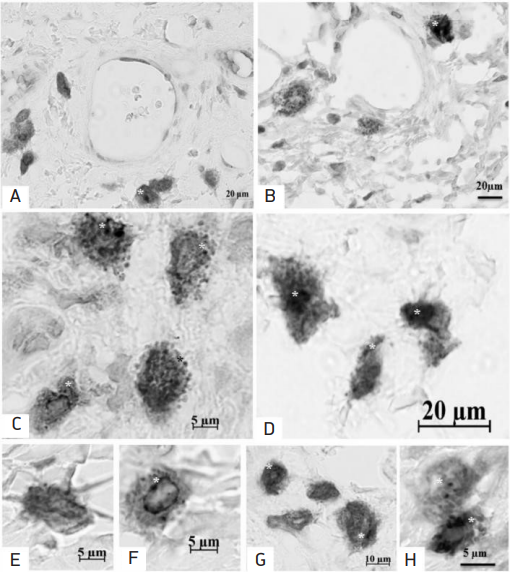
Рис. 3. Тучные клетки с метахромазией и триптазой слизистой оболочки носовой полости. А, E – ТК ГК с преимущественным содержанием компонентов секретома, обеспечивающих метахромазию; B – метахроматичные ТК с триптаза-позитивными гранулами группы с воздействием аллергена амброзии; C, D, F, H – различное содержание триптазы ТК при комбинированном воздействии ЭА пыльцы амброзии и химических загрязнителей (1/3 – C, F, 2/3 – D, 3/3 – C, H); G – ТК без признаков дегрануляции и с низким уровнем триптазы в группе комбинированного воздействия пыльцевых и химических агентов (коричневое окрашивание триптазы отмечено звездочкой). Масштабный отрезок: А, B, D – 20 мкм, G – 10 мкм, остальные – 5 мкм
Fig. 3. Mast cells with metachromasia and tryptase in the nasal mucosa. A, E – MC of the CG with a predominant content of secretome components providing metachromasia; B – metachromatic MCs with tryptase-positive granules of the group with exposure to the ragweed allergen; C, D, F, H – different content of TK tryptase under combined exposure to ragweed pollen allergens and chemical pollutants (1/3 – C, F, 2/3 – D, 3/3 – C, H); G – TC without signs of degranulation and with a low level of tryptase in the group of combined exposure to digital and chemical agents (brown staining of tryptase is marked with an asterisk). Scale bar: A, B, D – 20 µm, G – 10 µm, the rest – 5 µm
Обсуждение. Изолированное воздействие пыльцевых ЭА в эксперименте приводило к развитию признаков аллергического процесса с классическими клиническими симптомами.
В настоящее время имеются многочисленные экспериментальные данные, демонстрирующие важную роль АФК в регуляции дегрануляции ТК на in vitro и in vivo моделях. АФК могут стимулировать выработку многих провоспалительных медиаторов ТК, например триптазы [24]. Использование H2 в качестве вещества с антиоксидантными свойствами обеспечивает снижение активности дегрануляции ТК и, как следствие, снижение АФК. Данные эффекты Н2 проявлялись во всех группах воздействия как с одинарным интраназальным или внутрижелудочным введением, так и при комбинации двух методов введения ВР H2. ТК тесно вовлечены в развитие биологических эффектов Н2 и могут оказывать влияние на развитие его противоаллергических, противовоспалительных, антиапоптотических, иммуномодулирующих, вазотропных эффектов и эффектов ремоделирования внеклеточного матрикса [24].
Заключение. Отмечен возможный профилактический эффект ВР Н2, на течение аллергического процесса, отягощенного введением ХА, вне зависимости от способа его введения. Применение ВР Н2, способствовало достоверному (p < 0,05) уменьшению численности метахроматичных и триптаза-позитивных ТК, снижению их дегрануляции, что может свидетельствовать о стабилизирующем влиянии Н2 на процесс активации ТК. Интраназальное введение ВР Н2 было достаточным для локального развития эффекта снижения реактивности тканей на воздействие ЭА.
1. Атякшин Д.А., Шишкина В.В., Будневский А.В. и др. Способ окрашивания триптаза-позитивных тучных клеток в микропрепаратах тканей c докрашиванием раствором Май-Грюнвальда. Свидетельство о государственной регистрации ПрЭВМ, рег. № 2781558 от 13.10.2022. М.: Роспатент, 2022. Доступно по: https://patents.google.com/patent/RU2781558C1/ru. Ссылка активна на 04.08.2023.
Список литературы
1. García-García C, Kim M, Baik I. Associations of dietary vitamin A and C intake with asthma, allergic rhinitis, and allergic respiratory diseases. Nutr Res Pract. 2023;17(5):997-1006. doi: 10.4162/nrp.2023.17.5.997
2. Овчинников А.Ю., Мирошниченко Н.А., Симсова В.А. Эбастин в лечении больных аллергическим ринитом // Медицинский совет. 2019. № 12. С. 58–62. doi: 10.21518/2079-701X-2019-12-58-62
3. Павлюченко И.И., Клименко Я.В., Федотова Н.В., Коков Е.А., Кокова Л.Н., Сторожук А.П., Цымбалов О.В. Аэропалинологический мониторинг состояния окружающей среды в отдельно взятом регионе как фактор профилактики поллиноза // Инновационная медицина Кубани. 2023. № 3. С. 62–70. doi.org/10.35401/2541-9897-2023-26-3-62-70
4. Абатуров А.Е., Кривуша Е.Л., Бабич В.Л. Антигистаминные препараты при лечении аллергического ринита у детей // Здоровье ребенка. 2018. Т. 13. № 1. С. 68–79 doi: 10.22141/2224-0551.13.1.2018.127068
5. Омушева С.Э. Современная диагностика и лечение аллергического ринита у детей в Кргизской Республике // Бюллетень науки и практики. 2020. Т. 6. № 1. С. 129–137. doi: 10/33619/2414-2948/50/14
6. Bergmann KC, Brehler R, Endler C, et al. Impact of climate change on allergic diseases in Germany. J Health Monit. 2023;8(Suppl 4):76-102. doi: 10.25646/11654
7. Berger M, Bastl M, Bouchal J, Dirr L, Berger U. The influence of air pollution on pollen allergy sufferers. Allergol Select. 2021;5:345–348. doi: 10.5414/ALX02284E
8. Berlin F, Mogren S, Ly C, et al. Mast cell tryptase promotes airway remodeling by inducing anti-apoptotic and cell growth properties in human alveolar and bronchial epithelial cells. Cells. 2023;12(10):1439. doi: 10.3390/ cells12101439
9. Franco AS, Murai IH, Takayama L, et al. Assessment of bone microarchitecture in patients with systemic mastocytosis and its association with clinical and biochemical parameters of the disease. Calcif Tissue Int. 2023;113(3):276-285. doi: 10.1007/s00223-023-01107-x
10. Красникова А.А., Самодурова Н.Ю. Заболеваемость аллергическим ринитом (поллинозом) на территории Воронежской области за 10 лет // Санитарный врач. 2023. Т. 20. № 3 (230). С. 181–185. doi:10.33920/med08-2303-06
11. Qu J, Li Y, Zhong W, Gao P, Hu C. Recent developments in the role of reactive oxygen species in allergic as thma. J Thorac Dis. 2017;9(1):E32-E43. doi: 10.21037/ jtd.2017.01.05
12. Sies H, Belousov VV, Chandel NS, et al. Defining roles of specific reactive oxygen species (ROS) in cell biology and physiology. Nat Rev Mol Cell Biol. 2022;23(7):499- 515. doi: 10.1038/s41580-022-00456-z
13. Шишкина В.В., Клочкова С.В., Алексеева Н.Т. и др. Триптазный профиль популяции тучных клеток кожи крыс при раневом процессе // Журнал анатомии и гистопатологии. 2020. Т. 9 № 4. С. 84–89. doi: 10.18499/2225-7357-2020-9-4-84-89
14. Atiakshin D, Samoilova V, Buchwalow I, Boecker W, Tiemann M. Characterization of mast cell populations using different methods for their identification. Histochem Cell Biol. 2017;147(6):683–694. doi: 10.1007/ s00418-017-1547-7
15. Nguyen SMT, Rupprecht CP, Haque A, Pattanaik D, Yusin J, Krishnaswamy G. Mechanisms governing anaphylaxis: Inflammatory cells, mediators, endothelial gap junctions and beyond. Int J Mol Sci. 2021;22(15):7785. doi: 10.3390/ijms22157785
16. Atiakshin D, Kostin A, Volodkin A, et al. Mast cells as a potential target of molecular hydrogen in regulating the local tissue microenvironment. Pharmaceuticals (Basel). 2023;16(6):817. doi: 10.3390/ph16060817
17. Nazarov EI, Khlusov IA, Noda M. Homeostatic and endocrine responses as the basis for systemic therapy with medical gases: ozone, xenon and molecular hydrogen. Med Gas Res. 2021;11(4):174-186. doi: 10.4103/2045-9912.318863
18. Афонин А.Н., Баранова О.Г., Сенатор С.А. и др. Распространение и натурализация Ambrosia Trifida (Asteraceae) на европейской территории России // Ботанический журнал. 2022. Т. 107. № 4. С. 350–359 doi: 10.31857/S0006813622020028
19. Бурменко Ю.В., Баранова Т.В., Калаев В.Н. Сравнительный анализ цитогенетических реакций семенногопотомства березы повислой и родендрона ледебура на антропогенное загрязнение в городе Воронеже // Лесоведение. 2018. № 1. С. 65–73 doi: 10.7868/S0024114818010060
20. Markowska-Szczupak A, Wesołowska A, Borowski T, et al. Effect of pine essential oil and rotating magnetic field on antimicrobial performance. Sci Rep. 2022;12(1):9712. doi: 10.1038/s41598-022-13908-5
21. Kim DW, Kim DK, Eun KM, et al. IL-25 could be involved in the development of allergic rhinitis sensitized to house dust mite. Mediators Inflamm. 2017;2017:3908049. doi: 10.1155/2017/3908049
22. Awane S, Nishi K, Ishida M, et al. Inhibitory effect of Japanese black vinegar on IgE-mediated degranulation of RBL-2H3 cells and a murine model of Japanese cedar pollinosis. Cytotechnology. 2018;70(3):961-974. doi: 10.1007/s10616-018-0208-6
23. Jung HJ, Ko YK, Shim WS, et al. Diesel exhaust particles increase nasal symptoms and IL-17A in house dust mite-induced allergic mice. Sci Rep. 2021;11(1):16300. doi: 10.1038/s41598-021-94673-9
24. Choi S, Jung M-A, Hwang Y-H, et al. Anti-allergic effects of Asarum heterotropoides on an ovalbumin-induced allergic rhinitis murine model. Biomed Pharmacother. 2021;141:111944. doi: 10.1016/j.biopha.2021.111944
25. Механтьев И.И., Клепиков О.В., Куролап С.А., Попова Л.В. Современные гигиенические проблемы питьевого водоснабжения населения Воронежской области // Тенденции развития науки образования. 2021. № 79(1). С. 28–32. doi: 10.18411/trnio-11-2021-09
26. Пчелинцева А.А., Самодурова Н.Ю., Мамчик Н.П. Нитратная контаминация пищевых продуктов на территории Воронежской области // Сборник научных статей по итогам VIII межвузовской научно-практической конференции «Гигиенические, эпидемиологические и экологические аспекты профилактики заболеваемости на региональном уровне. Воронеж: ООО «Цифровая полиграфия». 2023. С. 30–33.
27. Suparmi S, Fasitasari M, Martosupono M, Mangimbulude JC. Comparisons of curative effects of chlorophyll from Sauropus androgynus (L) merr leaf extract and Cu-chlorophyllin on sodium nitrate-induced oxidative stress in rats. J Toxicol. 2016;2016:8515089 doi: 10.1155/2016/8515089
28. Kramkowski K, Leszczynska A, Przyborowski K, et al. Short-term treatment with nitrate is not sufficient to induce in vivo antithrombotic effects in rats and mice. Naunyn Schmiedebergs Arch Pharmacol. 2017;390(1):85–94. doi: 10.1007/s00210-016-1308-5
29. Lee JW, Lee DH, Park JK, Han JS. Sodium nitrite-derived nitric oxide protects rat testes against ischemia/ reperfusion injury. Asian J Androl. 2018;21(1):92-97. doi: 10.4103/aja.aja_76_18
30. Атякшин Д.А., Шишкина В.В., Будневский А.В. и др. Способ окрашивания триптаза-позитивных тучных клеток в микропрепаратах тканей c докрашиванием раствором Май-Грюнвальда. Свидетельство о государственной регистрации ПрЭВМ, рег. № 2781558 от 13.10.2022. М.: Роспатент, 2022. Доступно по: https://patents. google.com/patent/RU2781558C1/ru. Ссылка активна на 04.08.2023.
Об авторах
А. А. КрасниковаРоссия
Красникова Алина Алексеевна – аспирант кафедры эпидемиологии
ул. Студенческая, д. 10, г. Воронеж, 394036
Н. Ю. Самодурова
Россия
Самодурова Наталья Юрьевна – к.м.н., доцент, декан медико-профилактического факультета, доцент кафедры эпидемиологии
ул. Студенческая, д. 10, г. Воронеж, 394036
В. В. Шишкина
Россия
Шишкина Виктория Викторовна – к.м.н., доцент, директор НИИ экспериментальной биологии и медицины
Московский пр., д. 185а, г. Воронеж, 394066
О. А. Герасимова
Россия
Герасимова Ольга Андреевна – к.б.н., старший научный сотрудник НИИ экспериментальной биологии и медицины
Московский пр., д. 185а, г. Воронеж, 394066
Т. В. Самойленко
Россия
Самойленко Татьяна Валерьевна – научный сотрудник НИИ экспериментальной биологии и медицины
Московский пр., д. 185а, г. Воронеж, 394066
Д. И. Есауленко
Россия
Есауленко Дмитрий Игоревич, старший научный сотрудник НИИ экспериментальной биологии и медицины
Московский пр., д. 185а, г. Воронеж, 394066
Е. С. Горюшкина
Россия
Горюшкина Елена Сергеевна – лаборант НИИ экспериментальной биологии и медицины
Московский пр., д. 185а, г. Воронеж, 394066
Л. Н. Антакова
Россия
Антакова Любовь Николаевна – старший научный сотрудник НИИ экспериментальной биологии и медицины
Московский пр., д. 185а, г. Воронеж, 394066
Рецензия
Для цитирования:
Красникова А.А., Самодурова Н.Ю., Шишкина В.В., Герасимова О.А., Самойленко Т.В., Есауленко Д.И., Горюшкина Е.С., Антакова Л.Н. Гигиенические и морфологические аспекты применения водного раствора молекулярного водорода в экспериментальной модели поллиноза. Здоровье населения и среда обитания – ЗНиСО. 2023;31(12):91-98. https://doi.org/10.35627/2219-5238/2023-31-12-91-98
For citation:
Krasnikova A.A., Samodurova N.Yu., Shishkina V.V., Gerasimova O.A., Samoilenko T.V., Esaulenko D.I., Goryushkina Y.S., Antakova L.N. Hygienic and Morphological Aspects of Using the Aqueous Solution of Molecular Hydrogen in an Experimental Model of Hay Fever. Public Health and Life Environment – PH&LE. 2023;31(12):91-98. (In Russ.) https://doi.org/10.35627/2219-5238/2023-31-12-91-98









.png)



























