Перейти к:
Злокачественные новообразования в промышленном городе: эпидемиология, современные тенденции и прогноз
https://doi.org/10.35627/2219-5238/2023-31-12-17-26
Аннотация
Введение. Высокую актуальность приобретает оптимизация информационно-аналитического обеспечения социально-гигиенического мониторинга на основе современных технологий математического моделирования и прогнозирования, многомерных статистических методов и искусственных нейронных сетей.
Цель исследования: ретроспективный и проспективный эпидемиологический анализ заболеваемости злокачественными новообразованиями в городе Таганроге Ростовской области за 1985–2022 гг.
Материалы и методы. Проведен комплексный анализ статистических отчетных форм и персонифицированной базы данных о злокачественных новообразованиях за многолетний период с применением факторного анализа, иерархического кластерного анализа, оценки реального риска и искусственных нейронных сетей. Использовано программное обеспечение собственной разработки, а также пакеты программ IBM SPSS Statistics, version 19.0, и Matlab R2021a с набором инструментов Neural Network Toolbox.
Результаты. Данные исследований свидетельствуют о неблагоприятной ситуации в городе Таганроге Ростовской области с превышением среднемноголетнего уровня частоты злокачественных новообразований для городов области в 1,3 раза и тенденцией к дальнейшему росту. Определены половозрастные особенности и приоритетные локализации злокачественных новообразований. На основе региональных критериев оценки реального риска установлено, что Таганрог по онкологической заболеваемости и смертности, а также по семи отдельным локализациям занимает среди городов первое ранговое место. Наиболее высокий реальный риск диагностирован для злокачественных новообразований молочной железы и кожи. С применением факторного анализа и иерархического кластерного анализа изучена структура факторов риска при злокачественных новообразованиях ободочной кишки за 1988–2019 гг. Применение метода искусственных нейронных сетей обеспечило более высокую точность при среднесрочном прогнозировании частоты злокачественных новообразований по сравнению с экстраполяционным прогнозированием по теоретическим линиям тенденций.
Заключение. Применение многомерных статистических методов и искусственных нейронных сетей обеспечивает высокоинформативную характеристику состояния здоровья населения на популяционном уровне.
Ключевые слова
Для цитирования:
Марченко Б.И., Нестерова О.А., Тарасенко К.С. Злокачественные новообразования в промышленном городе: эпидемиология, современные тенденции и прогноз. Здоровье населения и среда обитания – ЗНиСО. 2023;31(12):17-26. https://doi.org/10.35627/2219-5238/2023-31-12-17-26
For citation:
Marchenko B.I., Nesterova O.A., Tarasenko K.S. Malignant Neoplasms in the Industrial City: Epidemiology, Current Trends and Forecast. Public Health and Life Environment – PH&LE. 2023;31(12):17-26. (In Russ.) https://doi.org/10.35627/2219-5238/2023-31-12-17-26
Введение. Химическое загрязнение компонентов среды обитания с контаминацией экополлютантами продуктов питания и питьевой воды обуславливает риски для здоровья населения России, что проявляется в дополнительных случаях экологически зависимой патологии и увеличении смертности [1][2]. «Концепция развития системы социально-гигиенического мониторинга в Российской Федерации на период до 2030 года»1 как приоритетные направления деятельности декларирует оптимизацию информационно-аналитического обеспечения оценки и управления рисками с внедрением в практику наукоемких технологий и результатов фундаментальных исследований в области гигиены. Одной из ключевых целей при этом является усиление потенциала национальной системы социально-гигиенического мониторинга (СГМ) в рамках риск-ориентированной и профилактической модели надзорной деятельности, существенно возрастает роль научных прогнозов и развития методов профилактики риск-ассоциированных потерь здоровья с целью достижения национального приоритета – повышения ожидаемой продолжительности жизни населения России [2][5–7]. Дальнейшее развитие их методологической базы интеграции исследований гигиенического и эпидемиологического типов включает широкое применение современных технологий математического моделирования и прогнозирования, многомерных статистических методов и искусственных нейронных сетей [3–5][8][9].
К числу высокоинформативных параметров, характеризующих состояние здоровья населения на популяционном уровне, традиционно относится заболеваемость злокачественными новообразованиями (ЗН). Это определяется их высокой социально-экономической и медицинской значимостью, а также существенной ролью средовых факторов риска в возникновении данной патологии [10–13]. Доказано участие в возникновении и развитии ЗН многочисленных факторов риска наследственного, средового (инициаторы и промоторы канцерогенеза), профессионально-производственного и индивидуального характера [13–18]. Так, около трети случаев смерти от ЗН связывается с избыточной массой тела, дефицитом овощей и фруктов в рационе, низкой физической активностью и употреблением алкоголя. Приоритетным фактором риска признается табакокурение, с которым ассоциировано свыше 22 % случаев смерти от ЗН [13][17][19–21]. Указанные факторы рассматриваются как этиология почти 70 % предотвратимых ЗН, включая рак легких, молочной железы, ободочной и прямой кишки [18]. Среди средовых факторов онкологического риска наряду с химическим загрязнением атмосферы и почвы [14][15][18] существенное значение имеют продукты гиперхлорирования питьевой воды [22]. Внедрение программ профилактики и скрининговых программ раннего выявления онкологических заболеваний в целях сокращения уровня онкологической смертности отнесено к основным задачам демографической политики Российской Федерации на период до 2025 года2.
Мультикаузальная природа ЗН определяет перспективность использования в процедуре анализа по факторам риска при ведении СГМ многомерных статистических методов, в том числе факторного анализа, кластерного анализа и множественного регрессионного анализа [23][24].
Цель исследования: ретроспективный и проспективный эпидемиологический анализ заболеваемости злокачественными новообразованиями в городе Таганроге Ростовской области за 1985–2022 гг.
Материалы и методы. При ретроспективном и проспективном анализе заболеваемости ЗН применены сведения отчетных форм № 35 «Сведения о больных злокачественными новообразованиями» за 1985–2015 гг. и № 7 «Сведения о злокачественных новообразованиях» за 2016–2022 гг. по Ростовской области. Факторный анализ и иерархический кластерный анализ корреляций проведены с применением обезличенной базы данных о потенциальных факторах риска при 2198 случаях заболеваний ЗН ободочной кишки, зарегистрированных в городе Таганроге с населением около 250 тыс. человек в 1988–2019 гг. При обработке материалов использован комплекс методов вариационной статистики, в том числе критерий t-Стьюдента, критерий Шовене и метод Пригге. Характеристика многолетней динамики онкологической заболеваемости выполнена на основе парного нелинейного регрессионного анализа. Региональные критерии для характеристики частоты ЗН рассчитаны с применением авторского метода оценки реального риска3. Частная оценка ситуации по отдельным локализациям ЗН дополнена интегральной оценкой реального риска по девяти приоритетным локализациям ЗН на основе кумулятивной нелинейной модели [26].
Качественная интерпретация извлеченных групповых (латентных) факторов заключалась в смысловой идентификации через первичные (регистрируемые) факторы риска, которые подвергались дальнейшей классификации методом ИКА с графическим представлением результата в виде дендрограммы. Использовано программное обеспечение собственной разработки, включая программный комплекс Turbo oncologist, version 2.01, а также профессиональный пакет статистических программ IBM SPSS Statistics (Statistical Package for Social Science), version 19.0. Использованная при апробации альтернативного метода прогнозирования онкологической заболеваемости искусственная нейронная сеть (ИНС) сформирована в среде пакета прикладных программ Matlab R2021a с набором инструментов для синтеза и анализа нейронных сетей Neural Network Toolbox. Обучение ИНС по типу многослойного персептрона прямого распространения сигнала проводилось по алгоритму Левенберга–Марквардта (Levenberg–Marquardt method), предназначенного для оптимизации параметров нелинейных регрессионных моделей при решении задач о наименьших квадратах [27–29].
Результаты. Сравнительный анализ показал, что уровень общей онкологической заболеваемости в Таганроге соответствует первому ранговому месту среди городов Ростовской области и превышает аналогичный показатель для городского населения (373,98 %ooo) в 1,30 раза. При этом стабильно неблагоприятная ситуация отмечена по заболеваемости ЗН желудка, ободочной и прямой кишки, молочной железы, яичника, предстательной железы и мочевого пузыря. В 2018–2022 гг. обращает на себя внимание относительное неблагополучие по ЗН трахей, бронхов и легкого, а также по злокачественным лимфомам (см. табл. 1).
В структуре онкологической заболеваемости населения Таганрога в 2008–2022 гг. первые пять ранговых мест занимают ЗН кожи (15,8 % без учета меланомы); молочной железы (12,7 %); трахеи, бронхов и легкого (9,0 %); ободочной кишки (6,8 %) и предстательной железы (6,5 %). Наибольшая частота по сумме локализаций ЗН приходится на старшие возрастные группы, причем как среди мужчин, так и среди женщин ее максимальный уровень свойствен для лиц в возрасте 70–74 года.
При расчете фоновых уровней онкологической заболеваемости для городского населения Ростовской области был использован 15-летний период 2005– 2019 гг., так как из-за пандемии COVID-19 сведения о зарегистрированных ЗН на ряде территорий в 2020 и 2021 гг. оказались существенно занижены. В табл. 2 указано, что по результатам частной оценки за 2008–2022 гг. в соответствии с региональными критериями реальный риск для населения Таганрога по сумме локализаций ЗН оценивается как высокий, что соответствует первому ранговому месту среди городов Ростовской области. Неблагополучие по онкологической заболеваемости для населения Таганрога подтверждается повышенной степенью ее реального (эпидемиологического) риска по результатам интегральной оценки и высоким риском онкологической смертности при первых ранговых местах среди аналогичных показателей городов областного подчинения.
На основе динамических рядов годовых показателей частоты ЗН продолжительностью 15 лет (2006–2020 гг.) проведена сравнительная оценка точности среднесрочных прогнозов на 2021 и 2022 гг., полученных двумя методами – экстраполяционным и с применением искусственных нейронных сетей (ИНС). В табл. 3 представлены результаты сопоставления точности полученных прогнозов по величинам их абсолютных (∆X, %ooo) и относительных (∆Y, %) погрешностей. Подтверждена более высокая точность среднесрочных прогнозов, полученных с применением ИНС как по сумме ЗН, так и по большинству из шести отдельных локализаций.
Факторный анализ (ФА) позволил за 11 итераций уменьшить до 27 число первичных (регистрируемых) потенциальных факторов риска (ПФР). Критерием отбора ПФР являлись значения их факторных нагрузок 0.500 и более. Идентифицированы, количественно измерены и содержательно интерпретированы три групповых (латентных, скрытых) фактора риска (ГФР), объясняющих 79,205 % суммарной дисперсии. Применение иерархического кластерного анализа корреляций (ИКА) позволило классифицировать и графически представить в виде дендрограммы иерархически организованные подгруппы (кластеры) ПФР, что послужило основой для смысловой интерпретации идентифицированных ГФР. Так, в структуре ГФР 1-го ранга (13 ПФР с суммарной дисперсией 33,209 %) выделены 4 кластера, которые позволяют интерпретировать его как «индивидуальные особенности, отягощенная наследственность, привычные интоксикации и потенциальные факторы риска популяционного уровня». ГФР 2-го ранга (6 ПФР с суммарной дисперсией 30,771 %) включает 2 кластера ПФР, интерпретирован как «преморбидный фон и сопутствующая патология ободочной кишки» ГФР 3-го ранга (8 ПФР с суммарной дисперсией 15,225 %) объединяет 3 кластера, характеризующие его как «неблагоприятные структура рациона и режим питания» (см. рисунок).
Таблица 1. Показатели частоты заболеваемости злокачественными новообразованиями на 100 тысяч населения (частота ± границы доверительных интервалов при p < 0,05, %ooo) по данным за 2008–2022 гг.
Table 1. Cancer incidence rates per 100,000 population (rate ± confidence interval at p < 0.05, %ooo) based on data for 2008–2022
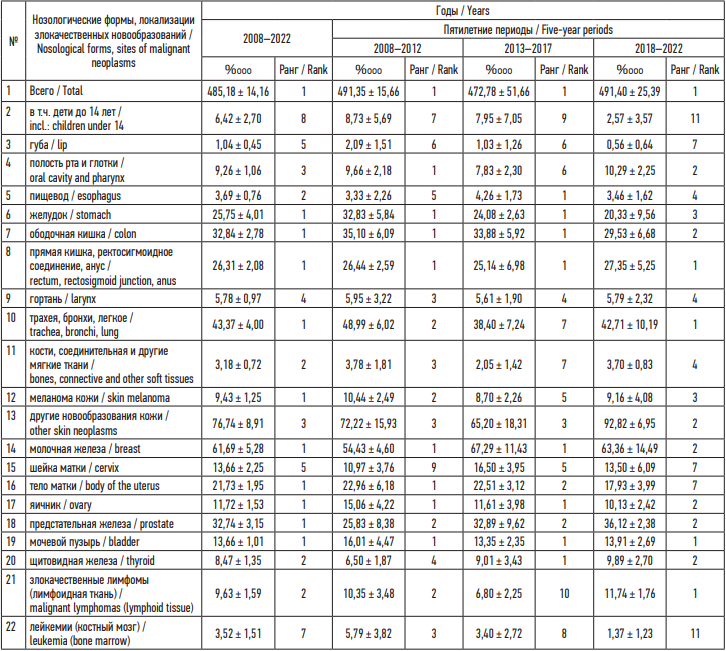
Примечание: в столбце «Ранг» указаны ранговые места города Таганрога по частоте злокачественных новообразований данной локализации среди городов Ростовской области.
Note: The column “Rank” shows ranking places of the city of Taganrog in terms of the incidence of malignant neoplasms of the specific site among the cities of the Rostov Region.
Таблица 2. Оценка реального риска заболеваемости злокачественными новообразованиями и онкологической смертности населения города Таганрога за период 2008–2022 гг.
Table 2. Assessment of the real risk of the incidence of malignant neoplasms and cancer mortality of the population of the city of Taganrog in 2008–2022
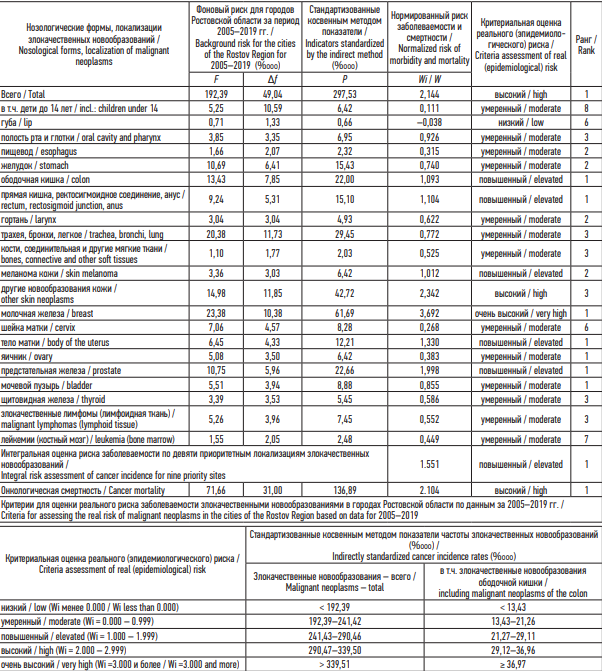
Примечание: F – фоновый риск заболеваемости; ∆f – предельная ошибка фонового риска заболеваемости (p < 0,05); P – стандартизованные косвенным методом показатели заболеваемости; Wi – частный нормированный показатель реального (эпидемиологического) риска заболеваемости; W – обобщенный нормированный показатель реального (эпидемиологического) риска заболеваемости.
Notes: F – background disease risk; ∆f – marginal error of the background disease risk (p < 0.05); P – incidence rates standardized by the indirect method; Wi – a particular normalized indicator of real (epidemiological) disease risk; W – a generalized normalized indicator of real (epidemiological) disease risk.
Таблица 3. Сравнительная оценка точности прогнозов частоты злокачественных новообразований методами экстраполяции по теоретическим линиям тенденций и применения искусственных нейронных сетей по данным за 2006–2020 гг.
Table 3. Comparative assessment of the accuracy of forecasts of the incidence of malignant neoplasms using techniques of extrapolation along theoretical lines of trends and artificial neural networks based on data for 2006–2020
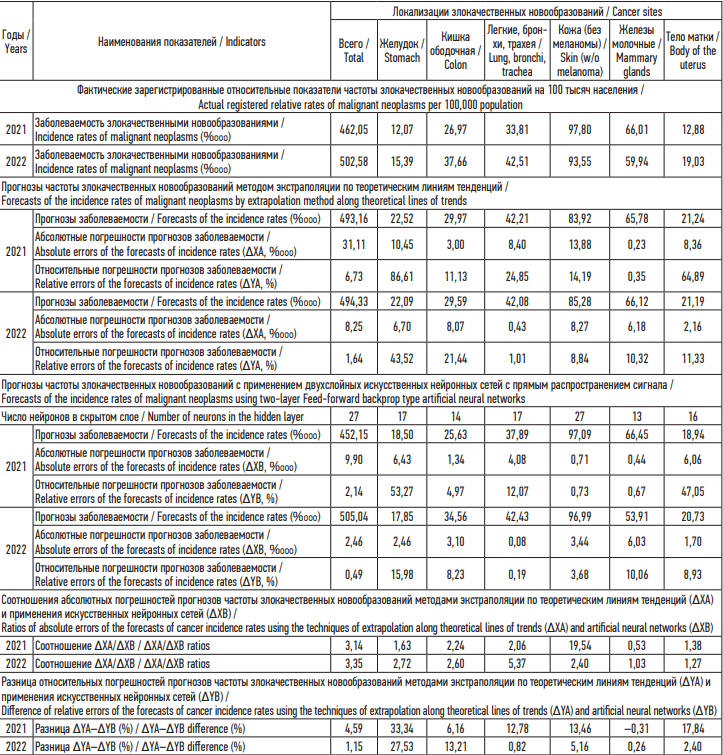
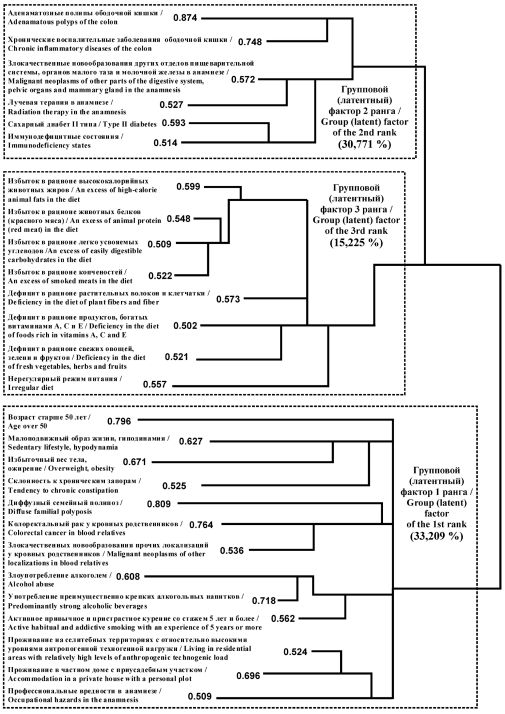
Рисунок. Дендрограмма факторной структуры и значения факторных нагрузок при злокачественных новообразованиях ободочной кишки в г. Таганроге за период 1988–2019 гг. (по результатам кластерного анализа корреляций)
Figure. Dendrogram of the factor structure and the values of factor loads for colon cancer in Taganrog in 1988–2019 (according to the results of the cluster analysis of correlations)
Обсуждение. Результаты исследований свидетельствуют о том, что в Таганроге сформировалась устойчивая тенденция к росту частоты ЗН, что соответствует динамике данной патологии по Российской Федерации с ежегодным приростом в среднем на 1,5 % [11]. На рост частоты ЗН кожи, ободочной, сигмовидной и прямой кишок, молочной и предстательной желез обращают внимание многие зарубежные исследователи [12][17][19][21][30–32]. За период 2008–2022 гг. Таганрог занимал первые ранговые места по общей онкологической заболеваемости, превышающей показатель для городского населения Ростовской области на 30 %, по частоте ЗН желудка, ободочной кишки, прямой кишки, легкого, молочной железы, тела матки, яичника, предстательной железы, мочевого пузыря, а также меланомы кожи. Приоритетными локализациями в структуре ЗН являются кожа (без учета меланомы), молочная железа, легкое, ободочная кишка и предстательная железа. Полученные результаты в целом согласуются с данными Московского НИОИ им. П.А. Герцена, ряда других отечественных и зарубежных исследователей [11][12][30–37].
Установлены высокие степени реального риска общей онкологической заболеваемости и смертности от ЗН в 2008–2022 гг., по стандартизованным показателям которых Таганрог занимает первые ранговые места среди городов области. Очень высокий реальный риск был диагностирован в отношении ЗН молочной железы, высокий – прочих ЗН кожи, повышенный – ЗН пяти локализаций (ободочная кишка, прямая кишка, меланома кожи, тело матки и предстательная железа), а также по его интегральной оценке с учетом 9 приоритетных локализаций.
Из результатов сравнительного анализа апробации среднесрочного прогнозирования с применением технологии искусственных нейронных сетей (ИНС) следует, что применение ИНС обеспечивает более высокую точность прогнозов по сравнению с экстраполяционным прогнозированием по теоретическим линиям тенденций на основе регрессионных моделей.
По данным литературных источников, рак ободочной кишки являются одной из самых распространенных нозологических форм ЗН и причин онкологической смертности с тенденцией роста заболеваемости среди лиц молодого возраста [11–13][38–41]. В ряде исследований показана этиологическая роль избыточного употребления красного мяса, жиров, крепкого алкоголя, а также дефицита в рационе пищевых волокон и ожирения [38][42][43]. Также существует риск того, что нитраты в питьевой воде способны увеличить риск развития рака ободочной кишки из-за эндогенного превращения их в канцерогенные N-нитрозосоединения [44]. Изучение структуры потенциальных факторов риска при ЗН ободочной кишки по Таганрогу за 1988–2019 гг. с применением методов факторного анализа и иерархического кластерного анализа корреляций позволило идентифицировать, количественно определить и содержательно интерпретировать три групповых (латентных, скрытых) фактора риска. Проведенные в 2013–2020 гг. исследования городских почв позволили установить, что приоритетным поллютантом является 3,4-бенз(а)пирен с превышением ПДК в 65,6 % проб (до 45,5 ПДК); по результатам выполненной оценки индивидуальный многомаршрутный канцерогенный риск (CR) равен 2,46·10–3, что соответствует его неприемлемому диапазону De Manifestis Risk, а пожизненный многомаршрутный популяционный канцерогенный риск (PCR) – 621 случаю заболеваний за 70 лет [45].
Выводы
1. В 2008–2022 гг. Таганрог занимает первые ранговые места среди городов Ростовской области по среднемноголетним показателям общей онкологической заболеваемости, частоты злокачественных новообразований десяти приоритетных локализаций. В структуре онкологической заболеваемости на первых пяти ранговых местах находятся злокачественные новообразования кожи без учета меланомы, молочной железы, легкого, ободочной кишки и предстательной железы.
2. На основе региональных оценочных критериев для городского населения Таганрога в 2008–2022 гг. определен высокий реальный (эпидемиологический) риск общих онкологической заболеваемости и смертности; очень высокий – по злокачественным новообразованиям молочной железы; высокий – кожи без учета меланомы; повышенный – ободочной кишки, прямой кишки, тела матки и предстательной железы, а также по результатам интегральной оценки с учетом 9 приоритетных локализаций злокачественных новообразований.
3. Применение факторного анализа и иерархического кластерного анализа корреляций позволило идентифицировать, количественно определить и содержательно интерпретировать три групповых фактора риска злокачественных новообразований ободочной кишки – «индивидуальные особенности, отягощенная наследственность, привычные интоксикации и потенциальные факторы риска популяционного уровня», «преморбидный фон и сопутствующая патология ободочной кишки», «неблагоприятные структура рациона и режим питания».
1. Приказ руководителя Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (Роспотребнадзора) от 26.08.2019 № 665 «Об утверждении концепции развития системы социально-гигиенического мониторинга в Российской Федерации на период до 2030 года».
2. Указ Президента Российской Федерации от 09.10.2007 № 1351 (в редакции Указа Президента Российской Федерации от 01.07.2014 № 483) «Об утверждении Концепции демографической политики Российской Федерации на период до 2025 года».
3. Егорова И.П., Марченко Б.И. Оценка эпидемиологического риска здоровью на популяционном уровне при медико-гигиеническом ранжировании территорий: пособие для врачей. Утверждено секцией по гигиене ученого совета Минздрава Российской Федерации, протокол № 9 от 24.12.1999. М.,1999. 48 с.
Список литературы
1. Попова А.Ю., Зайцева Н.В., Онищенко Г.Г., Клейн С.В., Глухих М.В., Камалтдинов М.Р. Санитарно-эпидемиологические детерминанты и ассоциированный с ними потенциал роста ожидаемой продолжительности жизни населения Российской Федерации // Анализ риска здоровью. 2020. № 1. С. 1–17. doi: 10.21668/health.risk/2020.1.01
2. Зайцева Н.В. Гигиена в решении актуальных проблем развития потенциала здоровья и продолжительности жизни населения Российской Федерации // Гигиена и санитария. 2022. Т. 101. № 10. С. 1138–1144. doi: 10.47470/0016-9900-2022-101-10-1138-1144
3. Попова А.Ю., Кузьмин С.В., Гурвич В.Б. и др. Информационно-аналитическая поддержка управления риском для здоровья населения на основе реализации концепции развития системы социально-гигиенического мониторинга в Российской Федерации на период до 2030 года // Здоровье населения и среда обитания. 2019. № 9 (318). С. 4–12. doi: 10.35627/2219-5238/2019-318-9-4-12
4. Попова А.Ю., Кузьмин С.В., Зайцева Н.В., Май И.В. Приоритеты научной поддержки деятельности санитарноэпидемиологической службы в области гигиены: поиск ответов на известные угрозы и новые вызовы // Анализ риска здоровью. 2021. № 1. С. 4–14. doi: 10.21668/health.risk/2021.1.01
5. Зайцева Н.В., Онищенко Г.Г., Май И.В., Шур П.З. Развитие методологии анализа риска здоровью в задачах государственного управления санитарноэпидемиологическим благополучием населения // Анализ риска здоровью. 2022. № 3. С. 4–20. doi: 10.21668/health.risk/2022.3.01
6. Попова А.Ю., Гурвич В.Б., Кузьмин С.В., Мишина С.В., Ярушин С.В. Современные вопросы оценки и управления риском для здоровья // Гигиена и санитария. 2017. Т. 96. № 12. С. 1125–1129. doi: 10.18821/0016-9900-2017-96- 12-1125-1129
7. Ракитский В.Н., Кузьмин С.В., Авалиани С.Л., Шашина Т.А., Додина Н.С., Кислицин В.А. Современные вызовы и пути совершенствования оценки и управления рисками здоровью населения // Анализ риска здоровью. 2020. № 3. С. 23–29. doi: 10.21668/health.risk/2020.3.03
8. Зайцева Н.В., Клейн С.В., Глухих М.В., Кирьянов Д.А., Камалтдинов М.Р. Прогноз потенциала роста ожидаемой продолжительности жизни населения Российской Федерации на основе сценарного изменения социальногигиенических детерминант с использованием искусственной нейронной сети // Анализ риска здоровью. 2022. № 2. С. 4–16. doi: 10.21668/health.risk/2022.2.01
9. Рахманин Ю.А., Леванчук А.В., Копытенкова О.И. Совершенствование системы социально-гигиенического мониторинга территорий крупных городов // Гигиена и санитария. 2017. Т. 96. № 4. С. 298–301. doi: 10.18821/0016-9900-2017-96-4-298-301
10. Зубарев Н.Ю. Некоторые особенности факторов смертности населения в Российской Федерации // Экономика и управление: проблемы, решения. 2019. Т. 4. № 3. С. 64–70.
11. Важенин А.В., Новикова С.В., Тюков Ю.А. Современные тенденции эпидемиологии злокачественных новообразований основных локализаций в России (обзор публикаций) // Непрерывное медицинское образование и наука. 2021. Т. 16. № 2. С. 30–35.
12. Siegel RL, Miller KD, Fuchs HE, Jemal A. Cancer statistics, 2022. CA Cancer J Clin. 2022;72(1):7–33. doi: 10.3322/caac.21708
13. Hulvat MC. Cancer incidence and trends. Surg Clin North Am. 2020;100(3):469–481. doi: 10.1016/j.suc.2020.01.002
14. Ракитский В.Н., Стёпкин Ю.И., Клепиков О.В., Куролап С.А. Оценка канцерогенного риска здоровью городского населения, обусловленного воздействием факторов среды обитания // Гигиена и санитария. 2021. Т. 100. № 3. С. 188–195. doi: 10.47470/0016-9900-2021-100-3-188-195
15. Максимов Г.Г., Азнабаева Ю.Г., Кириллова Э.В., Липатов О.Н., Муфазалов Ф.Ф. Связь заболеваемости раком легкого с выбросами в атмосферу канцерогенов с преимущественным поражением органов дыхания // Онкология. Журнал им. П.А. Герцена. 2020. Т. 9. № 1. С. 40–44. doi: 10.17116/onkolog2020901140
16. Тихонова Г.И., Брылёва М.С. К анализу факторов риска смертности от злокачественных новообразований мужского населения промышленных моногородов // Анализ риска здоровью. 2021. № 3. С. 67–77. doi: 10.21668/health.risk/2021.3.06
17. Hansen MS, Licaj I, Braaten T, Langhammer A, Marchand LL, Gram IT. Smoking related lung cancer mortality by education and sex in Norway. BMC Cancer. 2019;19(1):1132. doi: 10.1186/s12885-019-6330-9
18. Ефимова Н.В., Мыльникова И.В. Оценка вклада онкогенных факторов в риск развития злокачественных новообразований у городского населения трудоспособного возраста // Анализ риска здоровью. 2021. № 3. С. 99–107. doi: 10.21668/health.risk/2021.3.09
19. Islami F, Sauer AG, Miller KD, et al. Proportion and number of cancer cases and deaths attributable to potentially modifiable risk factors in the United States. CA Cancer J Clin. 2018;68(1):31–54. doi: 10.3322/caac.21440
20. Foerster B, Pozo C, Abufaraj M, et al. Association of smoking status with recurrence, metastasis, and mortality among patients with localized prostate cancer undergoing prostatectomy or radiotherapy: A systematic review and meta-analysis. JAMA Oncol. 2018;4(7):953–961. doi: 10.1001/jamaoncol.2018.1071
21. López-Campos JL, Ruiz-Ramos M, Fernandez E, Soriano JB. Recent lung cancer mortality trends in Europe: Effect of national smoke-free legislation strengthening. Eur J Cancer Prev. 2018;27(4):296–302. doi: 10.1097/CEJ.0000000000000354
22. Зайцева Н.В., Сбоев А.С., Клейн С.В., Вековшинина С.А. Качество питьевой воды: факторы риска для здоровья населения и эффективность контрольно-надзорной деятельности Роспотребнадзора // Анализ риска здоровью. 2019. № 2. С. 44–55. doi: 10.21668/health.risk/2019.2.05
23. Айдинов Г.Т., Марченко Б.И., Софяникова Л.В., Синельникова Ю.А. Применение многомерных статистических методов в задачах совершенствования информационноаналитического обеспечения системы социальногигиенического мониторинга // Здоровье населения и среда обитания. 2015. № 7 (268). С. 4–8.
24. Айдинов Г.Т., Марченко Б.И., Синельникова Ю.А. Многомерный анализ структуры и долевого вклада потенциальных факторов риска при злокачественных новообразованиях трахеи, бронхов и легкого // Анализ риска здоровью. 2017. № 1. С. 47–55. doi: 10.21668/health.risk/2017.1.06
25. Марченко Б.И., Плуготаренко Н.К., Семина О.А. Нейронные сети в задачах аналитического обеспечения систем социально-гигиенического и экологического мониторинга // Здоровье населения и среда обитания. 2021. Т. 29. № 11. С. 23–30. doi: 10.35627/2219-5238/2021-29-11-23-30
26. Айдинов Г.Т., Марченко Б.И., Синельникова Ю.А. Применение комплексной оценки состояния здоровья населения в задачах совершенствования системы социально-гигиенического мониторинга // Гигиена и санитария. 2016. Т. 95. № 10. С. 980–985. doi: 10.18821/0016-9900-2016-95-10-980-985
27. Галиуллина А.Ш., Васильев А.П., Коваленко И.А., Сбитнева А.А. Искусственные нейронные сети // Теория. Практика. Инновации. 2019. № 1 (37). С. 29–33.
28. Ремезова А.А., Тынченко В.В. Применение искусственных нейронных сетей для решения задач прогнозирования // Актуальные проблемы авиации и космонавтики. 2021. Т. 1. № 7. С. 371.
29. Пархоменко С.С., Леденёва Т.М. Обучение нейронных сетей методом Левенберга – Марквардта в условиях большого количества данных // Вестник Воронежского государственного университета. Серия: Системный анализ и информационные технологии. 2019. № 2. С. 98–106.
30. Рыбкина В.Л., Азизова Т.В., Адамова Г.В. Факторы риска развития злокачественных новообразований кожи // Клиническая дерматология и венерология. 2019. Т. 18. № 5. С. 548–555. doi: 10.17116/klinderma201918051548
31. Wright CY, Jean du Preez D, Millar DA, Norval M. The epidemiology of skin cancer and public health strategies for its prevention in Southern Africa. Int J Environ Res Public Health. 2020;17(3):1017. doi: 10.3390/ijerph17031017
32. Guo F, Kuo Y-F, Shih YCT, Giordano SH, Berenson AB. Trends in breast cancer mortality by stage at diagnosis among young women in the United States. Cancer. 2018;124(17):3500–3509. doi: 10.1002/cncr.31638
33. Desai VB, Wright JD, Gross CP, et al. Prevalence, characteristics, and risk factors of occult uterine cancer in presumed benign hysterectomy. Am J Obstet Gynecol. 2019;221(1):39.e1-39.e14. doi: 10.1016/j.ajog.2019.02.051
34. Bianchi FP, Gallone MS, Fortunato F, et al. Epidemiology and cost of cervical cancer care and prevention in Apulia (Italy), 2007/2016. Ann Ig. 2018;30(6):490–501. doi: 10.7416/ai.2018.2249
35. Castle PE, Kinney WK, Xue X, et al. Role of screening history in clinical meaning and optimal management of positive cervical screening results. J Natl Cancer Inst. 2019;111(8):820–827. doi: 10.1093/jnci/djy192
36. Taitt HE. Global trends and prostate cancer: A review of incidence, detection, and mortality as influenced by race, ethnicity, and geographic location. Am J Mens Health. 2018;12(6):1807–1823. doi: 10.1177/1557988318798279
37. Сиразиев А.М., Хасанова Г.Р., Ульянин М.Ю. Факторы риска рака предстательной железы // Медицинский альманах. 2019. № 3–4 (60). С. 110–114. doi: 10.21145/2499-9954-2019-3-110-114
38. Thanikachalam K, Khan G. Colorectal cancer and nutrition. Nutrients. 2019;11(1):164. doi: 10.3390/nu11010164
39. Loomans-Kropp HA, Umar A. Increasing incidence of colorectal cancer in young adults. J Cancer Epidemiol. 2019;2019:9841295. doi: 10.1155/2019/9841295
40. Mauri G, Sartore-Bianchi A, Russo AG, Marsoni S, Bardelli A, Siena S. Early-onset colorectal cancer in young individuals. Mol Oncol. 2019;13(2):109–131. doi: 10.1002/1878-0261.12417
41. Siegel RL, Wagle NS, Cercek A, Smith RA, Jemal A. Colorectal cancer statistics, 2023. CA Cancer J Clin. 2023;73(3):233–254. doi: 10.3322/caac.21772
42. Ширлина Н.Г., Стасенко В.Л., Турчанинов Д.В., Сохошко И.А. Питание и пищевые привычки, ассоциированные с риском развития колоректального рака у населения Омского региона: исследование случай-контроль // Эпидемиология и вакцинопрофилактика. 2019. Т. 18. № 1. С. 67–73. Doi: 10.31631/2073-3046-2019-18-1-67-73
43. Sarabi MM, Khorramabadi RM, Zare Z, Eftekhar E. Polyunsaturated fatty acids and DNA methylation in colorectal cancer. World J Clin Cases. 2019;7(24):4172–4185. doi: 10.12998/wjcc.v7.i24.4172
44. Picetti R, Deeney M, Pastorino S, et al. Nitrate and nitrite contamination in drinking water and cancer risk: A systematic review with meta-analysis. Environ Res. 2022;210:112988. doi: 10.1016/j.envres.2022.112988
45. Дерябкина Л.А., Марченко Б.И., Тарасенко К.С. Оценка канцерогенного риска, обусловленного повышенным содержанием 3,4-бенз(а)пирена в почве промышленного города // Анализ риска здоровью. 2022. № 1. С. 27–35. doi: 10.21668/health.risk/2022.1.03
Об авторах
Б. И. МарченкоРоссия
Марченко Борис Игоревич – д.м.н., доцент; профессор Института нанотехнологий, электроники и приборостроения
ул. Б. Садовая, д. 105/42, г. Ростов-на-Дону, 344006
О. А. Нестерова
Россия
Нестерова Олеся Александровна – аспирант Института нанотехнологий, электроники и приборостроения
ул. Б. Садовая, д. 105/42, г. Ростов-на-Дону, 344006
К. С. Тарасенко
Россия
Тарасенко Карина Сергеевна – аспирант Института нанотехнологий, электроники и приборостроения
ул. Б. Садовая, д. 105/42, г. Ростов-на-Дону, 344006
Рецензия
Для цитирования:
Марченко Б.И., Нестерова О.А., Тарасенко К.С. Злокачественные новообразования в промышленном городе: эпидемиология, современные тенденции и прогноз. Здоровье населения и среда обитания – ЗНиСО. 2023;31(12):17-26. https://doi.org/10.35627/2219-5238/2023-31-12-17-26
For citation:
Marchenko B.I., Nesterova O.A., Tarasenko K.S. Malignant Neoplasms in the Industrial City: Epidemiology, Current Trends and Forecast. Public Health and Life Environment – PH&LE. 2023;31(12):17-26. (In Russ.) https://doi.org/10.35627/2219-5238/2023-31-12-17-26









.png)



























