Перейти к:
Применение культуры фибробластов крысы для оценки токсических свойств воды
https://doi.org/10.35627/2219-5238/2023-31-9-38-44
Аннотация
Введение. Изменение состава воды поверхностных водоемов под воздействием гидрологических, климатических процессов и техногенных сбросов оказывает влияние на ее свойства, которые могут стать опасными для здоровья человека. Мониторирование качества и безопасности воды не учитывает все воздействующие на организм потенциально опасные элементы и их соединения, поскольку появление все новых веществ и рекомбинации уже имеющихся сопровождаются непрерывной трансформацией физико-химического состава воды, обуславливающего ее биологические свойства. Проведенное скрининговое исследование открывает новые перспективы использования метода биотестирования на культурах клеток в качестве подхода к оценке безопасности воды.
Цель исследования: апробация метода биотестирования общих показателей воды с использованием культуры клеток фибробластов крысы и регрессионной модели.
Материалы и методы. Проведены исследования физико-химических показателей в воде поверхностного питьевого водоисточника в осенний (2020 г.), зимний и летний (2021 г.) сезоны. Безопасность воды оценена с помощью метода МТТ-теста на клетках фибробластов крысы. Построена регрессионная модель клеточного ответа по 20 показателям с выбором наиболее значимых предикторов.
Результаты. Выявлены колебания физико-химического состава воды в осенний, зимний и летний сезоны. Превышений по показателям токсичности не обнаружено. Наименьшие значения дегидрогеназной активности культуры клеток фибробластов выявлены при воздействии воды осеннего сезона, тогда как вода летнего сезона наиболее благоприятно влияла на жизнеспособность клеток.
Выводы. В разные сезоны года были выявлены изменения физико-химических показателей, характеризующих качество и безопасность воды питьевого водоисточника. Апробация метода биотестирования воды на культуре клеток фибробластов крысы (МТТ-тест), показала чувствительность по отношению к общим показателям качества воды. На основании математического моделирования определен показатель, достоверно характеризующий токсическое воздействие на культуру клеток фибробластов, – растворенная форма железа, которая может служить индикатором изменения метаболических процессов.
Ключевые слова
Для цитирования:
Хлыстов И.А., Бушуева Т.В., Штин Т.Н., Карпова Е.П., Харькова П.К., Бугаева А.В., Гурвич В.Б. Применение культуры фибробластов крысы для оценки токсических свойств воды. Здоровье населения и среда обитания – ЗНиСО. 2023;31(9):38-44. https://doi.org/10.35627/2219-5238/2023-31-9-38-44
For citation:
Khlystov I.A., Bushueva T.V., Shtin T.N., Karpova E.P., Kharkova P.K., Bugaeva A.V., Gurvich V.B. Usage of Rat Fibroblasts to Assess Toxic Properties of Contaminated Water. Public Health and Life Environment – PH&LE. 2023;31(9):38-44. (In Russ.) https://doi.org/10.35627/2219-5238/2023-31-9-38-44
Введение. В поверхностных водоемах протекают различные гидрологические, химические и биологические процессы, формирующие физико-химический состав воды. Вариативность показателей качества и безопасности воды является следствием смены сезонов, а также воздействия климатических и техногенных факторов. Однако по изменениям состава воды невозможно оценивать ее токсические свойства и риски для здоровья. Токсичность следует рассматривать как системное свойство воды в целом, а не какого-то одного показателя.
Попадающие в воду природные компоненты и поллютанты подвергаются биологической и химической трансформации, в частности процессам комплексообразования, вследствие чего меняется их растворимость и биодоступность [1–3]. Трансформация опасных загрязнителей в окружающей среде обычно приводит к образованию трудноидентифицируемых соединений. Вредное воздействие компонентов среды можно обнаружить биологическими методами [4]. Выявление наиболее опасных компонентов водной среды путем применения биомаркеров представляется перспективным направлением исследований. Биотестирование применяют при оценке эколого-токсикологической нагрузки на водоемы [5], изучении биомагнификации веществ в пищевых цепях [6]. Зачастую в качестве основного биоиндикатора для изучения аккумуляции веществ используют физиологические и поведенческие показатели гидробионтов [7]. В России действует ряд биологических методов контроля различных видов вод, водных вытяжек из почв и отходов1 2 3 4 5 6 с применением различных тестовых организмов. Тестовые организмы из разных таксономических групп отличаются особенностями метаболизма и обладают неодинаковой чувствительностью к химическим веществам, а показатели токсического эффекта выражаются в неоднородных единицах, например, в оптической плотности или проценте выживаемости организмов, что затрудняет сравнение полученных результатов биотестирования и их экстраполяцию в отношении организма человека. Как правило, токсичность в таких исследованиях оценивается только в отношении одного компонента, присутствующего в изучаемой среде. В свою очередь, препятствием при использовании теплокровных организмов в качестве тест-объектов считают большую стоимость исследований и трудности с соблюдением правил биоэтики [8].
Дополнением к существующим методам биотестирования может послужить использование культур клеток. Тесты на общую токсичность, направленные главным образом на выявление биологической активности тестируемых веществ, проводят на клеточных культурах, например фибробластах или раковых клетках [9]. Так, метод МТТ-теста является быстрым и доступным вариантом биотестирования. В основе метода заложена способность восстановления тетразолиевого красителя, которая зависит от клеточной метаболической активности и обусловлена NAD(P)H-зависимыми клеточными оксидоредуктазами [10]. МТТ-тест идеально подходит в качестве диагностического метода для оценки цитотоксичности компонентов различного состава, таких как микотоксины, пестициды, бактериальные культуры, изоляты плесневых грибов, продукты питания, корма, а также широкий спектр проб из объектов окружающей среды [11]. Таким образом, выбор биомаркера должен основываться на его чувствительности к изменяющимся свойствам воды. В дальнейшем открываются перспективы использования в качестве биомаркеров клеточных линий человека и показателей клеточного метаболизма, чувствительных к определенным соединениям из состава воды, а также использования токсичности в качестве интегрального показателя состояния водного объекта.
Цель исследования: апробация метода биотестирования общих показателей воды с использованием культуры клеток фибробластов крысы и регрессионной модели.
Материалы и методы. В 2020 и 2021 годах был осуществлен отбор проб воды из зарегулированного на реке водохранилища – источника питьевого водоснабжения крупного города Свердловской области. На разных участках этой реки расположен ряд гидроузлов, а исследуемое водохранилище находится вблизи действующих промышленных объектов. Органолептические и физико-химические показатели измерены стандартными методами. Концентрации углерода измерены методом высокотемпературного окисления, тяжелых металлов – методом масс-спектрометрии с индуктивно-связанной плазмой. Тяжелые металлы также обладают комплексообразующими свойствами [2], что может менять их растворимость и биодоступность в воде. Эксперимент проведен на культуре первичных клеток (фибробласты кожи крысы), полученных в соответствии с описанным протоколом [12]. Фибробласты выбраны в качестве объекта биотестирования ввиду их распространенности в организме в качестве основного компонента соединительной ткани и участии в тканевом гомеостазе [13], а также высокой скорости выращивания в качестве культуры. Количество жизнеспособных клеток в полученной культуре определяли с помощью счетчика клеток LUNA-II (Logos Biosystems, Корея). Перед посадкой клеточной культуры в планшеты для проведения эксперимента из суспензии клеток отбирали 20 мкл и смешивали с эквивалентным объемом красителя трипанового синего. Полученную суспензию переносили в одноразовый слайд для подсчета клеток в приборе. Жизнеспособность культуры составила около 80 %. Клетки высевали в 96-луночный планшет (TPP Techno Plastic Products AG, Trasadingen, Switzerland) и инкубировали в течение 24 часов в стандартных условиях до добавления анализируемых проб воды.
Для количественной оценки цитотоксического эффекта определяли дегидрогеназную активность фибробластов (МТТ-тест). Использовали желтый тетразолиевый краситель (3-(4,5-диметилтиазол-2-ил)-2,5-дифенил-тетразолиум бромид) (Sigma Aldrich, США), который восстанавливается в пурпурный формазан в живых клетках. В качестве растворяющего компонента использовали диметилсульфоксид (ДМСО). В каждую лунку с клетками добавляли по 20 мкл MTT красителя в концентрации 5 мг/дм3 и инкубировали в атмосфере 5 % CO2 при 37 °C в течение 2 часов. После этого из планшетов полностью удаляли среду и в каждую лунку добавляли по 100 мкл ДМСО для растворения кристаллов формазана. Оптическую плотность измеряли на спектрофотометре Epoch™ (BioTek, США) при длине волны 490 нм. Результаты рассчитывали по формуле:

где А490 нм – оптическая плотность образца при длине волны 490 нм, blank – оптическая плотность фона (культуральной среды).
На основании выборки из результатов трех опытов построена регрессионная модель зависимости дегидрогеназной активности (группирующая переменная) от физико-химических показателей с выбором наиболее значимых.
Результаты. В табл. 1 представлены результаты исследований физико-химического состава воды, в табл. 2 – результаты оценки токсических свойств воды.
Таблица 1. Результаты исследований состава воды из поверхностного питьевого источника
Table 1. Results of seasonal surface water testing
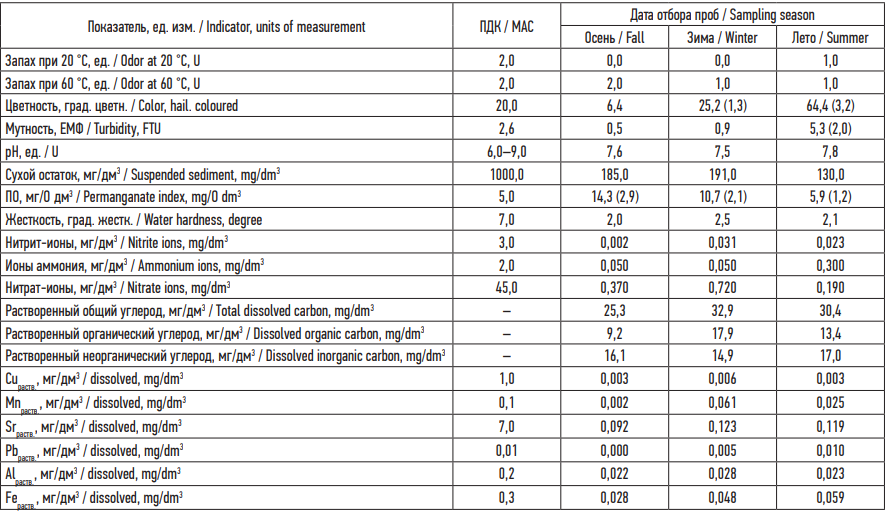
Примечание: Измерения физико-химических показателей воды за каждый месяц проведены однократно (n = 1); ПО – перманганатная окисляемость; величина погрешности каждого показателя лежит в границах установленных методиками пределов; в скобках указана кратность превышения показателя относительно ПДК.
Notes: We took single measurements of physicochemical water indicators in each month; the error of each indicator is within the limits established by the methods; the multiplicity of MAC (maximum allowable concentration) excess is shown in parentheses.
Таблица 2. Результаты оценки токсических свойств воды методом МТТ-теста
Table 2. Results of assessing toxic properties of surface water using the MTT assay

Примечание: Количество измерений (n) показателя дегидрогеназной активности в каждом месяце составляет 12.
Note: We took twelve measurements of dehydrogenase activity in each month.
Максимальные значения органолептических показателей цветности и мутности выявлены летом 2021 г. По показателю pH природная вода охарактеризована как слабощелочная. В зимнее время выявлены максимумы содержания сухого остатка, жесткости, нитрит- и нитрат-ионов, растворенного общего и органического углерода, растворенных форм меди, марганца и стронция. Увеличение концентрации железа (по сравнению с осенним сезоном) составило 1,7 раза зимой, 2,1 раза летом. Выявлены увеличения значений показателей в зимнее и летнее время (в сравнении с осенью):
по мутности – в 10 раз летом, нитрит-ионам – в 15 раз зимой, растворенному свинцу – десятикратное повышение концентрации летом. Не выявлено сезонных закономерностей между изменением значений показателей органического вещества – перманганатной окисляемости и растворенного органического углерода. Выявлены превышения установленных нормативных значений в воде7 по показателям: цветность, мутность, ПО.
Минимальные значения дегидрогеназной активности культуры клеток фибробластов выявлены при воздействии воды, отобранной в осенний сезон (табл. 2).
Получено уравнение регрессии, описывающее зависимость дегидрогеназной активности от комбинированного воздействия физико-химических показателей природной воды (R2 = 0,99; F(1,1) = 1440,8; p < 0,017; n = 3):
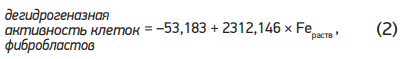
По результатам регрессионного анализа установлен наиболее значимый предиктор токсичности – растворенная форма железа.
Обсуждение. По результатам начатого мониторинга данного водоисточника установлена сезонная вариативность показателей, характеризующих ионный состав, кислотно-основные свойства воды, процессы поступления и трансформации органического вещества [14], что подтверждается текущими исследованиями. Каждый из этих показателей участвует в формировании физико-химических свойств воды и, как было предположено, оказывает влияние на ее токсичность. Наибольшие значения дегидрогеназной активности клеток выявлены летом, что может свидетельствовать о наиболее благоприятном влиянии физико-химическом состава воды на ее физиологические свойства. Из всех показателей физико-химического состава воды наиболее выраженное токсическое воздействие на фибробласты оказал фактор, не проявляющий экстремальных изменений в воде в разные сезоны года и не превышающий установленные нормативные требования, – растворенная форма железа. Железо также влияет на органолептические показатели воды (цветность, мутность) и комплексообразующую способность; лимитирующий показатель вредности – органолептичекий7. Вклад в содержание железа в водоемах Среднего Урала вносят подстилающие породы и сточные воды промышленных предприятий с повышенным содержанием данного элемента [15][16]. В Уральском регионе имеются железорудные месторождения [17], вследствие чего происходит повышение фонового содержания железа в почвах и грунтовых водах. Соединения железа аккумулируются на дне водных объектов. Вообще в процессах перераспределения химических соединений внутри осадка и в обмене с придонной водой участвуют в первую очередь реакционноспособные формы химических элементов, растворенные в иловой воде или переходящие в раствор (или в осадок) при соответствующем изменении условий [18]. Растворенная форма железа характеризуется более высокой биологической активностью, чем кристаллизованная. Содержание железа в водоисточниках выше допустимого уровня может привести к токсическим эффектам, влияя на метаболические реакции в живом организме [19]. При определенных условиях содержание ионов железа может стимулировать пролиферацию клеток. В эксперименте по воздействию раствора FeSO4 и FeCl3 (в концентрации от 50 до 100 мкм) наблюдали пролиферацию фибробластов за счет активного образования кислорода, опосредованного окислительно-восстановительной реакцией с участием железа, за счет присутствия ионов в самой среде, но не за счет доставки железа в клетки [20].
Железо в основном образует комплексы с растворенным органическим веществом в ионной форме, при этом на формирование соединений сильно влияет pH [21]. Известно, что под воздействием растворенных органических соединений увеличивается подвижность металлов [22][23]. Образующиеся металлорганические соединения могут быть более токсичными для биологических организмов по сравнению с ионной формой металлов8 [24]. Следовательно, в условиях невысокой концентрации растворенного железа, но при наличии достаточного количества лигандов может увеличиваться его биодоступность и токсичность. Наибольшее значение показателя «перманганатная окисляемость» выявлено осенью в сравнении с другими сезонами. Несмотря на отсутствие пикового значения концентрации растворенного органического углерода, уровень перманганатной окисляемости свидетельствует о преобладании в составе органических веществ доли легкоокисляемых (либо вновь поступивших в водоем) соединений. Вероятно, это способствует увеличению доли железа, связанного в комплексы и хелаты.
По результатам эксперимента можно заключить, что токсические свойства воды водохранилища в разные сезоны года определяются растворенной формой железа. При этом важна не концентрация, а сам показатель, играющий одну из ключевых ролей в клеточном метаболизме. Было выдвинуто предположение об усилении токсических свойств железа за счет взаимодействия с подвижными органическими лигандами либо доминирования в воде ионной формы железа в валентности, которая наиболее губительна для клеток.
Проведение скрининговых токсикологических исследований с использованием культур клеток позволит выявить чувствительные биохимические маркеры клеточного метаболизма, поможет выявить ткани и органы, подвергающиеся наибольшему токсическому воздействию. В дальнейшем переход к культурам клеток человека и выбора специфических биохимических показателей будет служить инструментом для идентификации наиболее опасных компонентов в составе воды.
Выводы
1. Проведены исследования физико-химических показателей воды, характеризующих ее качество и безопасность. Выявлена существенная вариативность показателей в разные сезоны года: по показателю «мутность» она составляет 10 раз, нитрит-ионам – 15 раз, а также десятикратное увеличение концентраций растворенного свинца.
2. Проведена апробация метода биотестирования воды на культуре клеток фибробластов крысы (МТТтест); показана чувствительность данного метода по отношению к компонентам физико-химического состава воды.
3. Установлены изменения клеточного метаболического ответа на состав воды в разные сезоны года. Минимальные значения дегидрогеназной активности культуры клеток выявлены при воздействии воды, отобранной в осенний сезон, а максимальные – в летний. Выявлен предполагаемый предиктор токсических свойств воды – растворенная форма железа.
1. ФР 1.39.2007.03222. Биологические методы контроля. Методика определения токсичности воды и водных вытяжек из почв, осадков сточных вод, отходов по смертности и изменению плодовитости дафний.
2. ФР 1.39.2001.00284. Методика определения токсичности воды и водных вытяжек из почв, осадков сточных вод, отходов по изменению уровня флуоресценции хлорофилла и численности клеток водорослей.
3. ПНД Ф Т 14.1:2:3:4.10-04, Т 16.1:2:2.3:3.7-04. Методика измерений оптической плотности культуры водоросли хлорелла (Chlorella vulgaris Beijer) для определения токсичности питьевых, пресных природных и сточных вод, водных вытяжек из грунтов, почв, осадков сточных вод, отходов производства и потребления.
4. ПНД Ф Т 14.1:2:3:4.11-04, Т 16.1:2.3:3.8-04. Методика определения интегральной токсичности поверхностных, в том числе морских, грунтовых, питьевых, сточных вод, водных экстрактов почв, отходов, осадков сточных вод по изменению интенсивности бактериальной биолюминесценции тест-системой «Эколюм».
5. ФР.1.31.2009.06301. Методика выполнения измерений индекса токсичности почв, почвогрунтов, вод и отходов по изменению подвижности половых клеток млекопитающих in vitro.
6. ЦОС ПВ Р 005-95. Методические рекомендации по применению методов биотестирования для оценки качества воды в системах хозяйственно-питьевого водоснабжения.
7. СанПиН 1.2.3685–21 «Гигиенические нормативы и требования к обеспечению безопасности и (или) безвредности для человека факторов среды обитания». М.: Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека, 2022. 668 с.
8. Формы миграции металлов в пресных поверхностных водах. Под ред. Линник П.Н., Набиванец Б.И. Л.: Гидрометеоиздат, 1986. 270 с.
Список литературы
1. Nikinmaa M. Chapter 6 – Factors affecting the bioavailability of chemicals. In: Nikinmaa M. Introduction to Aquatic Toxicology. London: Academic Press Ltd – Elsevier Science Ltd; 2014:65-72. doi: 10.1016/B978-0-12-411574-3.00006-2
2. Моисеенко Т.И. Биодоступность и экотоксичность металлов в водных системах: критические уровни загрязнения // Геохимия. 2019. T. 64. № 7. C. 675–688. doi: 10.31857/S0016-7525647675-688. EDN: GBYYBL.
3. Briffa J, Sinagra E, Blundell R. Heavy metal pollution in the environment and their toxicological effects on humans. Heliyon. 2020;6(9):e04691. doi: 10.1016/j.heliyon.2020.e04691
4. Лущай Е.А., Иванов Д.Е., Тихомирова Е.И. Разработка и исследование эффективности новых методов быстрой оценки токсичности компонентов окружающей среды при биомониторинге // Поволжский экологический журнал. 2019. T. 4. C. 458–469. doi: 10.35885/1684-7318-2019-4-458-469. EDN: UTJPTP.
5. Чуйко Г.М., Томилина И.И., Холмогорова Н.В. Методы биодиагностики в водной экотоксикологии // Токсикологический вестник. 2022. T. 30. № 5. C. 315–322. doi: 10.47470/0869-7922-2022-30-5-315-322. EDN: OSFNYR.
6. Ali H, Khan E, Ilahi I. Environmental chemistry and ecotoxicology of hazardous heavy metals: Environmental persistence, toxicity, and bioaccumulation. J Chem. 2019;2019:6730305. doi: 10.1155/2019/6730305
7. Morgalev Y, Dyomin V, Morgalev S, et al. Environmental contamination with micro- and nanoplastics changes the phototaxis of euryhaline zooplankton to paired photostimulation. Water. 2022;14(23):3918. doi: 10.3390/w14233918
8. Ostroumov SA. Toxicity testing of chemicals without use of animals. Russian Journal of General Chemistry. 2016;86(13):2933–2941. doi: 10.1134/S1070363216130028
9. Ekwall B, Silano V, Paganuzzi-Stammati A, Zucco F. Toxicity tests with mammalian cell cultures. In: Bourdeau P, et al, eds. Short-term Toxicity Tests for Non-genotoxic Effects. Chichester: John Wiley & Sons Ltd; 1990:75-97. Accessed August 7, 2023. https://scope.dge.carnegiescience.edu/SCOPE_41/SCOPE_41_2.02_Chapter_7_75-98.pdf
10. Bahuguna A, Khan I, Bajpai VK, Kang SC. MTT assay to evaluate the cytotoxic potential of a drug. Bangladesh J Pharmacol. 2017;12(2):115-118. doi: 10.3329/bjp.v12i2.30892
11. Twarużek M, Zastempowska E, Soszczyńska E, Ałtyn I. The use of in vitro assays for the assessment of cytotoxicity on the example of MTT test. Folia Biologica et Oecologica. 2018;14(1):23-32. doi: 10.1515/fobio-2017-0006
12. Seluanov A, Vaidya A, Gorbunova V. Establishing primary adult fibroblast cultures from rodents. J Vis Exp. 2010;44:2033. doi: 10.3791/2033
13. Plikus MV, Wang X, Sinha S, et al. Fibroblasts: Origins, definitions, and functions in health and disease. Cell. 2021;184(15):3852-3872. doi: 10.1016/j.cell.2021.06.024
14. Хлыстов И.А., Харькова П.К., Бугаева А.В., Замолоцких Т.В., Штин Т.Н., Гурвич В.Б. Определение индикативных показателей для организации мониторинга источников питьевого водоснабжения при изменении климатических условий // Здоровье населения и среда обитания. 2022. T. 9. C. 84–90. doi: 10.35627/2219-5238/2022-30-9-84-90. EDN: XLHFFT.
15. Oznobikhina LA. Pollution of ecosystem water resources in the Ural Federal District. IOP Conf Ser: Earth Environ Sci. 2022;1045:012125. doi: 10.1088/1755-1315/1045/1/012125
16. Флефель Х.Э., Гутова М.О., Донник И.М., Грибовский Ю.Г. Оценка концентрации тяжелых металлов Fe, Zn, Cd и Pb в природных водоисточниках // Аграрный вестник Урала. 2019. № 6(185). С. 44-47. doi: 10.32417/article_5d47f804ec0943.26307077.
17. Чернышов Н.М., Молотков С.П., Резникова О.Г. Золото-платиноносность главнейших типов железорудных формаций мира (информационно-аналитический обзор) // Вестник Воронежского государственного университета. Серия: Геология. 2003. № 2. C. 137–162. EDN: PJCVEX.
18. Титова К.В., Кокрятская Н.М. Распределение реакционноспособного железа в донных отложениях малых озер // Вестник Северного (Арктического) федерального университета. Серия: Естественные науки. 2013. № 2. C. 49–54. EDN: QCOPRP.
19. Han G, Yang K, Zeng J, Zhao Y. Dissolved iron and isotopic geochemical characteristics in a typical tropical river across the floodplain: The potential environmental implication. Environ Res. 2021;200:111452. doi: 10.1016/j.envres.2021.111452
20. Yabe N, Matsui H. Effects of iron chelates on the transferrin-free culture of rat dermal fibroblasts through active oxygen generation. In Vitro Cell Dev Biol Anim. 1997;33(7):527-535. doi: 10.1007/s11626-997-0095-1
21. Adusei-Gyamfi J, Ouddane B, Rietveld L, Cornard JP, Criquet J. Natural organic matter-cations complexation and its impact on water treatment: A critical review. Water Res. 2019;160:130-147. doi: 10.1016/j.watres.2019.05.064
22. Ashworth DJ, Alloway BJ. Influence of dissolved organic matter on the solubility of heavy metals in sewage-sludge-amended soils. Commun Soil Sci Plant Anal. 2008;39(3-4):538–550. doi: 10.1080/00103620701826787
23. Kalbitz K, Wennrich R. Mobilization of heavy metals and arsenic in polluted wetland soils and its dependence on dissolved organic matter. Sci Total Environ. 1998;209(1):27-39. doi: 10.1016/s0048-9697(97)00302-1
24. Lee R, Oshima Y. Effects of selected pesticides, metals and organometallics on development of blue crab (Callinectes sapidus) embryos. Mar Environ Res. 1998;46(1-5):479-482. doi: 10.1016/S0141-1136(97)00072-X
Об авторах
И. А. ХлыстовРоссия
Хлыстов Иван Андреевич – к.б.н., научный сотрудник, исполняющий обязанности заведующего лабораторией гигиены окружающей среды и экологии человека отдела комплексных проблем гигиены и профилактики заболеваний населения
ул. Попова, д. 30, г. Екатеринбург, 620014
Т. В. Бушуева
Россия
Бушуева Татьяна Викторовна – к.м.н., заведующая научно-производственным отделом «Лабораторно-диагностических технологий»
ул. Попова, д. 30, г. Екатеринбург, 620014
Т. Н. Штин
Россия
Штин Татьяна Николаевна – к.х.н., заведующая отделом физико-химических методов исследования
ул. Попова, д. 30, г. Екатеринбург, 620014
Е. П. Карпова
Россия
Карпова Елизавета Павловна – младший научный сотрудник научно-производственного отдела «Лабораторно-диагностических технологий»
ул. Попова, д. 30, г. Екатеринбург, 620014
П. К. Харькова
Россия
Харькова Полина Константиновна – младший научный сотрудник лаборатории гигиены окружающей среды и экологии человека отдела комплексных проблем гигиены и профилактики заболеваний населения
ул. Попова, д. 30, г. Екатеринбург, 620014
А. В. Бугаева
Россия
Бугаева Александра Владиславовна – младший научный сотрудник лаборатории гигиены окружающей среды и экологии человека отдела комплексных проблем гигиены и профилактики заболеваний населения
ул. Попова, д. 30, г. Екатеринбург, 620014
В. Б. Гурвич
Россия
Гурвич Владимир Борисович – д.м.н., научный руководитель
ул. Попова, д. 30, г. Екатеринбург, 620014
Рецензия
Для цитирования:
Хлыстов И.А., Бушуева Т.В., Штин Т.Н., Карпова Е.П., Харькова П.К., Бугаева А.В., Гурвич В.Б. Применение культуры фибробластов крысы для оценки токсических свойств воды. Здоровье населения и среда обитания – ЗНиСО. 2023;31(9):38-44. https://doi.org/10.35627/2219-5238/2023-31-9-38-44
For citation:
Khlystov I.A., Bushueva T.V., Shtin T.N., Karpova E.P., Kharkova P.K., Bugaeva A.V., Gurvich V.B. Usage of Rat Fibroblasts to Assess Toxic Properties of Contaminated Water. Public Health and Life Environment – PH&LE. 2023;31(9):38-44. (In Russ.) https://doi.org/10.35627/2219-5238/2023-31-9-38-44









.png)



























