Перейти к:
Действие высоких доз метаванадата натрия на тиреоидный статус крыс
https://doi.org/10.35627/2219-5238/2023-31-9-31-37
Аннотация
Введение. Широкое применение ванадия в металлургической промышленности приводит к его высокому содержанию в воздухе рабочей зоны, что создает угрозу здоровью рабочих предприятий и населения. Ванадий аккумулируется во многих органах и оказывает токсическое действие, однако исследования, касающиеся данных по его действию на щитовидную железу, очень немногочисленные и узконаправленные. Данное исследование направлено на оценку влияния ванадия на функционирование щитовидной железы.
Цель исследования: изучить тиреоидный статус крыс при однократном внутрибрюшинном введении метаванадата натрия.
Материалы и методы. В ходе исследования крысы-самцы весом более 200 г в возрасте 3 месяцев были разделены на 3 группы – контрольную, опытные V11 (11 мг/кг веса метаванадата натрия) и V18 (18 мг/кг веса метаванадата натрия). Концентрации тиреотропного гормона, общего трийодтиронина, общего тироксина, свободной фракции тироксина, свободной фракции трийодтиронина в сыворотке крови определялись методом иммуноферментного анализа.
Результаты. Введение высоких разовых доз метаванадата натрия вызывает значимые сдвиги в содержании гормонов. При введении 11 мг/кг метаванадата натрия повышается содержание свободного тироксина, общего тироксина и уменьшается соотношение общего трийодтиронина к общему тироксину по сравнению с контролем. При введении 18 мг/кг метаванадата натрия увеличивается содержание свободного трийодтиронина, свободного тироксина, соотношение свободного трийодтиронина к общему трийодтиронину и соотношение свободного тироксина к общему тироксину по сравнению с контролем. Также отмечены различия между опытными группами: в группе V11 увеличивается содержание свободного трийодтиронина, соотношение свободного трийодтиронина к общему трийодтиронину и соотношение свободного тироксина к общему тироксину.
Заключение. По результатам исследования можно заключить, что введение метаванадата натрия в высоких разовых дозах 11 и 18 мг/кг приводит к подавлению функции щитовидной железы и развитию гипофункции органа, даже спустя 14 дней с момента введения.
Ключевые слова
Для цитирования:
Головина Д.П., Шеломенцев И.Г., Грибова Ю.В. Действие высоких доз метаванадата натрия на тиреоидный статус крыс. Здоровье населения и среда обитания – ЗНиСО. 2023;31(9):31-37. https://doi.org/10.35627/2219-5238/2023-31-9-31-37
For citation:
Golovina D.P., Shelomentsev I.G., Gribova J.V. Effects of High Doses of Sodium Metavanadate on the Thyroid Status in Rats. Public Health and Life Environment – PH&LE. 2023;31(9):31-37. (In Russ.) https://doi.org/10.35627/2219-5238/2023-31-9-31-37
Введение. Ванадий (V) используется во многих отраслях промышленности, что приводит к выбросам ванадия в рабочую зону и в атмосферу прилегающих к предприятиям населенных пунктов [1][2]. Концентрации V в воздухе рабочей зоны может достигать отметки 8,45 мг/м3 при нормативном значении 0,5 мг/м3 [2–4]1.
Несмотря на то что ванадий является необходимым микронутриентом в организме и принимает участие в ряде важных биологических функций, избыточное накопление ванадия может привести к пагубным последствиям для многих систем органов [5][6]. В связи с этим ванадий и его соединения создают угрозу здоровью рабочих промышленных предприятий и населения, находящегося в непосредственной близости к ним [7–9]. Существует большое количество исследований на тему токсичности ванадия на системы органов [1][10–11]. Также есть научные работы, касающиеся токсического влияния ванадия на щитовидную железу (ЩЖ), однако они единичные и затрагивают лишь молекулярные механизмы воздействия других соединений ванадия на жизнеспособность и пролиферацию клеток щитовидной железы [12].
Нарушения функции ЩЖ могут приводить к таким заболеваниям, как микседема, эндемический зоб, базедова болезнь у взрослых и кретинизм у детей, поэтому важно оценить влияние ванадия на функции ЩЖ [13][14]. Одним из основных маркеров функциональной активности ЩЖ является тиреоидный статус организма, показывающий состояние метаболизма, работоспособность и функционирование органа [15][16].
Таким образом, целью данного исследования является изучение тиреоидного статуса крыс при однократном внутрибрюшинном введении метаванадата натрия.
Материалы и методы
Дизайн исследования
Исследование было проведено в рамках эксперимента по определению LD50 метаванадата натрия. Для определения нижеуказанных параметров выбраны группы крыс, выживших в данном эксперименте в полном составе. В исследовании использовались самцы крыс породы Wistar, массой более 200 г (с разбросом масс не более 10 %) и возрастом более 3 месяцев. Диета стандартная. Общее количество животных – 26 особей.
Животные были разделены на 3 группы.
1. Контрольная группа (10 животных) – дистиллированная вода.
2. Опытная группа V11 (8 животных) – метаванадат натрия в концентрации 11 мг/кг веса животного.
3. Опытная группа V18 (8 животных) – метаванадат натрия в концентрации 18 мг/кг веса животного.
Животным была введена однократная инъекция объемом 2 мл внутрибрюшинным способом. Спустя 14 дней производили забор биологического материала.
Место проведения эксперимента – ФБУН «Екатеринбургский медицинский – научный центр профилактики и охраны здоровья рабочих промышленных предприятий» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека.
Время проведения эксперимента – август 2022 г.
Определение концентрации гормонов ЩЖ
Для определения концентрации гормонов ЩЖ была отобрана цельная кровь объемом 5–6 мл в пробирки с диоксидом кремния в качестве коагулянта у каждого животного контрольной (n = 10) и опытных групп V11 (n = 8) и V18 (n = 8). Далее пробы центрифугировались для получения сыворотки крови.
Концентрация тиреотропного гормона (ТТГ), общего трийодтиронина (Т3о), общего тироксина (Т4о), свободной фракции тироксина (Т4с), свободной фракции трийодтиронина (Т3с) определялась методом иммуноферментного анализа с помощью спектрофотометра Epoch (BioTek, США) с использованием коммерческих наборов «ВЕКТОР-БЕСТ» (Россия) согласно инструкции производителя.
В качестве дополнительных параметров оценки были посчитаны соотношения Т3 свободного к Т4 свободному, Т3 общего к Т4 общему, Т3 свободного к Т3 общему и Т4 свободного к Т4 общему.
Статистический анализ данных
Математическая обработка данных и расчеты производились в программе Excel (Microsoft, США). Статистическую обработку данных проводили с помощью программного обеспечения Statistica версии 12.0 компании StatSoft. Достоверность различий между группами определяли с помощью H-критерия Краскела – Уоллиса и U-критерия Манна – Уитни. Разницу между значениями считали статистически значимой, если вероятность ее случайного появления была ниже 0,05 (p ≤ 0,05).
Результаты. Анализ тиреоидных гормонов дает возможность оценить функциональное состояние ЩЖ и сделать выводы о тиреоидном статусе организма. Анализ ТТГ в результатах не приведен, так как содержание этого гормона было ниже порога чувствительности коммерческого набора (С < 0,05 мМЕ/л). Результаты анализа содержания других гормонов ЩЖ представлены на рисунке.
По результатам анализа было обнаружено, что введение метаванадата натрия в высоких дозах лабораторным животным внутрибрюшинно приводит к изменению содержания гормонов ЩЖ в сыворотке крови.
Содержание Т3 свободного у экспериментальной группы крыс V18 было ниже на 11,3 % (p = 0,003) относительно контрольной группы животных и на 7,2 % (p = 0,027) ниже группы V11 (см. рисунок, a). Различий в содержании гормона общего Т3 между группами не обнаружено (p = 0,719) (см. рисунок, b). Как видно из рисунка (c) концентрация Т4 свободного у группы V11 выше на 15,5 % (p = 0,041), а у группы V18 – на 25,4 % (p = 0,016) относительно контроля. Содержание же общего Т4 у экспонированной группы V11 уменьшилось на 18,2 % (p = 0,029) относительно контрольной группы, однако в опытной группе V18, где доза вещества была выше, показатель тироксина выравнивается по сравнению с контролем (см. рисунок, d).
Также были обнаружены изменения в показателях соотношения гормонов ЩЖ (см. таблицу).
Различия в соотношении гормонов Т3о/Т4о были обнаружены между контрольной группой и экспериментальной V11 группой животных (p = 0,015) (на 19,7 % выше контроля). Показатели соотношения Т3с/Т3о и Т4с/Т4о достоверно снижаются в экспериментальной группе V18 на 12,5 % (p = 0,007) и 12,6 % (p = 0,013) соответственно по сравнению с контролем, а также на 8,5 % (p = 0,023) и 14,7 % (p = 0,010) соответственно по сравнению с группой V11. Различий показателя соотношения гормонов Т3с/Т4с между группами не обнаружено (p = 0,187).
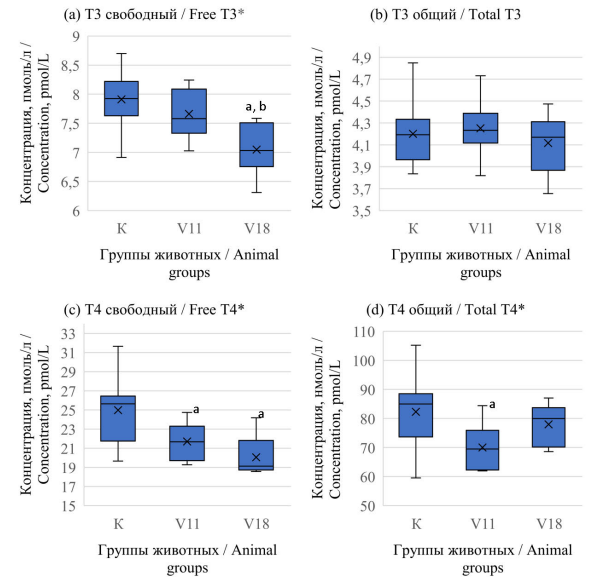
Рисунок. Сравнение содержания гормонов в сыворотке исследуемых группах крыс при введении метаванадата натрия на 14-е сутки эксперимента: (а) свободного и (b) общего трийодтиронина, (c) свободного и (d) общего тироксина D
Figure. Comparison of serum levels of (a) free and (b) total triiodothyronine, (c) free and (d) total thyroxine in the groups of rats on day 14 of the experiment with a single intraperitoneal injection of sodium metavanadate
Примечание: * – достоверные различия по критерию Краскела – Уоллиса; a – отличие от контрольной группы, b – отличие между опытными группами достоверны по критерию Манна – Уитни (p < 0,05). Горизонтальная линия – медиана. Х – среднее арифметическое. Диаграммы размаха – минимум-максимум. Бокс – квартили 0,25–0,75.
Notes: * – statistically significant differences in the Kruskal–Wallis test; a – statistically different from the controls and b – between the experimental groups in the Mann–Whitney U-test (p < 0.05). The horizontal line shows the median; X shows the arithmetic mean; the range charts show minimum and maximum values, and the boxes present upper and lower quartiles (0.25–0.75).
Таблица. Соотношения тиреоидных гормонов исследуемых групп крыс
Table. Thyroid hormone ratios established in the groups of rats
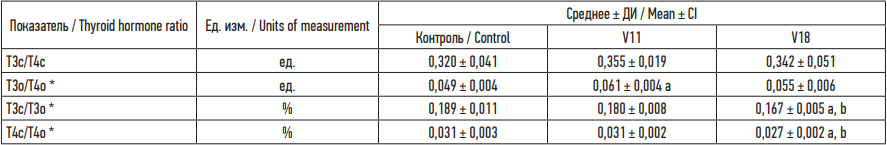
Примечание: ДИ – доверительный интервал (±95 %); * – достоверные различия по критерию Краскела – Уоллиса; a – отличие от контрольной группы; b – отличия между опытными группами достоверны по критерию Манна – Уитни (p < 0,05).
Notes: * CI, confidence interval (±95 %); * – statistically significant differences in the Kruskal–Wallis test; statistically different a from the controls and b between the experimental groups in the Mann–Whitney U-test (p < 0.05).
Обсуждение. Гормоны ЩЖ играют роль индикатора работоспособности и функционирования органа, а определение содержания гормонов Т3 и Т4 является классическим критерием оценки работы тиреоидной системы [15].
По литературным данным, снижение свободного Т3 часто является симптомом гипотиреоза щитовидной железы [17]. Сниженное содержание свободного Т3 может быть связано с нарушением связывания гормонов ЩЖ транспортным белком, поскольку содержание Т3 свободного в крови не коррелирует с концентрацией транспортных белков крови, их приравнивают к индикаторам функциональной активности ЩЖ [18].
Понижение содержания гормона тироксина может говорить об активации транспорта йода в ЩЖ, что приводит к избытку йода в организме и, как следствие, подавлению работы железы [15]. Такой гормональный сбой приводит к нарушению транспорта йода в фолликулярные тиреоциты и модификации Т4 в Т3 [19]. Соответственно, анализ содержания тироксина говорит о тенденции к снижению функциональной активности, гипофункции ЩЖ и избытку йода. Избыток йода, в свою очередь, является фактором риска развития заболеваний ЩЖ, характеризующегося подавлением или блокировкой ТТГ, что подтверждают исследования [20]. Понижение содержания гормона Т4 может приводить и к изменениям в структуре железы, таким как перестройка паренхимы, то есть уменьшение количества фолликулов на единицу площади за счет увеличения их размера.
Известно, что показатель соотношения Т3 свободный / Т4 свободный может служить дополнительным параметром в раннем распознавании состояний гипо- или гипертиреоза. Соответственно, так как отношение Т3/Т4 является показателем, отражающим функцию ЩЖ и действие гормонов на ткани, можно предположить, что функция ЩЖ носит нарушенный характер [16].
Отношение общих и свободных T3/T4 может быть критерием для оценивания гомеостаза щитовидной железы и являться инструментом клинических исследований. Литературные данные подтверждают, что соотношение T3/T4 может увеличиваться при гипертиреозе, но также и при гипотиреозе из-за более высокого синтеза биологически активной фракции гормонов, увеличенной деиодиназной активности тканей и снижения уровня Т4 [16]. Однако, учитывая отсутствие статистически значимых различий в данном исследовании по гормону Т3 и увеличение содержания Т4 в опытной группе, можно предположить, что результаты смещены в сторону гипотиреоза.
Известно, что ванадий накапливается в органах дыхания, печени, почках, органах половой системы, костях, а также в структурах мозга и щитовидной железе [1][11][21–22]. Попадая в организм, метаванадат ингибирует работу Н+/K+-АТФазы, Na+/K+-АТФазы и Са2+/Mg2+-АТФазы в клетках, что приводит к нарушениям в них, таким как повышенная генерация АФК, активация окислительного стресса, запуск апоптотических процессов в митохондриях, и, как следствие, сбоям в работе органов [23][24]. Данная информация позволяет выдвинуть две гипотезы.
1. Метаванадат натрия, накапливаясь в тканях, действует непосредственно на ЩЖ, что приводит к нарушениям ее структуры. В связи с этим необходимо провести дополнительные исследования, включающие анализ морфометрических параметров фолликулов ЩЖ для оценки морфофункциональных изменений.
2. Любые отклонения в содержании гормонов от нормы могут говорить о серьезных изменениях в организме и работе гипоталамо-гипофизарно-тиреоидной (ГГТ) оси. ГГТ ось относится к оси обратной связи. Тиреотропин-рилизинг-гормон стимулирует секрецию ТТГ в передней доле гипофиза, который, в свою очередь, активирует секрецию Т3 и Т4 в ЩЖ. На данном этапе Т3 и Т4 аккумулируются в двух доступных формах – в свободной и связанной с белками [25]. В то же время известно, что другие соединения ванадия действуют на структуры мозга – обонятельные луковицы, гиппокамп, соматосенсорную кору [26–28]. Предположительно, нарушения затрагивают и гипоталамус с гипофизом, которые являются частью ГГТ оси, что может говорить об опосредованном влиянии на работу ЩЖ. Соответственно, изменения в работе гипофиза и гипоталамуса могут отражаться на работе всей ГГТ оси. Это позволяет выдвинуть гипотезу о том, что изменения в работе и структуре ГГТ оси несут нарушения тиреоидного статуса организма. В данном случае необходимы дополнительные исследования, затрагивающие изучение изменений в структурах мозга.
Таким образом, результаты имеют тенденцию к подавлению функции щитовидной железы и развитию гипофункции органа. Однако выраженного дозозависимого эффекта не обнаружено. Предположительно, такие результаты связаны с тем, что забор биологического материала крыс был выполнен на 14-е сутки после введения метаванадата натрия. За этот период вещество могло быть выведено из ЩЖ, а возникшие в начале нарушения приведены в норму за счет адаптационно-компенсаторных процессов организма.
Заключение. По результатам исследования можно заключить, что введение метаванадата натрия в высоких разовых дозах 11 и 18 мг/кг приводит к подавлению функции щитовидной железы, развитию гипофункции органа и избытку йода, даже спустя 14 суток с момента введения. В дальнейшем необходимо провести дополнительные исследования, включающие анализ морфометрических параметров фолликулов ЩЖ для оценки морфофункциональных изменений. Также исследования действия метаванадата натрия в остром эксперименте без периода восстановления и в хроническом/субхроническом эксперименте с малыми дозами позволят расширить понимание действия метаванадата натрия на структуру и функции ЩЖ.
Вместе с тем необходимо учитывать, что нарушения в работе гормональной системы ЩЖ могут брать начало из ГГТ оси. Соответственно, необходимы дополнительные исследования, затрагивающие также изучение отделов головного мозга, чтобы определить степень влияния метаванадата натрия на гипофиз и гипоталамус и их связь с нарушениями ЩЖ. Данные исследования необходимы, в частности, для изучения биологических механизмов, лежащих в основе связи между тяжелыми металлами и гормонами ЩЖ, для нормативной токсикологии и оценки рисков.
1. СанПиН 1.2.3685–21 «Гигиенические нормативы и требования к обеспечению безопасности и (или) безвредности для человека факторов среды обитания». М.: Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека, 2022. 668 с.
Список литературы
1. Lee JC, Kurniawan, Kim EY, Chung KW, Kim R, Jeon HS. A review on the metallurgical recycling of vanadium from slags: towards a sustainable vanadium production. J Mater Res Technol. 2021;12(4):343-364. doi: 10.1016/j.jmrt.2021.02.065
2. González N, Esplugas R, Marquès M, Domingo JL. Concentrations of arsenic and vanadium in environmental and biological samples collected in the neighborhood of petrochemical industries: A review of the scientific literature. Sci Total Environ. 2021;(771):145149. doi: 10.1016/j.scitotenv.2021.145149
3. Измеров Н.Ф., Шиган Е.Е., Бухтияров И.В. и др. Профессиональные заболевания органов дыхания : Национальное руководство. Москва : Общество с ограниченной ответственностью Издательская группа «ГЭОТАР-Медиа», 2015. 792 с.
4. Долгих О.В., Алексеев В.Б., Дианова Д.Г., Кривцов А.В. Иммунная дисрегуляция у работников предприятия черной металлургии в условиях избыточной контаминации ванадием // Мед. труда и пром. экол. 2020. Т. 60. № 5. С. 294–298. doi:10.31089/1026-9428-2020-60-5-294-298
5. Hanus-Fajerska E, Wiszniewska A, Kamińska I. A dual role of vanadium in environmental systems – Beneficial and detrimental effects on terrestrial plants and humans. Plants (Basel). 2021;10(6):1110. doi: 10.3390/plants10061110
6. Aureliano M, De Sousa-Coelho AL, Dolan CC, Roess DA, Crans DC. Biological consequences of vanadium effects on formation of reactive oxygen species and lipid peroxidation. Int J Mol Sci. 2023;24(6):5382. doi: 10.3390/ijms24065382
7. Tu W, Xiao X, Lu J, et al. Vanadium exposure exacerbates allergic airway inflammation and remodeling through triggering reactive oxidative stress. Front Immunol. 2023;13:1099509. doi: 10.3389/fimmu.2022.1099509
8. Ścibior A, Llopis J, Dobrakowski PP, Męcik-Kronenberg T. CNS-related effects caused by vanadium at realistic exposure levels in humans: A comprehensive overview supplemented with selected animal studies. Int J Mol Sci. 2023;24(10):9004. doi: 10.3390/ijms24109004
9. Yuan TH, Jhuang MJ, Yeh YP, Chen YH, Lu S, Chan CC. Relationship between renal function and metal exposure of residents living near the No. 6 Naphtha Cracking Complex: A cross-sectional study. J Formos Med Assoc. 2021;120(10):1845-1854. doi: 10.1016/j.jfma.2021.04.009
10. He X, Jarrell ZR, Smith MR, et al. Low-dose vanadium pentoxide perturbed lung metabolism associated with inflammation and fibrosis signaling in male animal and in vitro models. Am J Physiol Lung Cell Mol Physiol. 2023;325(2):L215-L232. doi: 10.1152/ajplung.00303.2022
11. Wang X, Xing C, Li G, et al. The key role of proteostasis at mitochondria-associated endoplasmic reticulum membrane in vanadium-induced nephrotoxicity using a proteomic strategy. Sci Total Environ. 2023;869:161741. doi: 10.1016/j.scitotenv.2023.161741
12. Fallahi P, Foddis R, Elia G, et al. Vanadium pentoxide induces the secretion of CXCL9 and CXCL10 chemokines in thyroid cells. Oncol Rep. 2018;39(5):2422-2426. doi: 10.3892/or.2018.6307
13. Benvenga S, Elia G, Ragusa F, et al. Endocrine disruptors and thyroid autoimmunity. Best Pract Res Clin Endocrinol Metab. 2020;34(1):101377. doi: 10.1016/j.beem.2020.101377
14. Connelly KJ, Park JJ, LaFranchi SH. History of the thyroid. Horm Res Paediatr. 2022;95(6):546-556. doi: 10.1159/000526621
15. Saganuwan SA. Ameliorative effects of piroxicam on perchloric acid-induced thyroid gland hormones disruption in male rats. J King Saud Univ Sci. 2023;35(5):102661. doi: 10.1016/j.jksus.2023.102661
16. Taylor PN, Albrecht D, Scholz A, et al. Global epidemiology of hyperthyroidism and hypothyroidism. Nat Rev Endocrinol. 2018;14(5):301-316. doi: 10.1038/nrendo.2018.18
17. Ахмедов Ш.С., Абдунабиева Х.М. Гипофункция щитовидной железы // Re-health journal. 2021; 10 (2).
18. Köhrle J, Brabant G. Synthesis, metabolism and diagnostics of thyroid hormones. Internist (Berl). 2010;51(5):559-560, 562-567. (In German.) doi: 10.1007/s00108-009-2494-8
19. Мохорт Т.В. Эволюция представлений о диагностике и лечении гипотиреоза // Медицинские новости. 2022; № 6 (333). С. 4–12.
20. Цанава И.А., Булгакова С.В., Меликова А.В. Субклинический гипотиреоз: лечить или наблюдать? // Вестник медицинского института «Реавиз»: реабилитация, врач и здоровье. 2020. № 6 (48). С. 98–108
21. Usende IL, Alimba CG, Emikpe BO, Bakare AA, Olopade JO. Intraperitoneal sodium metavanadate exposure induced severe clinicopathological alterations, hepato-renal toxicity and cytogenotoxicity in African giant rats (Cricetomys gambianus, Waterhouse, 1840). Environ Sci Pollut Res Int. 2018;25(26):26383-26393. doi: 10.1007/s11356-018-2588-8
22. Adebiyi OE, Olayemi FO, Olopade JO, Tan NH. Βeta-sitosterol enhances motor coordination, attenuates memory loss and demyelination in a vanadium-induced model of experimental neurotoxicity. Pathophysiology. 2019;26(1):21-29. doi: 10.1016/j.pathophys.2018.12.002
23. Barreto A, Santos J, Amorim MJB, Maria VL. Environmental hazards of boron and vanadium nanoparticles in the terrestrial ecosystem—A case study with Enchytraeus crypticus. Nanomaterials (Basel). 2021;11(8):1937. doi: 10.3390/nano11081937
24. Ścibior A, Kurus J. Vanadium and oxidative stress markers – In vivo model: A review. Curr Med Chem. 2019;26(29):5456-5500. doi: 10.2174/0929867326666190108112255
25. Flach E, Koenig J, van der Venne P, Parzer P, Resch F, Kaess M. Hypothalamic-pituitary-thyroid axis function in female adolescent nonsuicidal self-injury and its association with comorbid borderline personality disorder and depression. Prog Neuropsychopharmacol Biol Psychiatry. 2021;111:110345. doi: 10.1016/j.pnpbp.2021.110345
26. Fatola OI, Olaolorun FA, Olopade FE, Olopade JO. Trends in vanadium neurotoxicity. Brain Res Bull. 2019;145:75-80. doi: 10.1016/j.brainresbull.2018.03.010
27. Jaiswal MR, Kale PP. Mini review – vanadium-induced neurotoxicity and possible targets. Neurol Sci. 2020;41(4):763-768. doi: 10.1007/s10072-019-04188-5
28. Igado OO, Andrioli A, Azeez IA, et al. Ameliorative effect of mimo2 (a novel compound from Moringa oleifera leaves) against vanadium-induced neurotoxicity. IBRO Reports. 2019;7:S19-S20. doi: 10.1016/j.ibror.2019.09.043
Об авторах
Д. П. ГоловинаРоссия
Головина Дарья Павловна – лаборант-исследователь отдела молекулярной биологии и электронной микроскопии
ул. Попова, д. 30, г. Екатеринбург, 620014
И. Г. Шеломенцев
Россия
Шеломенцев Иван Глебович – научный сотрудник отдела молекулярной биологии и электронной микроскопии
ул. Попова, д. 30, г. Екатеринбург, 620014
Ю. В. Грибова
Россия
Грибова Юлия Витальевна – врач клинической лабораторной диагностики НПО лабораторно-диагностических технологий
ул. Попова, д. 30, г. Екатеринбург, 620014
Дополнительные файлы
Рецензия
Для цитирования:
Головина Д.П., Шеломенцев И.Г., Грибова Ю.В. Действие высоких доз метаванадата натрия на тиреоидный статус крыс. Здоровье населения и среда обитания – ЗНиСО. 2023;31(9):31-37. https://doi.org/10.35627/2219-5238/2023-31-9-31-37
For citation:
Golovina D.P., Shelomentsev I.G., Gribova J.V. Effects of High Doses of Sodium Metavanadate on the Thyroid Status in Rats. Public Health and Life Environment – PH&LE. 2023;31(9):31-37. (In Russ.) https://doi.org/10.35627/2219-5238/2023-31-9-31-37









.png)



























