Перейти к:
Оценка состояния здоровья детей, проживающих в условиях воздействия токсической нагрузки в городах с развитой цветной металлургией Свердловской области
https://doi.org/10.35627/2219-5238/2022-30-9-67-76
Аннотация
Введение. Риски, формируемые кадмием, мышьяком и свинцом в Свердловской области, обуславливают дополнительные случаи заболеваний у детей. Данные токсиканты оказывают влияние на минеральный обмен, повреждение клеток печени, почек, показатели иммунитета, нервную систему.
Цель: оценить уровень содержания кадмия, свинца и мышьяка в биосредах, наблюдаемый у детей дошкольного возраста (3–6 лет), проживающих в городах с развитой цветной металлургией, и состояние здоровья при обнаруженном уровне токсической нагрузки.
Материалы и методы. Исследование проведено в 6 городах Свердловской области с развитой цветной металлургией. Анализ уровня загрязнения среды обитания проведен по данным социально-гигиенического мониторинга. Для оценки токсической нагрузки проведен биомониторинг. Проанализирован уровень хронической заболеваемости детей в организованных коллективах, приведены результаты специального обследования детей (включающего осмотр педиатра и невролога). Выполнено математическое моделирование с использованием метода «Деревья решений».
Результаты. Установлено превышение среднеобластного уровня хронической заболеваемости детей в организованных коллективах по 9 классам болезней. По результатам углубленного обследования в структуре основного диагноза лидируют болезни: кожи и подкожной клетчатки; органов дыхания; крови и отдельные нарушения, вовлекающие иммунный механизм; пищеварительной системы. При оценке неврологического статуса выявлены: резидуальная церебральная органическая недостаточность, синдром дефицита внимания с гиперактивностью, церебрастенический синдром. При оценке данных биомониторинга в группе детей с вышеперечисленными отклонениями обнаружено повышенное содержание свинца, мышьяка и кадмия в биосредах. Результаты математического моделирования свидетельствуют о статистически достоверных взаимосвязях между содержанием свинца, кадмия, мышьяка в объектах окружающей среды, данными биомониторинга и результатами клинико-лабораторного обследования детей (уровнем аланинаминотрансферазы, цинка, общего белка, фагоцитарного индекса и носителя маркера апоптоза CD95+).
Выводы. Результаты биомониторинга ассоциируются с данными о хронической заболеваемости детей в организованных коллективах. Установлен уровень токсической нагрузки, при превышении которого могут возникать отклонения клинико-лабораторных показателей от референтных значений. Полученные результаты могут быть использованы при реализации медико-профилактических мероприятий.
Для цитирования:
Кадникова Е.П. Оценка состояния здоровья детей, проживающих в условиях воздействия токсической нагрузки в городах с развитой цветной металлургией Свердловской области. Здоровье населения и среда обитания – ЗНиСО. 2022;(9):67-76. https://doi.org/10.35627/2219-5238/2022-30-9-67-76
For citation:
Kadnikova E.P. Assessment of the Health Status of Children Exposed to Industrial Toxicants in the Towns with Developed Non-Ferrous Metallurgy of the Sverdlovsk Region. Public Health and Life Environment – PH&LE. 2022;(9):67-76. (In Russ.) https://doi.org/10.35627/2219-5238/2022-30-9-67-76
Введение. В соответствии с результатами социально-гигиенического мониторинга в Свердловской области на протяжении многих лет комплексная химическая нагрузка занимает лидирующее положение среди всех факторов, оказывающих влияние на уровень болезней органов дыхания, врожденных аномалий, болезней костно-мышечной системы, болезней крови и кроветворных органов, злокачественных новообразований и прочих нозологий не только взрослого, но и детского населения.
По результатам ранжирования уровня прогнозируемых многосредовых рисков, обусловленных воздействием загрязнений объектов среды обитания, в городах, прежде всего с развитой цветной металлургией, лидирует риск задержки психического развития детского населения (прогнозируется 5,3 случая на 1000 населения) и преждевременной смертности среди взрослых (прогнозируется 1,4 случая на 1000 населения) в связи с многосредовым свинцовым загрязнением; далее следует суммарный канцерогенный риск (основной вклад в риск для здоровья населения вносит мышьяк (523 случая онкологических заболеваний)), на третьем месте – риск возникновения нефропатий за всю жизнь населения в связи с многосредовым воздействием кадмия (139 468 случаев)1 .
По современным литературным данным, эти токсиканты оказывают выраженное влияние на минеральный обмен, и связано это, прежде всего, с особенностями их поглощения в организме: транспортные белки желудочно-кишечного тракта (DMT1, TRPV6, ZIP8, ZIP14), обладающие широкой субстратной специфичностью, позволяют транспортировать большинство двухвалентных металлов (как макро-, микроэлементов, так и токсичных металлов) [1].
В соответствии с современными представлениями о метаболизме ксенобиотиков в реализации первой стадии – обезвреживание ксенобиотика и перевод его в форму, удобную для выведения из организма, – ключевую роль играют клетки печени с поэтапным прохождением нескольких фаз, таких как гидроксилирование, реакции конъюгации и синтеза. В результате данных процессов возможно повреждающее действие свинца, кадмия и мышьяка на клетки печени [2–4]. Во время второй стадии – выведение токсина из организма – связанные с белками токсиканты направляются в почки, оказывая токсическое воздействие на эпителиальные клетки канальцев и почечные клубочки с нарушениями фильтрационной способности и, как следствие, изменение белкового обмена, диуреза, обмена микроэлементов и т. д. [5–10].
Среди иммунотропных эффектов токсикантов различают снижение функциональной активности иммунокомпетентных клеток, подавление окислительного метаболизма макрофагов, снижение митогениндуцированной и антителозависимой цитотоксичности, нарушение цитокинового баланса и антителогенеза, нарушение функционального состояния нейтрофильных лейкоцитов, нарушение фагоцитарной активности нейтрофилов [11][12]. По данным Касохова Т.Б., вторичная иммунная недостаточность у детей, проживающих в регионе, загрязненном солями металлов, характеризуется выраженными сдвигами в интерфероногенезе и фагоцитозе по сравнению с Т- или В-клеточными звеньями иммунитета (по степени чувствительностиинтерфероновая система > фагоцитарная система > Т и В системы иммунитета)2 .
Анализ материалов научной литературы показывает, что нейротоксические механизмы воздействия свинца, кадмия и мышьяка обусловлены их проникновением в головной мозг в виде свободных ионов, в комплексе с низкомолекулярными лигандами либо при транспортировке катионными переносчиками DMT1 и в последующем приводят к поведенческим и когнитивным расстройствам у детей [13–17].
Перечисленные неблагоприятные эффекты зависят от поглощенной дозы вещества, в связи с чем различные концентрации данных токсикантов в биологических средах организма формируют различные эффекты для здоровья, причем выраженность тех или иных сдвигов может и не манифестировать сразу же после воздействия, а проявить себя спустя значительный промежуток времени, характеризуя накопительный эффект воздействия на организм данных токсикантов3 [18].
Правильная и своевременная оценка состояния здоровья и токсической нагрузки этими токсикантами важна для организации последующих мероприятий по управлению рисками возникновения и развития отклонений в состоянии здоровья населения.
В соответствии с современной концепцией предиктивной, превентивной и персонализированной медицины4 развитие индивидуальных подходов к пациенту подразумевает использование биомаркеров (например, концентрации токсикантов в биосредах) с целью выявления предикторных изменений в состоянии организма для своевременной минимизации риска развития заболеваний, обусловленных химическим загрязнением среды обитания, и последующей разработки и применения соответствующих профилактических мер.
В связи с этим необходимо знать не только уровни приоритетных токсикантов в биосредах, наблюдаемых у детей, проживающих в условиях естественного содержания и антропогенного загрязнения среды обитания свинцом, кадмием и мышьяком, но и возможные предикторные ответы, возникающие в организме при установленном уровне токсической нагрузки.
Цель: оценить уровень содержания кадмия, свинца и мышьяка в биосредах, наблюдаемый у детей дошкольного возраста (3–6 лет), проживающих в городах с развитой цветной металлургией, и состояние здоровья при обнаруженном уровне токсической нагрузки.
Материалы и методы. Для проведения исследования выбраны 6 городов Свердловской области, расположенных в зонах влияния крупных промышленных предприятий цветной металлургии, в которых в период с 2004 по 2020 год были организованы медико-профилактические мероприятия по управлению риском здоровью населения: городской округ (далее ГО) Первоуральск, ГО Краснотурьинск, ГО Красноуральск, ГО Ревда, ГО Верхняя Пышма, Кировградский ГО.
Объектом исследования являлись дети в возрасте 3–6 лет, проживающие на территории вышеуказанных городов и участвовавшие в реализации медико-профилактических мероприятий по управлению риском здоровью населения в период с 2004 по 2020 год. В выборку было включено 2026 детей, средний возраст которых составил 4,46 ± 0,6 года. Обязательным критерием для включения детей в систему медико-профилактических мероприятий по управлению риском здоровью населения было наличие добровольного информированного согласия родителей на проведение биомониторинга и лабораторного обследования, согласия на обработку персональных данных.
Оценка качества среды обитания (уровни загрязнения свинцом, кадмием и мышьяком атмосферного воздуха, почвы, питьевой воды) на территориях указанных городов была выполнена по данным информационного фонда социально-гигиенического мониторинга Свердловской области.
Биомониторинг токсической нагрузки выполнен в соответствии с пособием для врачей «Организация и проведение оценки содержания токсических элементов в биологических материалах» (утв. секцией «Гигиена» УС МЗ и СР РФ 15 декабря 2004 г., протокол № 6). Исследования биоматериалов проводили в соответствии с методическими указаниями5 6 7.
Статистическая обработка результатов биомониторинга включала в себя расчет средних концентраций по всему массиву данных по городам с развитой цветной металлургией, медиану, асимметрию, стандартное отклонение, проверку характера распределения, ошибку средней величины; для установления взаимосвязей между концентрацией свинца, кадмия и мышьяка в моче от их уровней в крови были рассчитаны парные коэффициенты Пирсона.
В соответствии с данными информационного фонда социально-гигиенического мониторинга Свердловской области в 6 муниципальных образованиях выполнен расчет показателей структуры, уровня, темпы прироста/убыли хронической заболеваемости детей в организованных коллективах.
Для анализа состояния здоровья детей были использованы «Шаблоны электронных медицинскихдокументов в формате международного стандарта HL7 CDA Release 2 для системы мониторинга детей с экологически обусловленными заболеваниями для муниципальных детских лечебно-профилактических учреждений». Данное программное средство содержит результаты проведенного специального обследования детей, включавшего консультацию педиатра, невролога, клинико-лабораторное обследование (показатели красной крови (гемоглобин, эритроциты), биохимические показатели (глюкоза, АЛТ, АСТ, железосвязывающая способность сыворотки), макроэлементы (кальций, фосфор, цинк, медь), показатели клеточного иммунитета (СD-20,3,4,56,8,95 и их % содержание), фагоцитарный индекс, фагоцитарное число, показатели гуморального иммунитета (IgA, IgG, IgM))8 .
Анализ взаимосвязей концентраций свинца, кадмия и мышьяка в объектах среды обитания, уровня токсической нагрузки (по данным биомониторинга) и состояния здоровья детей проведен методом «Деревья решений» (Decision Tree) с использованием критерия Манна – Уитни, алгоритма Conditional inference trees (реализация Ctree из пакета Party) для построения регрессионных деревьев решений (p < 0,0050).
Исследование проведено в рамках научно-исследовательской работы «Гигиеническая диагностика и оценка риска для здоровья населения», зарегистрированной ФГАНУ «Центр информационных технологий и систем органов исполнительной власти», номер государственного учета НИОКТР АААА-А18-118041890074-7 от 18 апреля 2018 г. Работа одобрена локальным этическим комитетом ФГБОУ ВО УГМУ Минздрава России (протокол № 5 от 15 декабря 2017 г.).
Результаты. По данным социально-гигиенического мониторинга на территории городов с развитой цветной металлургией за период с 2004 по 2020 год большинство проб атмосферного воздуха и питьевой воды, исследованных на содержание свинца, кадмия и мышьяка, соответствовали гигиеническим нормативам. Удельный вес проб почвы, не соответствующий гигиеническим нормативам, в изучаемых муниципальных образованиях, составляет по свинцу 20,7 %, по кадмию – 13,0 %, по мышьяку – 10,5 %, в том числе проб почвы селитебных территорий по свинцу – 21,2 %, по кадмию – 7,4 %, по мышьяку – 4,2 %; на территории детских образовательных учреждений по свинцу – 36,3 %, по кадмию – 15,4 %, по мышьяку – 0,7 % [19].
Для оценки влияния на здоровье детей свинца, кадмия и мышьяка проведен биомониторинг токсической нагрузки в рамках действующей на территории Свердловской области системы медико-профилактических мероприятий управления риском для здоровья населения в унифицированных условиях обследования (табл. 1).
Таблица 1. Средние концентрации свинца, кадмия и мышьяка в крови и моче у детей, проживающих в городах
с развитой цветной металлургией Свердловской области
Table 1. Mean blood and urinary levels of lead, cadmium and arsenic in children living in the towns
with developed non-ferrous metallurgy of the Sverdlovsk Region
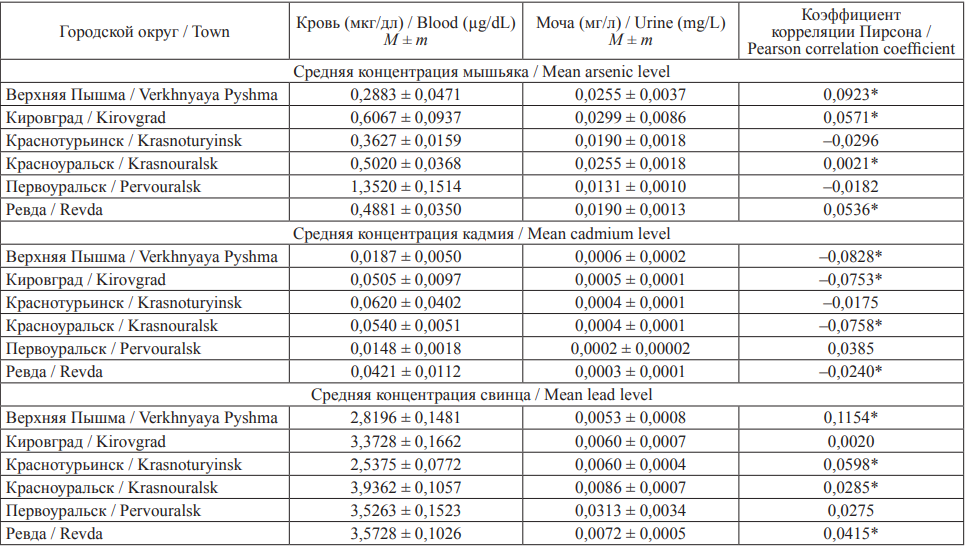
Примечание: * – p < 0,0050.
Notes: *p < 0.0050
Для установления взаимосвязей между уровнем содержания свинца, кадмия и мышьякав объектах среды обитания и их концентрациями в биосредах было проведено математическое моделирование зависимостей «внешняя среда – маркер экспозиции». Предикторными переменными для такой математической модели были выбраны средние концентрации свинца, кадмия и мышьяка в объектах окружающей среды, а зависимыми переменными – маркеры экспозиции. Обнаружено, что содержание свинца в воде более 0,00014 мг/л, концентрация мышьяка в воздухе более 0,000002 мг/м3 и в воде более 0,0001 мг/л, кадмия в почве более 1,33 мг/кг и в воде более 0,00028 мг/л приводило к росту этих токсикантов в биосредах у детей в 1,4–6,9 раза [19].
В соответствии с современными представлениями о токсикокинетике и токсикодинамике к основным системам, которые наиболее подвержены воздействию изучаемых токсикантов, относятся: центральная нервная система, кроветворная, репродуктивная, гормональная, сердечно-сосудистая, иммунная, мочевыделительная системы, система органов дыхания, пищеварения [4][18][20–25]. Учитывая возможное разнообразие эффектов в организме человека, возникающих при поражении указанных критических органов и систем, в качестве установления вероятного воздействия на популяционное здоровье детей в изучаемых городах от воздействия свинца, кадмия и мышьяка, а также из имеющейся информации в региональном информационном фонде социально-гигиенического мониторинга Свердловской области был проанализирован среднемноголетний уровень и средние темпы прироста (убыли) хронической заболеваемости детей в организованных коллективах по основным классам болезней за период 2004–2020 гг. (табл. 2).
Таблица 2. Среднемноголетние уровни (на 1000 детей в возрасте 3–6 лет) и средние темпы прироста/убыли (%)
хронической заболеваемости детей в организованных коллективах по классам болезней по 6 муниципальным образованиям
Свердловской области в 2004–2020 гг.
Table 2. Average long-term (per 1,000 children aged 3–6 years) and change rates (%) of chronic morbidity in preschool children
by disease categories in six towns of the Sverdlovsk Region, 2004–2020
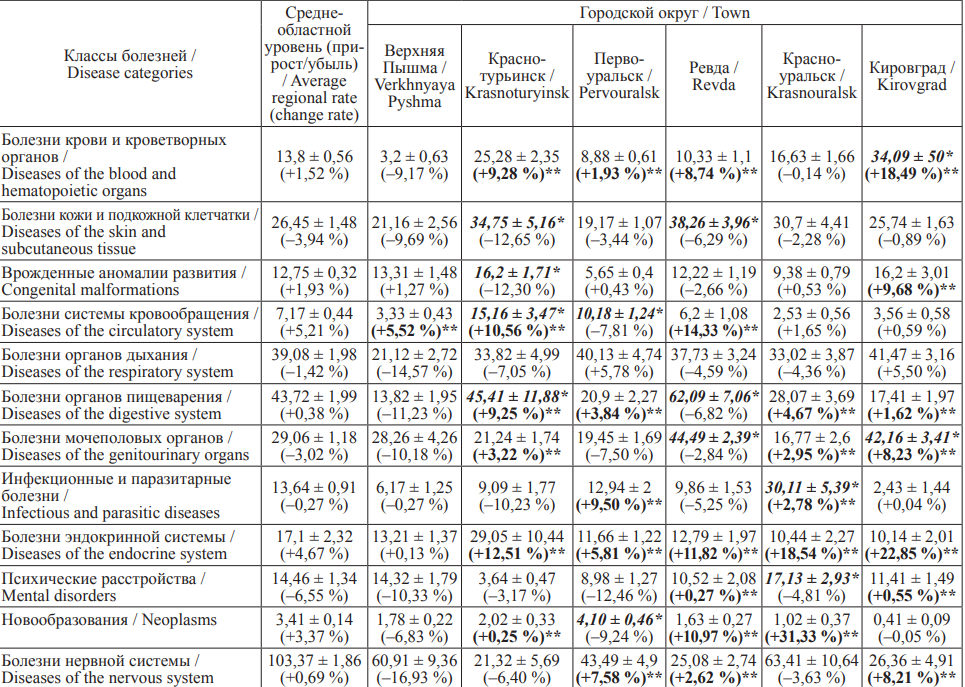
Примечание: * – жирным курсивом выделены уровни хронической заболеваемости, которые достоверно выше среднеобластных показателей (р < 0,05
по критерию Манна – Уитни), ** – жирным шрифтом выделены средние темпы прироста, превышающие среднеобластное значение.
Notes: * Prevalence rates exceeding the regional averages are in bold italics (p < 0.05, Mann-Whitney U-test); ** Average growth rates exceeding the regional
averages (p < 0.05) are in bold.
Полученные данные о среднемноголетних уровнях хронической заболеваемости детей в организованных коллективах и ее средних темпах прироста/убыли свидетельствовали о достоверно высоких уровнях по сравнению со среднеобластными показателями по следующим классам: болезни крови и кроветворных органов, болезни кожи и подкожной клетчатки, врожденные аномалии развития, болезни системы кровообращения, болезни органов пищеварения, болезни мочеполовых органов, инфекционные и паразитарные болезни, психические расстройства, новообразования.
Обнаружены корреляционные зависимости между концентрацией свинца, кадмия и мышьяка в биосредах и уровнями хронической заболеваемости (уровень свинца в крови был взаимосвязанс уровнем психических расстройств (r = 0,34, p < 0,05), кадмия в моче – с уровнями болезней органов дыхания (r = 0,35, p < 0,05), органов пищеварения (r = 0,48, p < 0,05), кожи и подкожной клетчатки (r = 0,41, p < 0,05)).
В соответствии с установленными унифицированными медицинскими критериями отбора дети из группы риска развития заболеваний, связанных с высоким уровнем химического загрязнения среды обитания (аллергодерматозы, бронхообструкция, бронхиальная астма, хронический тонзиллит, круглогодичный ринит, аллергический риносинусит, поллинозы, нарушения обмена обменно-конституционного характера, а также группа часто и длительно болеющих детей), и имеющие наибольший уровень токсической нагрузки были направлены на специальное обследование, организованное и проведенное на базе отделения восстановительного лечения ГБУЗ СО «Областная детская клиническая больница № 1» (озеро Балтым). По полученным результатам осмотра детей 3–6 лет педиатром в структуре основного диагноза лидируют болезни кожи и подкожной клетчатки (49,91 %), из которых превалируют аллергический дерматит (23,9–42 %), атопический дерматит (18,83–36,46 %); далее следуют болезни органов дыхания (26,49 %), заболевания крови и отдельные нарушения, вовлекающие иммунный механизм (15,04 %), затем – заболевания пищеварительной (6,05 %). В структуре сопутствующего диагноза первое место занимают болезни органов пищеварения (78,3 %), второе место – болезни нервной системы (62,8 %) и болезни органов дыхания (61,9 %). При оценке неврологических симптомов неврологом установлено, что из осмотренных детей 20,87 % имеют резидуальную церебральную недостаточность, 7,80 % – синдром дефицита внимания с гиперактивностью, 2,75 % – церебрастенический синдром, 9,63 % – синдром вегетативной дистонии, 6,10 % – минимальную мозговую дисфункцию, 2,44 % – синдром дефицита внимания, 2,44 % – гипертензионно-гидроцефальный синдром.
Объекты исследования (дети с 3–6 лет) были разделены на группы по критерию наличия либо отсутствия основного или сопутствующего диагнозов и неврологических симптомов, установленных по данным осмотра педиатра и невролога. Тест Вилкоксона для независимых выборок показал различия мышьяка и кадмия в крови детей в группах: с неуточненным иммунодефицитом и хроническими болезнями миндалин и аденоидов уровень мышьяка в крови выше на 65,7 и 1,3 % соответственно, по сравнению с группой детей, у которых отсутствовали данные патологии в основном или сопутствующем диагнозе; у детей с неуточненной энцефалопатией и другими уточненными поражениями головного мозга уровень кадмия в крови выше на 118,4 и 76,9 % соответственно; у детей с наличием других уточненных болезней желчного пузыря уровень мышьяка, кадмия и свинца в крови выше на 4,8; 68,3 и 17,3 % соответственно.
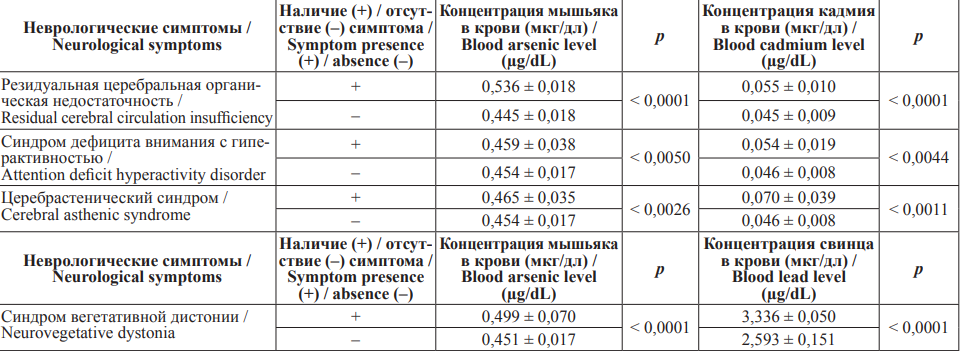
В группе детей с наличием указанных в табл. 3 неврологических симптомов концентрации кадмия, свинца и мышьяка были незначительно выше, чем у детей без них.
Таблица 3. Концентрация кадмия, свинца и мышьяка в крови у детей с наличием/отсутствием неврологических симптомов
Table 3. Blood cadmium, lead and arsenic levels in children with/without neurological symptoms
Для описания возможных изменений в состоянии здоровья при обнаруженном уровне токсической нагрузки использовано математическое моделирование – в качестве независимой переменной использовали концентрации свинца, кадмия и мышьяка в крови и моче. Зависимой переменной являлись результаты клинико-лабораторных показателей – показатели красной крови (гемоглобин, эритроциты), биохимические показатели (глюкоза, АЛТ, АСТ, железосвязывающая способность сыворотки), макроэлементы (кальций, фосфор, цинк, медь), показатели клеточного иммунитета (СD-20,3,4,56,8,95 и их процентное содержание), фагоцитарный индекс, фагоцитарное число, показатели гуморального иммунитета (IgA, IgG, IgM).
По результатам биомониторинга объекты исследования разделены на группы по уровню содержания каждого из металлов в крови и моче (табл. 4).
Таблица 4. Описание групп токсикантов (Pb, Cd и As) в биосредах и результаты математического моделирования
Table 4. Description of groups of toxicants (Pb, Cd and As) in biological fluids and results of mathematical modeling
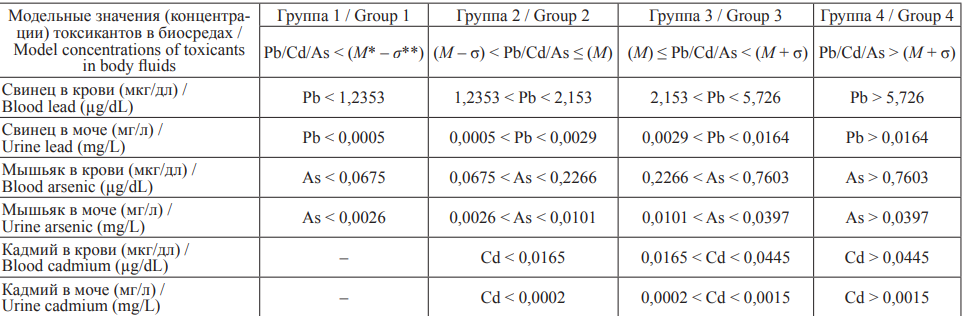
Примечание: *M – средняя концентрация в группе; **σ – стандартное отклонение.
Notes: *М – mean group concentration; **σ – standard deviation
Для указанных групп исследованы зависимости между показателями в крови и моче с помощью регрессионных деревьев решений. С помощью обобщенных линейных моделей построены соответствующие уравнения регрессии: Клинический показатель крови/мочи = b (значение клинико-лабораторных показателей) + a* (группы по металлам). Для выявления тенденций влияния изменения концентрации (Pb, Cd и As) на нормальныепоказатели клинических исследований из группы параметров b (значение клинико-лабораторных показателей) первоначально были исключены отклоняющиеся от нормы значения.
В качестве примера обнаруженных зависимостей приведем результаты моделирования «концентрация мышьяка в крови» – «уровень аланинаминотрансферазы (далее – АЛТ)» (рис. 1). Уровень АЛТ у наблюдаемой группы детей находился в пределах физиологической нормы – 0,2347 (норма АЛТ в крови 0,1–0,68 ммоль/л). Если концентрация мышьяка в крови относилась к третьей группе (0,2266 < As < 0,7603, средняя концентрация 0,4419 ± 0,0049 мкг/дл в данной группе) и четвертой группе (> 0,7603, средняя концентрация 1,6962 ± 0,08945 мкг/дл в данной группе), то концентрация АЛТ была выше физиологических значений и составляла в модели 1,0936 ммоль/л. Если концентрация мышьяка в крови в пределах 1-й группы (< 0,0675, средняя концентрация в данной группе 0,0486 ± 0,00033 мкг/дл) и 2-й группы (0,0675 < As < 0,2266, средняя концентрация в данной группе 0,1594 ± 0,0027 мкг/дл), то уровень АЛТ был в пределах физиологической нормы: значение в модели – 0,2347 ммоль/л. Таким образом, при концентрации мышьяка в крови более 0,2266 ммоль/л может наблюдаться рост АЛТ выше физиологической нормы.
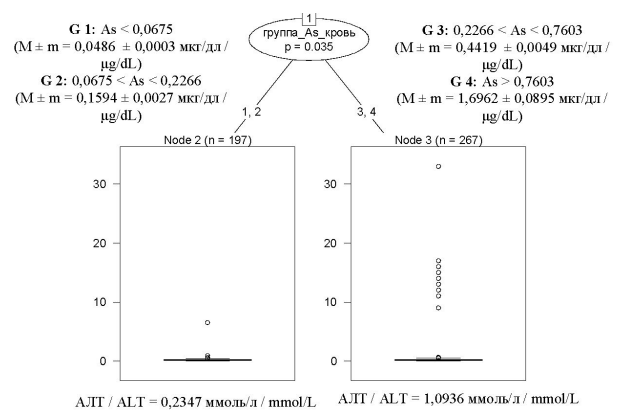
Рисунок. Пример использования статистического анализа методом регрессионных деревьев решений – результаты
математического моделирования «концентрация мышьяка в крови – уровень АЛТ в крови»
Figure. An example of using a decision tree regression: results of “blood arsenic level – ALT” mathematical modeling
Примечание: G – группа; m – средняя концентрация; АЛТ – аланинаминотрансфераза; As – мышьяк; группа 1: уровень металла < (среднее – стандарт- ное отклонение для данного металла); группа 2: (среднее – стандартное отклонение для данного металла) < уровень металла ≤ (среднее для данного
металла); группа 3: (среднее для данного металла) ≤ уровень металла < (среднее + стандартное отклонение для данного металла); группа 4: уровень
металла > (среднее + стандартное отклонение для данного металла).
Notes: G, group; m, mean concentration; ALT, alanine aminotransferase; As, arsenic; Group 1: metal level <(mean – standard deviation for the metal); Group 2:
(mean – standard deviation for the metal) < metal level ≤ (mean for the metal); Group 3: (mean for the metal) ≤ metal level < (mean + standard deviation for the
metal); Group 4: metal level > (mean + standard deviation for the metal)
По предложенному методу «Деревья решений» (Decision Tree) было проанализировано влияние различных концентраций свинца, кадмия и мышьяка на лабораторные показатели – показатели красной крови (гемоглобин, эритроциты), биохимические показатели (глюкоза, АЛТ, АСТ, железосвязывающая способность сыворотки), макроэлементы (кальций, фосфор, цинк, медь), показатели клеточного иммунитета (СD-20,3,4,56,8,95 и их процентное содержание), фагоцитарный индекс,фагоцитарное число, показатели гуморального иммунитета (IgA, IgG, IgM).
Полученные результаты математического моделирования (концентрация свинца, кадмия и мышьяка, уровень фермента АЛТ крови) отражают влияние токсикантов на печеночные клетки. Обнаружена связь между содержанием фермента АЛТ и уровнем мышьяка в крови и моче. Концентрация мышьяка в крови менее 0,2266 мкг/л и в моче менее 0,0101 мг/л была взаимосвязана с содержанием АЛТ в крови в пределах референтного уровня – 0,1–0,68 ммоль/л9 (значение АЛТ, полученное в моделях, – 0,2347 ммоль/л и 0,2148 ммоль/л соответственно). При концентрации кадмия в крови менее 0,0165 мкг/дл и в моче – менее 0,0015 мг/л содержание АЛТ в крови – 0,5279 ммоль/л и 0,2873 ммоль/л соответственно. В соответствии с полученными данными наиболее выраженное неблагоприятное действие на печеночные клетки оказывает свинец. Даже самая низкая концентрация свинца в моче (< 0,0005 мг/л) была связана с увеличением АЛТ до 0,769 ед/л.
По данным математического моделирования установлена связь между концентрацией свинца, кадмия и мышьяка в биосредах и содержанием цинка. Концентрация кадмия в крови менее 0,0165 мкг/дл была взаимосвязана с уровнем цинка в крови 364,047 мкг/дл (рекомендуемый уровень цинка в крови 362,13–383,33 ± 31,69 мкг/дл10). Рост концентрации кадмия в крови до 0,0165 < Cd < 0,0445 был связан с уменьшением концентрации цинка до 283,135 мкг/дл. Концентрация кадмия в моче менее 0,0002 мг/л связана с уровнем цинка 0,4216 мг/л (физиологический уровень цинка в моче составляет 0,27–0,85 мг/л)9 . Увеличение уровня кадмия в моче до 0,0002 < Cd < 0,0015 мг/л связано с ростом элиминации цинка до 0,8913 мг/л.
Обнаружено, что уровень свинца в концентрации менее 0,0005 мг/л в моче связан с референтным уровнем цинка в моче 0,4616 мг/л9 . Обнаружено влияние кадмия на белковый обмен: при увеличении его концентрации в моче более 0,0015 мг/л концентрация мочевины принимала значения ниже принятых референтных уровней 4,3–7,3 ммоль/л9 (значение мочевины в модели – 4,1494 ммоль/л). Концентрация кадмия в моче, которая была взаимосвязана с референтными значениями мочевины в крови (в модели – 4,5842 ммоль/л), составляет менее 0,0015 мг/л.
Установлена связь между концентрацией свинца в крови и величиной фагоцитарного индекса. При концентрации свинца в крови 7,8506 ± 0,1474 мкг/дл величина фагоцитарного индекса составляет 20,443 %, при концентрации свинца менее 1,2353 мкг/дл взаимосвязана со значением фагоцитарного индекса 35,845 % (референтный уровень фагоцитарного индекса составляет 31–60 %)9 .
Носитель маркера апоптоза CD95+ при концентрации свинца в моче в пределах 0,0005 < Pb < 0029 мг/л выше физиологических значений 50–280 мм3 10 (в модели 314,05 мм3 ). Концентрация свинца в моче, которая была взаимосвязана с физиологическим уровнем CD95 в крови, составляет менее 0,0005 мг/л.
Математические модели, построенные по другим клинико-лабораторным показателям (глюкоза, билирубин общий, холестерин, удельный вес мочи, эпителий в моче, фосфор, эритроциты, гемоглобин, железосвязывающая способность сыворотки, скорость оседания эритроцитов, CD8, CD4, CD56, CD95, количество лейкоцитов, эозинофилы, фагоцитарное число, моноциты, тромбоциты), не показали отклонений от референтных значений при изменении концентрации свинца, кадмия и мышьяка в биосредах, но свидетельствовали о дозозависимых тенденциях.
Наименьшие уровни токсикантов, связанные с референтными значениями клинико-лабораторных показателей, составляют:
мышьяк < 0,2266 мкг/дл в крови, < 0,0101 мг/л в моче;
кадмий < 0,0165 мкг/дл в крови, < 0,0002 мг/л в моче;
свинец < 1,2353 мкг/дл в крови, < 0,0005 мг/л в моче.
Обсуждение. Полученные результаты свидетельствуют о высоком уровне хронической заболеваемости детей в организованных коллективах и ее существенном приросте за шестнадцатилетний период в городах с развитой цветной металлургией. Обнаруженные уровни токсической нагрузки по данным биомониторинга ассоциируются с данными хронической заболеваемости детей в организованных коллективах и выявленными отклонениями в показателях здоровья по данным специального обследования. Повышенные уровни свинца в крови в ГО Красноуральск находят свое отражение в превышении среднеобластного показателя заболеваемости психическими расстройствами, свинца в моче в Первоуральском ГО – болезнями системы кровообращения, кадмия в моче в ГО Ревда – болезнями мочеполовых органов, кадмия в крови в ГО Краснотурьинск – болезнями системы кровообращения, мышьяка в крови в Первоуральском ГО – новообразованиями.
Результаты математического моделирования подтверждают влияние токсической нагрузки на показатели гомеостаза и находят свое отражение в исследованиях других авторов. Обнаруженная связь концентрации свинца, кадмия и мышьяка с уровнем трансаминаз иллюстрирует влияние токсикантов на печеночные клетки.
По данным литературы установлено, что рассматриваемые химические вещества оказывают повреждающее действие на печень, вызывая ее дисфункцию [26]. Полученные данные о статистически значимых зависимостях кадмия и свинца с уровнем цинка свидетельствуют о конкурентных взаимоотношениях между ними как на этапе всасывания в желудочно-кишечном тракте, так и при связывании с лигандами. Полученные зависимости также отражают вероятное влияние кадмия на проницаемость проксимальных канальцев почек ионов цинка [3][7][9][10][22–24]. Влияние на систему фагоцитоза, как одного из возможных механизмов элиминации токсикантовиз организма, также показано в ряде исследований11 [13].
Из полученных результатов математического моделирования нами были выбраны наименьшие концентрации данных элементов с целью минимизации возможного риска здоровью.
Полученные нами в ходе математического моделирования данные не претендуют на исчерпывающую характеристику патогенетических механизмов развития отклонений, характерных для специфического воздействия данных химических веществ. Однако превышение наименьших уровней токсикантов, связанных с нормальными значениями клинико-лабораторных показателей, может быть использовано в качестве дополнительного критерия при формировании групп риска среди детского населения, подверженного воздействию химической нагрузки среды обитания, для проведения адресных медико-профилактических и оздоровительных мероприятий.
Выполненное исследование еще раз подтверждает необходимость проведения анализа состояния биомаркеров с целью предотвращения наступления заболевания или ранней доклинической минимизации его проявления.
Выводы
1. Установленные по данным биомониторинга уровни токсической нагрузки ассоциируются с данными о хронической заболеваемости детей в организованных коллективах, обусловленной химическим загрязнением среды обитания.
2. Выявленные статистически значимые зависимости в построенных математических моделях методом «Деревья решений» (Decision Tree) свидетельствуют о возможном конкурентном взаимоотношении свинца, кадмия и мышьяка и возможном влиянии их различных концентраций в биосредах на отклонение аланинаминотрансферазы, цинка, общего белка, фагоцитарного индекса и носителя маркера апоптоза CD95+ от референтных уровней.
3. Полученные в ходе исследования результаты показали, что наблюдаемые отклонения в состоянии здоровья детей с изменениями клинико-лабораторных показателей, по данным специального обследования в ГО Первоуральск, ГО Красноуральск, Кировградский ГО и ГО Краснотурьинск, сопоставимы с уровнями токсической нагрузки у детей и позволяют использовать данные биомониторинга в качестве критериев выбора и формирования групп повышенного риска среди детского населения, подверженного воздействию химической нагрузки среды обитания, для адресного проведения медико-профилактических и оздоровительных технологий и оценки их эффективности.
1. Государственный доклад о состоянии санитарно-эпидемиологического благополучия населения в Свердловской области в 2021 году [Электронный ресурс]. Доступно по: https://www.66.rospotrebnadzor.ru/c/document_library/ get_file?uuid=09130ea3-ab49-4c27-b4b6-06792a94c295&groupId=10156. Ссылка активна на: 09 сентября 2022.
2. Касохов Т.Б. Вторичная иммунная и интерфероновая недостаточность у детей при экопатогенном воздействии свинца, кадмия, цинка: автореф. дисс. … д-ра мед. наук. М, 1999. Доступно по: http://medical-diss.com/medicina/ vtorichnaya-immunnaya-i-interferonovaya-nedostatochnost-u-detey-pri-ekopatogennom-vozdeystvii-svintsa-kadmiya-tsinka. Ссылка активна на 9 сентября 2022 г.
3. Плотникова И.А. Комплексный подход к оценке состояния здоровья и эффективности реабилитационных мероприятий у детей, проживающих в условиях воздействия неблагоприятных факторов окружающей среды: дис. ... д-ра мед. наук. Екатеринбург, 2011. Доступно по: https://www.dissercat.com/content/kompleksnyi-podkhod-k-otsenke-sostoyaniyazdorovya-i-effektivnosti-reabilitatsionnykh-meropr. Ссылка активна на 9 сентября 2022 г.
4. Приказ Министерства здравоохранения РФ от 24 апреля 2018 г. № 186 «Об утверждении Концепции предиктивной, превентивной и персонализированной медицины».
5. МУК 4.1.1483–03 «Определение содержания химических элементов в диагностируемых биосубстратах, препаратах и биологически активных добавках методом масс спектрометрии с индуктивно связанной аргоновой плазмой».
6. МУК 4.1.1482–03 «Определение содержания химических элементов в диагностируемых биосубстратах, поливитаминных препаратах с микроэлементами, в биологически активных добавках к пище и в сырье для их изготовления методом атомной эмиссионной спектрометрии с индуктивно связанной аргоновой плазмой».
7. МУК 4.1.1897–04 «Определение химических соединений в биологических средах».
8. Темнова О.В., Плотникова И.А., Вялухин С.Г. Шаблоны электронных медицинских документов в формате международного стандарта HL7 CDA Release 2 для системы мониторинга детей с экологически обусловленными забо- леваниями для муниципальных детских лечебно-профилактических учреждений. Свидетельство о государственной регистрации программы для ЭВМ № 2013611586. М.: Федеральная служба по интеллектуальной собственности, патентам и товарным знакам, 2013
9. Кишкун А.А. Руководство по лабораторным методам диагностики. М.: ГЭОТАР-Медиа, 2009. 800 с.
10. Плотникова И.А. Комплексный подход к оценке состояния здоровья и эффективности реабилитационных мероприятий у детей, проживающих в условиях воздействия неблагоприятных факторов окружающей среды: дис. ... д-ра мед. наук. Екатеринбург; 2011. Доступно по: https://www.dissercat.com/content/kompleksnyi-podkhod-k-otsenke-sostoyaniyazdorovya-i-effektivnosti-reabilitatsionnykh-meropr. Ссылка активна на 9 сентября 2022 г.
11. Касохов Т.Б. Вторичная иммунная и интерфероновая недостаточность у детей при экопатогенном воздействии свинца, кадмия, цинка: автореф. дисс. … д-ра мед. наук. М., 1999. Доступно по: http://medical-diss.com/medicina/ vtorichnaya-immunnaya-i-interferonovaya-nedostatochnost-u-detey-pri-ekopatogennom-vozdeystvii-svintsa-kadmiya-tsinka. Ссылка активна на 9 сентября 2022 г.
Список литературы
1. Fujishiro H, Hamao S, Tanaka R, Kambe T, Himeno S. Concentration-dependent roles of DMT1 and ZIP14 in cadmium absorption in Caco-2 cells. J Toxicol Sci. 2017;42(5):559-567. doi: 10.2131/jts.42.559
2. Сахаутдинова Р.Р., Клинова С.В., Грибова Ю.В. Цитоморфологические показатели мазков-отпечатков органов лабораторных животных как дополнительный метод оценки токсичного влияния солей тяжелых металлов в эксперименте // Медицина труда и промышленная экология. 2020. Т. 60. № 11. С. 860–862. doi: 10.31089/1026-9428-2020-60-11-860-862
3. Клинова С.В., Минигалиева И.А., Кацнельсон Б.А. и др. Общетоксическое и кардиовазотоксическое действие наночастиц оксида кадмия // Гигиена и санитария. 2020. Т. 99. № 12. С. 1346–1352. doi: 10.47470/0016-9900-2020-99-12-1346-1352
4. Титов Е.А., Якимова Н.Л., Новиков М.А. Альтерация ткани головного мозга и печени белых крыс при свинцовой интоксикации в динамике эксперимента // Гигиена и санитария. 2018. Т. 97. № 10. С. 976–978. doi: 10.18821/0016-9900-2018-97-10-976-978
5. Jain RB. Cadmium and kidney function: Concentrations, variabilities, and associations across various stages of glomerular function. Environ Pollut. 2020;256:113361. doi: 10.1016/j.envpol.2019.113361
6. Кольдибекова Ю.В., Землянова М.А., Пустовалова О.В., Пескова Е.В. Влияние повышенного содержания мышьяка в питьевой воде на изменения биохимических показателей негативных эффектов у детей, проживающих на территории природной геохимической провинции // Гигиена и санитария. 2020. Т. 99. № 8. С. 834–840. doi: 10.47470/0016-9900-2020-99-8-834-840
7. Бузоева М.Р., Ахполова В.О. Сочетанное действие цинка и кадмия на функциональное состояние почек, перекисное окисление липидов и обмен кальция в опытах на крысах // Вестник новых медицинских технологий. Электронное издание. 2019. № 6. С. 127–133. doi: 10.24411/2075-4094-2019-16559
8. Jain RB. Lead and kidney: Concentrations, variabilities, and associations across the various stages of glomerular function. J Trace Elem Med Biol. 2019;54:36-43. doi: 10.1016/j.jtemb.2019.03.007
9. Harari F, Sallsten G, Christensson A, et al. Blood lead levels and decreased kidney function in a population-based cohort. Am J Kidney Dis. 2018;72(3):381-389. doi: 10.1053/j.ajkd.2018.02.358
10. Genchi G, Sinicropi MS, Lauria G, Carocci A, Catalano A. The effects of cadmium toxicity. Int J Environ Res Public Health. 2020;17(11):3782. doi: 10.3390/ijerph17113782
11. Агзамова Г.С., Абдуллаева М.М. Иммунологические механизмы хронических поражений печени при воздействии химических веществ // Медицина труда и промышленная экология. 2019. Т. 59. № 9. С. 536–537. doi: 10.31089/1026-9428-2019-59-9-536-537
12. Зайцева Н.В., Землянова М.А., Чащин В.П., Гудков А.Б. Научные принципы применения биомаркеров в медико-экологических исследованиях (обзор литературы) // Экология человека. 2019. № 9. С. 4–14. doi: 10.33396/1728-0869-2019-9-4-14
13. Neal AP, Guilarte TR. Mechanisms of lead and manganese neurotoxicity. Toxicol Res (Camb). 2013;2(2):99-114. doi: 10.1039/C2TX20064C
14. Ma C, Iwai-Shimada M, Nakayama SF, et al. Japan Environment Children’s Study Group. Association of prenatal exposure to cadmium with neurodevelopment in children at 2 years of age: The Japan Environment and Children’s Study. Environ Int. 2021;156:106762. doi: 10.1016/j.envint.2021.106762
15. Sharma A, Kumar S. Arsenic exposure with reference to neurological impairment: An overview. Rev Environ Health. 2019;34(4):403-414. doi: 10.1515/reveh-2019-0052
16. de Paula Arrifano G, Crespo-Lopez ME, Lopes-Araújo A, et al. Neurotoxicity and the global worst pollutants: Astroglial involvement in arsenic, lead, and mercury intoxication. Neurochem Res. 2022. doi: 10.1007/s11064-022-03725-7. Epub ahead of print.
17. Cai QL, Peng DJ, Lin-Zhao, et al. Impact of lead exposure on thyroid status and IQ performance among school-age children living nearby a lead–zinc mine in China. Neurotoxicology. 2021;82:177-185. doi: 10.1016/j.neuro.2020.10.010
18. Землянова М.А., Пережогин А.Н., Кольдибекова Ю.В. Тенденции состояния здоровья детского населения и их связь с основными аэрогенными факторами риска в условиях специфического загрязнения атмосферного воздуха предприятиями металлургического и деревообрабатывающего профиля // Анализ риска здоровью. 2020. № 4. С. 46–53. doi: 10.21668/health.risk/2020.4.05
19. Кадникова Е.П. Химическое загрязнение среды обитания и состояние здоровья детей дошкольного возраста, по данным социально-гигиенического мониторинга // Здоровье населения и среда обитания. 2019. № 2 (311). С. 9–14. doi: 10.35627/2219-5238/2019-311-2-9-14
20. Delgado CF, Ullery MA, Jordan M, Duclos C, Rajagopalan S, Scott K. Lead exposure and developmental disabilities in preschool-aged children. J Public Health Manag Pract. 2018;24(2):e10-e17. doi: 10.1097/PHH.0000000000000556
21. Wu Y, Lou J, Sun X, et al. Linking elevated blood lead level in urban school-aged children with bioaccessible lead in neighborhood soil. Environ Pollut. 2020;261:114093. doi: 10.1016/j.envpol.2020.114093
22. Jain RB. Cadmium and kidney function: Concentrations, variabilities, and associations across various stages of glomerular function. Environ Pollut. 2020;256:113361. doi: 10.1016/j.envpol.2019.113361
23. Wang M, Chen Z, Song W, Hong D, Huang L, Li Y. A review on cadmium exposure in the population and intervention strategies against cadmium toxicity. Bull Environ Contam Toxicol. 2021;106(1):65-74. doi: 10.1007/s00128-020-03088-1
24. Hong H, Xu Y, Xu J, et al. Cadmium exposure impairs pancreatic β-cell function and exaggerates diabetes by disrupting lipid metabolism. Environ Int. 2021;149:106406. doi: 10.1016/j.envint.2021.106406
25. Smeester L, Fry RC. Long-term health effects and underlying biological mechanisms of developmental exposure to arsenic. Curr Environ Health Rep. 2018;5(1):134-144. doi: 10.1007/s40572-018-0184-1
26. Ахполова В.О., Брин В.Б. Современные представления о кинетике и патогенезе токсического воздействия тяжелых металлов (обзор литературы) // Вестник новых медицинских технологий. 2020. Т. 27. № 1. С. 55–61. doi: 10.24411/1609-2163-2020-16578
Об авторе
Е. П. КадниковаРоссия
Кадникова Екатерина Петровна – начальник отдела социально-гигиенического мониторинга
пер. Отдельный, д. 3, г. Екатеринбург, 620078
Рецензия
Для цитирования:
Кадникова Е.П. Оценка состояния здоровья детей, проживающих в условиях воздействия токсической нагрузки в городах с развитой цветной металлургией Свердловской области. Здоровье населения и среда обитания – ЗНиСО. 2022;(9):67-76. https://doi.org/10.35627/2219-5238/2022-30-9-67-76
For citation:
Kadnikova E.P. Assessment of the Health Status of Children Exposed to Industrial Toxicants in the Towns with Developed Non-Ferrous Metallurgy of the Sverdlovsk Region. Public Health and Life Environment – PH&LE. 2022;(9):67-76. (In Russ.) https://doi.org/10.35627/2219-5238/2022-30-9-67-76









.png)



























