Перейти к:
Профилактика комбинированного цитотоксического действия наночастиц оксидов селена и меди в эксперименте
https://doi.org/10.35627/2219-5238/2022-30-9-43-48
Аннотация
Введение. Предприятия, занятые переработкой медьсодержащего сырья, являются источниками поступления во внешнюю среду аэрозолей сложного состава. В число компонентов, загрязняющих воздух рабочей зоны и атмосферный воздух прилегающих населенных мест, входят селен и медь, в том числе в форме элементооксидных наночастиц.
Цель работы: оценка комбинированного цитотоксического действия наночастиц оксидов селена и меди при применении биопрофилактического комплекса.
Материалы и методы. Цитотоксическое действие моделировалось на белых беспородных крысах-самках путем однократного интратрахеального введения наночастиц оксидов селена и меди в концентрации 0,25 г/л, полученных методом лазерной абляции. Через 24 часа после введения суспензии оценивались цитологические и биохимические показатели бронхоальвеолярной лаважной жидкости. В течение месяца перед интратрахеальным введением суспензий наночастиц часть экспонированных животных получала диету, включающую специально разработанный биопрофилактический комплекс (введение комплекса осуществлялось вместе с питьем и кормом).
Результаты. Однократное интратрахеальное введение суспензий наночастиц оксидов селена и меди вызвало изменение цитологических и биохимических характеристик бронхоальвеолярной лаважной жидкости, свидетельствующих о выраженном цитотоксическом действии наночастиц. В группе экспонированных животных после проведения предварительного курса биологической профилактики было отмечено снижение абсолютного числа нейтрофильных лейкоцитов и соотношения нейтрофильных лейкоцитов и альвеолярных макрофагов, являющегося косвенным показателем цитотоксического действия, а также активности аспартатаминотрансферазы в бронхоальвеолярной лаважной жидкости.
Заключение. Научно обоснованный и экспериментально апробированный биопрофилактический комплекс способен ослабить комбинированное цитотоксическое действие наночастиц оксидов селена и меди.
Для цитирования:
Привалова Л.И., Рябова Ю.В., Сутункова М.П., Гурвич В.Б., Минигалиева И.А., Бушуева Т.В., Тажигулова А.В., Соловьева С.Н., Кацнельсон Б.А. Профилактика комбинированного цитотоксического действия наночастиц оксидов селена и меди в эксперименте. Здоровье населения и среда обитания – ЗНиСО. 2022;(9):43-48. https://doi.org/10.35627/2219-5238/2022-30-9-43-48
For citation:
Privalova L.I., Ryabova Yu.V., Sutunkova M.P., Gurvich V.B., Minigalieva I.A., Bushueva T.V., Tazhigulova A.V., Solovyеva S.N., Katsnelson B.A. Prevention of the Combined Cytotoxic Effect of Selenium and Copper Oxide Nanoparticles in the Animal Experiment. Public Health and Life Environment – PH&LE. 2022;(9):43-48. (In Russ.) https://doi.org/10.35627/2219-5238/2022-30-9-43-48
Введение. Известно, что при ряде производственных процессов, включая металлургические, образуются элементооксидные наночастицы (ЭО НЧ), которые вместе с субмикронными частицами тех же оксидов элементов размером более 100 нм загрязняют воздух рабочих помещений и атмосферы. Как литературные данные, так и экспериментальные исследования нашего коллектива свидетельствуют о том, что мелкодисперсные частицы обладают выраженным вредным воздействием на организм [1–3]. Наряду с техническими способами снижения загрязненности воздуха целесообразен поиск путей повышения устойчивости организма к указанному вредному действию. Эта стратегия, называемая нами биологической профилактикой, развивается научным коллективом ФБУН ЕМНЦ ПОЗРПП Роспотребнадзора на протяжении многих лет. Ранее были научно обоснованы и экспериментально апробированы способы повышения устойчивости к вредному действию наночастиц при их изолированной экспозиции (например, к наносеребру, нанозолоту, наноникелю, наномарганцу [4]) и в комбинации (например, к наномеди, наноцинку и наносвинцу [5]). В данной статье рассматриваются результаты эксперимента, в котором оценивалось влияние комплекса биологически активных веществ (биопрофилактический комплекс (БПК) – это комплекс биологически активных веществ, безвредных при длительном применении и повышающих устойчивость организма к токсическому воздействию химических загрязнителей производственной среды и среды обитания), обладающих антитоксическим действием при интратрахеальном введении комбинации наночастиц оксида селена (SeO) и оксида меди (CuO). Комбинация этих химических элементов встречается в составе загрязнителей воздуха при рафинировании меди и некоторых других производственных процессах, протекающих в электролизных, шламовых, медеплавильных цехах [6][7].
Материалы и методы. Суспензии исследуемых наночастиц (НЧ) были получены в Центре коллективного пользования «Современные нанотехнологии» Уральского федерального университета с помощью лазерной абляции тонких листовых мишеней соответствующего элемента 99,99 % чистоты в стерильной деионизированной воде (ДВ) по методике, описанной ранее [8].
Форма и размер частиц были охарактеризованы с использованием сканирующей электронной микроскопии (СЭМ) и графиков распределения частиц по диаметру (d). Средний диаметр использованных наночастиц оксида селена составил (SeO НЧ) 51 ± 14 нм (рис. 1), оксида меди (CuO НЧ) – 21 ± 4 нм (рис. 2).
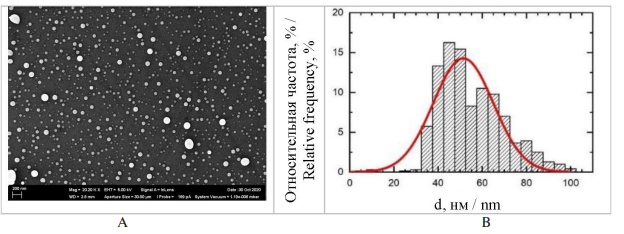
Рис. 1. А – СЭМ-изображение наночастиц SeO в суспензии, приготовленной для экспериментов (увеличение ×20 200);
B – график распределения частиц по диаметру
Fig. 1. А – SeO nanoparticles in the suspension prepared for experiments (SEM, ×20,200 magnification); B – The particle
diameter distribution function
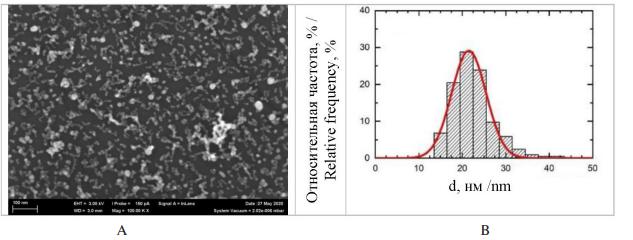
Рис. 2. A – СЭМ-изображение наночастиц CuO в суспензии, приготовленной для экспериментов (увеличение
×100 000); B – график распределения частиц по диаметру
Fig. 2. А – CuO nanoparticles in the suspension prepared for experiments (SEM, ×100,000 magnification);
B – The particle diameter distribution function
Стабильность суспензий характеризовалась величиной дзета-потенциала, измеренного с помощью анализатора Zetasizer Nano ZS (Malvern Panalytical Ltd., UK), и была высокой (дзета-потенциал вплоть до 42 mV), что позволило путем частичного испарения воды при 50 °C повысить концентрацию суспензии до 0,25 г/л без изменения размера и химической идентичности ЭО НЧ.
Исследование проводилось на аутбредных белых крысах-самках. Масса животных учитывалась на начало эксперимента и составляла от 222,43 ± 1,48 г, при этом разброс составлял не более чем 20 %. Статистической значимой разницы по массам между группами не было.
Интратрахеальная инстилляция с помощью специальной воронки по 0,5 мл суспензий SeO НЧ и CuO НЧ в концентрациях 0,25 г/л НЧ («НЧ SeO + НЧ CuO») либо стерильной ДВ без частиц объемом 1 мл («Контроль») осуществлялась крысам под эфирным рауш-наркозом под контролем зрения. Половина животных обеих групп ежедневно на протяжении 4 недель, предшествующих интратрахеальной инстилляции, получала специальную диетическую добавку, содержащую БПК. Соответствующие группы крыс (по 10 особей в каждой) далее обозначаются «Контроль», «НЧ SeO + НЧ CuO», «НЧ SeO + НЧ CuO + БПК», «ДВ + БПК».
В состав испытанного БПК входили следующие компоненты:
- в питье, которое полностью заменяло бутилированную воду: 1,5 % раствор глутамата натрия;
- в корме (дозировка указана из расчета на одно животное): глицин (12 мг), рутин и витамин С (по 1,4 мг), смесь омега-3 полиненасыщенных жирных кислот (с преобладанием докозагексаеновой кислоты не менее 45 % и эйкозапентаеновой кислоты не менее 40 %, общим объемом 13,3 мг), ретинол (1,3 мкг), цианкоболамин (0,69 мкг), витамин D3 (холекальциферол, 1,04 мг).
Этот состав базировался на литературных и собственных данных о патогенетических, защитно-компенсаторных механизмах развития интоксикаций, а также о благоприятном воздействии биологически активных веществ на эти механизмы с учетом токсикодинамических и токсикокинетических эффектов упомянутых ЭО НЧ [8][9].
Бронхоальвеолярный лаваж проводился спустя 24 часа после инстилляции. У крыс под гексеналовым наркозом в препарированную трахею вводилась канюля, соединенная со шприцем Люэра, содержащим 10 мл физиологического раствора. Жидкость поступала в легкие медленно под тяжестью поршня при вертикальном положении животного и шприца. Затем крыса и шприц поворачивались на 180°, и бронхоальвеолярная лаважная жидкость (БАЛЖ) частично перетекала обратно в шприц. Объем БАЛЖ фиксировали, БАЛЖ помещалась в охлажденные пробирки.
Аликвотная проба БАЛЖ набиралась в меланжер для белых кровяных телец вместе с метиленовым синим, растворенным в 3 % уксусной кислоте. Подсчет общего числа клеток велся с помощью камеры Горяева при оптической микроскопии. Остальной объем БАЛЖ центрифугировали в течение 4 мин при 200 г, затем жидкость декантировалась, а из осадка готовились мазки на два предметных стекла. После просушивания на воздухе мазки фиксировались метиловым спиртом и окрашивались азур-эозином. Мазки микроскопировались с иммерсией при увеличении ×1000. Дифференциальный подсчет для определения процента альвеолярных макрофагов (АМ), нейтрофильных лейкоцитов (НЛ) и прочих клеток проводился до общего числа подсчитан ных клеток, равного 100. С учетом общего числа клеток в БАЛЖ эти проценты пересчитывались на абсолютное число AM и НЛ.
Активность аспартатаминотрансферазы (АСТ) в надосадочной жидкости после центрифугирования БАЛЖ оценивалась на анализаторе Cobas Integra 400 plus (Roche Diagnostics GmbH) с использованием соответствующего диагностического набора ASTIFCC (Roche Diagnostics GmbH).
Статистическая значимость межгрупповых различий средних значений оценивалась с помощью t-критерия Стьюдента.
Результаты. Под влиянием наночастиц оксидов селена и меди отмечается статистически значимое увеличение общего числа клеток БАЛЖ в сравнении с контролем. Как показано в таблице, это увеличение происходило преимущественно за счет возрастания числа НЛ. Под влиянием БПК в группе «НЧ SeO + НЧ CuO + БПК» основные цитологические характеристики БАЛЖ – общее число клеток, число НЛ и отношение НЛ/АМ – были существенно снижены в сравнении с соответствующими показателями группы «НЧ SeO + НЧ CuO».
Наряду с этим при интратрахеальном введении комбинации наночастиц оксидов селена и меди в надосадочной жидкости БАЛЖ отмечалось статистически значимое увеличение содержания АСТ. Этот показатель в группах «НЧ SeO + НЧ CuO + БПК» и «ДВ + БПК» не отличался от контроля (рис. 3).
Таблица. Число клеток в жидкости, полученной при БАЛ через 24 часа после интратрахеального введения крысам суспензии
НЧ SeO + НЧ CuO и влияние БПК на эти показатели (Х ± Sx)
Table. The number of cells in the bronchoalveolar lavage fluid counted 24 hours after intratracheal instillation of a SeO NP + CuO
NP suspension to rats and the effect of the bioprophylactic complex (BPC) on these parameters (Х ± Sx)
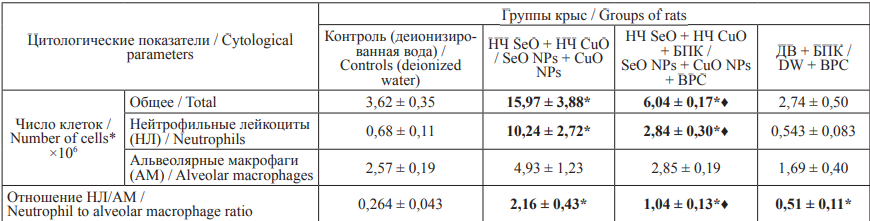
Примечание: значком «*» отмечены значения, имеющие статистически значимые отличия от контрольной группы; знаком «♦» отмечены значения пока- зателей в группе «НЧ SeO + НЧ CuO + БПК», имеющие статистически значимые отличия от показателей в группе «НЧ SeO + НЧ CuO» (по t-критерию
Стьюдента при p ≤ 0,05).
Notes: * statistically different from the control group; ♦ statistically different between the experimental groups with and without BPC (p ≤ 0.05)
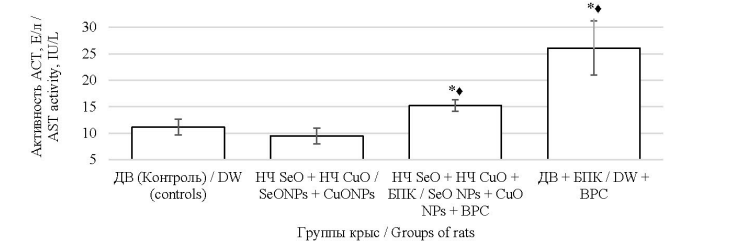
Рис. 3. Содержание аспартатаминотрансферазы (АСТ) в надосадочной жидкости БАЛ. Значком «*» отмечены значения, имеющие статистически значимые отличие от контрольной группы; знаком «♦» отмечены значения показателей в
группе «НЧ SeO + НЧ CuO + БПК», имеющие статистически значимые отличия от показателей в группе «НЧ SeO +
НЧ CuO» (по t-критерию Стьюдента при p ≤ 0,05)
Fig. 3. The level of aspartate aminotransferase (AST) in the supernatant of the bronchoalveolar lavage fluid. Here, * marks the
values statistically different from the control group of rats exposed to deionized water (DW); ♦ marks the values statistically
different between the experimental groups with and without BPC (p ≤ 0.05)
Обсуждение. Показатели, представленные в таблице, служат многократно испытанным критерием сравнительной количественной оценки цитотоксического действия различных частиц. Известно, что мобилизация АМ, и в еще большей степени НЛ, регулируются продуктами разрушения макрофагов, происходящего под действием фагоцитируемых ими цитотоксичных частиц. Повышение соотношения НЛ/АМ является косвенным, но высокоинформативным показателем цитотоксического действия любых интратрахеально введенных или ингалированных малорастворимых частиц, поскольку его увеличение связано с преобладающей мобилизацией НЛ в ответ на действие продуктов разрушения АМ [8][9].
Снижение в группе «НЧ SeO + НЧ CuO + БПК» основных цитологических характеристик БАЛЖ (общее число клеток, число НЛ и, главным образом, отношение НЛ/АМ) может свидетельствовать об ослаблении цитотоксического действия изученной комбинации наночастиц оксидов селена и меди после проведения предварительного курса биологической профилактики. По числу АМ отмечается недостаточно статистически значимая, но благоприятная тенденция, отмечено некоторое их повышение в группе «НЧ SeO + НЧ CuO» и последующее снижение в группе «НЧ SeO + НЧ CuO + БПК».
Практически все цитологические показатели у крыс, получавших только БПК, не отличались от контрольных значений. Исключение составляет соотношение НЛ/АМ, статистически значимое повышение которого произошло за счет недостоверного снижения АМ, но не увеличения НЛ. Предположительно, полученный эффект можно объяснить большой дисперсией числа АМ в БАЛЖ.
Снижение активности АСТ в БАЛЖ можно считать благоприятным действием входящих в состав БПК веществ, которые могли оказать прямой и опосредованный мембраностабилизирующий эффект.
Такое снижение цитотоксического действия обусловлено сложными механизмами защитного действия входящих в комплекс биопротекторов. Витамины способствуют повышению неспецифической сопротивляемости организма, а также оказывают корригирующее действие на обменные процессы. Витамин В12 был включен в качестве компонента, согласно литературным данным [10][11], способствующего снижению вредного действия селена. Особое значение имеет мембраностабилизирующее действие глутамата натрия, поскольку оно может препятствовать повреждению митохондрий и тем самым – оксидативному стрессу, являющемуся, по современным представлениям, одним из основных механизмов цитотоксического действия. Для подавления окисления липидов в состав комплекса нами был включен жирорастворимый антиоксидант – витамин А [12]. Воспалительная реакция, помимо мобилизации нейтрофильных лимфоцитов (НЛ) в рамках реализации естественного механизма самоочищении легких от ЭО НЧ, может быть также опосредована медью, вызывающей острые воспалительные изменения легочной ткани [1][13][14]. Воспалительный ответ способны подавлять такие компоненты БПК, как омега-3 ПНЖК [15], витамин D3 [16], рутин [17][18], витамин С [19][20]. Большое значение, по нашему мнению, имеют разные молекулярные механизмы антиоксидантного действия, в той или иной степени присущие ряду биопротекторов заявляемого комплекса (антиоксидантный синергизм).
Заключение. Однократное интратрахеальное введение комбинации суспензий наночастиц оксидов селена и меди вызвало изменения цитотоксических и биохимических характеристик бронхоальвеолярной лаважной жидкости, характерных для действия типичных цитотоксичных частиц.
Научно обоснованный и испытанный нами в эксперименте биопрофилактический комплекс существенно ослабил это цитотоксическое действие ЭО НЧ. Большое значение, по нашему мнению, имеет разное по молекулярным механизмам антиоксидантное действие, в той или иной степени присущее ряду биопротекторов изученного комплекса (антиоксидантный синергизм).
Данный биопрофилактический комплекс может быть использован в качестве способа минимизации рисков производственной и окружающей среды для здоровья населения, подверженного комбинированному воздействию ЭО НЧ.
Список литературы
1. Cho WS, Duffin R, Poland CA, et al. Differential pro-inflammatory effects of metal oxide nanoparticles and their soluble ions in vitro and in vivo; zinc and copper nanoparticles, but not their ions, recruit eosinophils to the lungs. Nanotoxicology. 2012;6(1):22-35. doi: 10.3109/17435390.2011.552810
2. Cronholm P, Karlsson HL, Hedberg J, et al. Intracellular uptake and toxicity of Ag and CuO nanoparticles: a comparison between nanoparticles and their corresponding metal ions. Small. 2013;9(7):970-982. doi: 10.1002/smll.201201069
3. Сутункова М.П. Экспериментальное изучение токсического действия металлосодержащих наночастиц на предприятиях черной и цветной металлургии и оценка риска для здоровья работающих // Гигиена и санитария. 2017. Т. 96. № 12. С. 1182–1187. doi: 10.47470/0016-9900-2017-96-12-1182-1187
4. Privalova LI, Sutunkova MP, Minigalieva IA, et al. Main results obtained in a series of animal experiments for the assessment of the organism's responses to metallic nanoparticles exposure. IOP Conf Ser: Mater Sci Eng. 2018;443:012025. Accessed July 13, 2022. https://iopscience.iop.org/article/10.1088/1757-899X/443/1/012025/meta
5. Minigalieva IA, Katsnelson BA, Panov VG, et al. In vivo toxicity of copper oxide, lead oxide and zinc oxide nanoparticles acting in different combinations and its attenuation with a complex of innocuous bio-protectors. Toxicology. 2017;380:72-93. doi: 10.1016/j.tox.2017.02.007
6. Кульчицкий Н.А., Наумов А.В. Современное состояние рынков селена и соединений на его основе // Известия вузов. Цветная металлургия. 2015. № 3. С. 40–48. doi: 10.17073/0021-3438-2015-3-40-48
7. Загородняя А.Н. Шлам сернокислотного цеха балхашского медеплавильного завода - альтернативный источник получения селена на предприятии // Комплексное использование минерального сырья. 2018. № 4 (307). С. 46–55. doi: 10.31643/2018/6445.29
8. Privalova LI, Katsnelson BA, Loginova NV, et al. Subchronic toxicity of copper oxide nanoparticles and its attenuation with the help of a combination of bioprotectors. Int J Mol Sci. 2014;15(7):12379–12406. doi: 10.3390/ijms150712379
9. Privalova LI, Katsnelson BA, Varaksin AN, Panov VG, Balesin SL. The pulmonary phagocytosis response to separate and combined impacts of manganese (IV) and chromium (VI) containing particulates. Toxicology. 2016;370:78-85. doi:10.1016/j.tox.2016.09.016
10. Yücel UM, Başbuğan Y, Uyar A, Kömüroğlu AU, Keleş ÖF. Use of an antiarrhythmic drug against acute selenium toxicity. J Trace Elem Med Biol. 2020;59:126471. doi: 10.1016/j.jtemb.2020.126471
11. Gad MA, Abd El-Twab SM. Selenium toxicosis assessment (in vivo and in vitro) and the protective role of vitamin B12 in male quail (Coturnix Coturnix). Environ Toxicol Pharmacol. 2009;27(1):7-16. doi: 10.1016/j.etap.2008.07.001
12. Koekkoek WA, van Zanten AR. Antioxidant vitamins and trace elements in critical illness. Nutr Clin Pract. 2016;31(4):457-474. doi: 10.1177/0884533616653832
13. Pereira TC, Campos MM, Bogo MR. Copper toxicology, oxidative stress and inflammation using zebrafish as experimental model. J Appl Toxicol. 2016;36(7):876-885. doi: 10.1002/jat.3303
14. Fahmy B, Cormier SA. Copper oxide nanoparticles induce oxidative stress and cytotoxicity in airway epithelial cells. Toxicol In Vitro. 2009;23(7):1365-1371. doi: 10.1016/j.tiv.2009.08.005
15. Calder PC. Omega-3 polyunsaturated fatty acids and inflammatory processes: nutrition or pharmacology? Br J Clin Pharmacol. 2013;75(3):645-662. doi: 10.1111/j.1365-2125.2012.04374.x
16. Mousa A, Misso M, Teede H, Scragg R, de Courten B. Effect of vitamin D supplementation on inflammation: protocol for a systematic review. BMJ Open. 2016;6(4):e010804. doi: 10.1136/bmjopen-2015-010804
17. Тараховский Ю.С., Ким Ю.А., Абдрасилов Б.С., Музафаров Е.Н. Флавоноиды: биохимия, биофизика, медицина. Пущино: Synchrobook, 2013. 310 с.
18. Li X, Jin Q, Yao Q, et al. The flavonoid quercetin ameliorates liver inflammation and fibrosis by regulating hepatic macrophages activation and polarization in mice. Front Pharmacol. 2018;9:72. doi: 10.3389/fphar.2018.00072
19. Carr AC, Maggini S. Vitamin C and immune function. Nutrients. 2017;9(11):1211. doi: 10.3390/nu9111211
20. Spoelstra-de Man AME, Elbers PWG, Oudemans-Van Straaten HM. Vitamin C: should we supplement? Curr Opin Crit Care. 2018;24(4):248-255. doi: 10.1097/MCC.0000000000000510
Об авторах
Л. И. ПриваловаРоссия
Привалова Лариса Ивановна – д.м.н., профессор, заведующий лабораторией научных основ биологической профилактики
ул. Попова, д. 30, г. Екатеринбург, 620014
Ю. В. Рябова
Россия
Рябова Юлия Владимировна – младший научный сотрудник отдела токсикологии и биопрофилактики
ул. Попова, д. 30, г. Екатеринбург, 620014
М. П. Сутункова
Россия
Сутункова Марина Петровна – д.м.н., директор
ул. Попова, д. 30, г. Екатеринбург, 620014
В. Б. Гурвич
Россия
Гурвич Владимир Борисович – д.м.н., научный руководитель Центра
ул. Попова, д. 30, г. Екатеринбург, 620014
И. А. Минигалиева
Россия
Минигалиева Ильзира Амировна – д.б.н., заведующий отделом токсикологии и биопрофилактики
ул. Попова, д. 30, г. Екатеринбург, 620014
Т. В. Бушуева
Россия
Бушуева Татьяна Викторовна – к.м.н., заведующий НПО лабораторно-диагностических технологий
ул. Попова, д. 30, г. Екатеринбург, 620014
А. В. Тажигулова
Россия
Тажигулова Анастасия Валерьевна – младший научный сотрудник отдела токсикологии и биопрофилактики
ул. Попова, д. 30, г. Екатеринбург, 620014
С. Н. Соловьева
Россия
Соловьева Светлана Николаевна – к.б.н., заведующий клиникой экспериментальных животных
ул. Попова, д. 30, г. Екатеринбург, 620014
Б. А. Кацнельсон
Россия
Кацнельсон Борис Александрович – проф., д.м.н., научный консультант Центра
ул. Попова, д. 30, г. Екатеринбург, 620014
Рецензия
Для цитирования:
Привалова Л.И., Рябова Ю.В., Сутункова М.П., Гурвич В.Б., Минигалиева И.А., Бушуева Т.В., Тажигулова А.В., Соловьева С.Н., Кацнельсон Б.А. Профилактика комбинированного цитотоксического действия наночастиц оксидов селена и меди в эксперименте. Здоровье населения и среда обитания – ЗНиСО. 2022;(9):43-48. https://doi.org/10.35627/2219-5238/2022-30-9-43-48
For citation:
Privalova L.I., Ryabova Yu.V., Sutunkova M.P., Gurvich V.B., Minigalieva I.A., Bushueva T.V., Tazhigulova A.V., Solovyеva S.N., Katsnelson B.A. Prevention of the Combined Cytotoxic Effect of Selenium and Copper Oxide Nanoparticles in the Animal Experiment. Public Health and Life Environment – PH&LE. 2022;(9):43-48. (In Russ.) https://doi.org/10.35627/2219-5238/2022-30-9-43-48









.png)



























