Перейти к:
Результаты эпидемиологического и микробиологического мониторинга инфекций, связанных с оказанием медицинской помощи, в Республике Северная Осетия – Алания
https://doi.org/10.35627/2219-5238/2022-30-7-57-65
Аннотация
Введение. Комплекс экзогенных и эндогенных факторов риска в многопрофильных стационарах создает условия для развития инфекций, связанных с оказанием медицинской помощи, вызываемых ESKAPE-патогенами.
Цели исследования: определение эпидемиологических особенностей, учет этиологической значимости резистентных штаммов ведущих возбудителей инфекций, связанных с оказанием медицинской помощи, и их pаспространенности в многопрофильных стационарах Рeспyблики Севеpная Оceтия – Алaния.
Материалы и методы. Проведен эпидемиологический анализ результатов мониторинга заболеваемости и данных микробиологического мониторинга чувствительности к антимикробным препаратам ведущих возбудителей в 2012–2021 гг. Выполнена детекция генов, кодирующих продукцию металло-β-лактамаз, у штаммов Р. aeruginosa, β-лактамаз расширенного спектра и PFGE-профилей штаммов E. coli и K. pneumoniaе.
Результаты. В Республике Северная Осетия – Алания среднемноголетний показатель инцидентности в изученный период составил 0,74 на 1000 госпитализированных больных. 44,2 % всех случаев приходится на хирургические отделения, 32,4 % – на отделения родовспоможения, 6,6 % – на детские отделения, 16,8 % – на другие отделения. Среднемноголетний показатель инцидентности в хирургии выше данных по другим отделениям – 0,85 на 1000 пациентов, основными нозологическими формами явились инфекции области хирургического вмешательства, постинъекционные инфекции, инфекции нижних дыхательных путей и инфекции мочевыводящих путей. Ведущими возбудителями в этиологической структуре являются микроорганизмы семейства Enterobacteriaceae, P. aeruginosa и Staphylococcus spp. Показатели инцидентности, установленные на основе результатов организованного микробиологического мониторинга, были в среднем в 2,5 раза выше данных регистрации на основе рутинной системы надзора.
Выводы. Показатели заболеваемости инфекциями, связанными с оказанием медицинской помощи, в Республике Северная Осетия – Алания существенно не отличаются от показателей по РФ в целом. Отделениями риска в регионе являются хирургические. Оптимизация мер профилактики требует риск-ориентированного подхода с учетом данных углубленного микробиологического мониторинга ведущих возбудителей, имеющих механизмы устойчивости к препаратам выбора, распространенных в стационарах.
Для цитирования:
Хабалова Н.Р., Лялина Л.В., Кафтырева Л.А. Результаты эпидемиологического и микробиологического мониторинга инфекций, связанных с оказанием медицинской помощи, в Республике Северная Осетия – Алания. Здоровье населения и среда обитания – ЗНиСО. 2022;(7):57-65. https://doi.org/10.35627/2219-5238/2022-30-7-57-65
For citation:
Khabalova N.R., Lyalina L.V., Kaftyreva L.A. Results of Epidemiological and Microbiological Monitoring of Healthcare- Associated Infections in the Republic of North Ossetia–Alania. Public Health and Life Environment – PH&LE. 2022;(7):57-65. (In Russ.) https://doi.org/10.35627/2219-5238/2022-30-7-57-65
Актуальность проблемы. Надзор и профилактика инфекций, связанных с оказанием медицинской помощи (ИСМП), – это непростые задачи многих практических медицинских направлений и специальностей, сохраняющие актуальность во все периоды развития здравоохранения [1–3].
Показатель заболеваемости в нашей стране находится на уровне 0,8 на 1000 госпитализированных пациентов [1]. Тяжелое течение у пациентов основных патологий, требующих инвазивных медицинских вмешательств, существенно увеличивает риск развития инфекционных осложнений, связанных с оказанием в условиях многопрофильных стационаров необходимой специализированной медицинской помощи [1]. К этой группе риска относятся в первую очередь пациенты хирургических и специализированных реанимационных отделений.
В зависимости от совокупности вышеуказанных эндогенных и экзогенных факторов риска частота инфекций области хирургического вмешательства (ИОХВ) составляет 15–118 случаев на 1000 оперированных пациентов, инфекции нижних дыхательных путей (ИНДП) – 7,9–23,9 на 1000 дней респираторной поддержки, катетер-ассоциированные инфекции кровотока (КАИК) – 3,5–12,2 на 1000 дней катетеризации центральных вен, инфекции мочевыводящих путей (ИМП) – 4,1–8,8 на 1000 дней катетеризации [2].
Успех лечения зависит от правильности назначения антимикробной терапии, так как резистентные к препаратам выбора возбудители выходят на лидирующие позиции как этиологические агенты основных нозологических форм, в том числе у пациентов хирургических и реанимационных отделений [4–8]. Глобальное распространение штаммов, имеющих гены резистентности к антимикробным препаратам (АМП) и способных к их передаче среди возбудителей, представляет значительную угрозу здравоохранению в целом [8–13].
В ходе исследования впервые получены данные об эпидемиологических особенностях ИСМП, эпидемическом процессе, факторах риска в хирургических и специализированных реанимационных отделениях многопрофильных стационаров Республики Северная Осетия – Алания, изучены механизмы формирования резистентности к широкому спектру современных АМП у возбудителей, выделенных из биоматериала от пациентов с данной инфекционной патологией.
Целью исследования явилось определение эпидемиологических особенностей, учет этиологической значимости резистентных штаммов ведущих возбудителей инфекций, связанных с оказанием медицинской помощи и их pаспространенности в многопрофильных стационарах Рeспyблики Севеpная Оceтия – Алaния (РСО-А).
Материалы и методы. Проявления эпидемического процесса ИСМП изучались методом детального ретроспективного анализа заболеваемости взрослого населения за десятилетний период с 2012 по 2021 год. Данные официальной регистрации были подвержены статистической обработке для определения динамики и структуры многолетней заболеваемости, особенностей эпидемического процесса в отделениях различного профиля стационаров РСО-А, частоты возникновения основных нозологических форм ИСМП. Использован метод целенаправленного эпидемиологического наблюдения за исходами ИСМП на основании данных медицинской документации хирургических и реанимационных отделений за 48 календарных месяцев 2012–2013 и 2018–2019 гг. для выявления, стратификации и сравнения фоновых уровней заболеваемости, выявления ведущих экзогенных и эндогенных факторов риска, причинно-следственных связей, определения основных источников инфекции, механизмов передачи возбудителей. Учет ИСМП осуществлялся методом активного выявления с использованием стандартного эпидемиологического определения случая ИСМП.
Отделения хирургического профиля рассматривались в совокупности со специализированными реанимационными в силу общего контингента пациентов, получающих обязательный реанимационный уход в послеоперационном периоде. Многопрофильные отделения реанимации для пациентов с ургентной патологией, не связанные с хирургическими, рассматривать в данном контексте было нецелесообразно, они вошли в категорию «прочие отделения».
Бактериологические методы включали идентификацию микроорганизмов из проб биоматериала, исследование чувствительности к антимикробным препаратам (АМП) выделенных штаммов микроорганизмов различными методами, ретроспективный анализ данных микробиологических исследований биологических проб от пациентов с проявлениями ИСМП. Изучена чувствительность к АМП 3044 изолированных штаммов ведущих микроорганизмов, выделенных за 60 календарных месяцев 2015–2019 гг. Интерпретацию полученных результатов проводили согласно экспертным правилам EUCAST (версия 8.0, 2020), современным критериям CLSI.
Для молекулярно-генетических методов исследований ДНК выделяли с использованием коммерческого набора InstaGen Matrix (BioRad) согласно инструкции производителя. В ходе исследования проводилась детекция генов, кодирующих продукцию β-лактамаз генетических семейств ТЕМ, SHV, ОХА и СТХ-М у штаммов возбудителей семейства Enterobacteriaceae в мультиплексной ПЦР. Детекцию генов, кодирующих продукцию металло-β-лактамаз (VIM, IMP, NDM) у штаммов P. aeruginosa, проводили в ПЦР в режиме реального времени с использованием готовых коммерческих наборов реагентов «АмплиСенс® MDR MBL-FL». «Генотипирование методом PFGE штаммов E. сoli и K. pneumoniae проводилось с рестриктазой XbaI согласно протоколу1 и методу [14], апробированному и широко используемому в лаборатории кишечных инфекций научно-исследовательского института эпидемиологии и микробиологии им. Пастера.
В качестве контрольного использовался штамм S. Branderup. Проведено полногеномное секвенирование 6 штаммов из группы ESКAPE и их депонирование в Государственную коллекцию патогенных микроорганизмов и клеточных культур.
Результаты. Динамика заболеваемости в многопрофильных стационарах РСО-А показывает относительно стабильные уровни заболеваемости, за исключением отдельно взятых лет. Среднемноголетний показатель заболеваемости в РСО-А составил 0,74 на 1000 госпитализированных пациентов (95 % ДИ 0,60–0,88). По данным официальной статистики в основном случаи регистрируются у пациентов старше 18 лет – 0,55 на 1000 госпитализированных (95 % ДИ 0,5–0,61), именно поэтому исследование проводилось в этой возрастной группе.
Среднемноголетняя частота ИСМП в отделениях хирургического и реанимационного профиля была наиболее высока и составила 44,2 %. Среднемноголетний показатель инцидентности в отделениях хирургического и реанимационного профиля в РСО-А составил 0,85 на 1000 госпитализированных (95 % ДИ 0,66–1,04). На втором месте отделения родовспоможения – 32,4 %, среднемноголетний показатель инцидентности составил 0,42 на 1000 госпитализированных (95 % ДИ 0,25–0,59). Заболеваемость в прочих отделениях стационарного типа составила 12,3 %, в детских отделениях – 6,6 %, в амбулаторно-поликлинических учреждениях – 4,5 %.
Несмотря на неразрывную связь между отделениями хирургического и реанимационного профиля, спектр ведущих микроорганизмов, вызывающих ИСМП у пациентов, имел различия.
В отделениях реанимации в пробах биоматериала от пациентов чаще обнаруживались штаммы P. aeruginosa (45,9 на 100 исследований), Staphylococcus spp. (20,9), бактерии семейства Enterobacteriaceae (11,4). Эти микроорганизмы составили более 65 % всех находок.
В отделениях хирургического профиля бактерии семейства Enterobacteriaceae и рода Staphylococcus в биоматериале обнаруживались чаще (37,9 и 38,7 на 100 исследований соответственно). Штаммы P. aeruginosa изолировались реже в 3,5 (13,5). В хирургических и реанимационных отделениях ИОХВ за период исследования составили 44,8 %. Среднемноголетний уровень заболеваемости за анализируемый период составил 0,79 на 1000 оперированных больных. Чаще встречались нагноения послеоперационных ран (88,3 %) и лигатурные абсцессы (11,7 %).
Из отделяемого послеоперационных ран S. aureus выделяли чаще остальных возбудителей (38,7 на 100 исследований), таких как E. coli (19,3), P. aeruginosa (13,5), P. mirabilis (9,6), Enterococcus spp. (7,7), K. pneumoniae (3,6).
Постинъекционные инфекционные осложнения составили 17,5 %. Структура заболеваемости была представлена постинъекционными внутримышечными инфильтратами (28,6 %) и абсцессами (19,4 %), ограниченными инфекционными воспалениями в месте установки катетера (27,1 %), флебитами (14,5 %), колонизациями венозных катетеров (12,3 %), инфекционными воспалениями подкожного кармана (4,9 %), туннельными инфекционными воспалениями (3,2 %). Среднемноголетний показатель инцидентности на 1000 дней катетеризации составил 7,74.
Ведущими этиологическими агентами, выделенным из проб крови, являются коагулазонегативные стафилококки, P. aeruginosa, представители семейства Enterobacteriaceae и S. aureus (63,2, 15,2, 8,6 и 6,3 на 100 исследований соответственно).
Частота возникновения инфекций нижних дыхательных путей (ИНДП) составила 28,6 %. Структура заболеваемости представлена нозокомиальными пневмониями (65 %) и инфицированиями трахеостомических отверстий (24 %). Среднемноголетний показатель инцидентности на 1000 дней респираторной поддержки составил 8,12.
При микробиологическом исследовании проб биоматериала от пациентов с ИНДП (отделяемое дыхательных путей, бронхоальвеолярный лаваж, мокрота) чаще выделяли P. aeruginosa (36 на 100 исследований), K. pneumoniae (27,4), S. aureus (16,9) и E. coli (9,8).
Удельный вес ИМП от числа основных форм ИСМП составил 9,5 %. Среднемноголетний показатель инцидентности составил 8,5 на 1000 дней катетеризации мочевыводящий путей.
Исследование мочи показало, что ведущими возбудителями ИМП являются E. coli (18,2 на 100 исследований), Enterococcus spp., коагулазонегативные стафилококки (16,0), P. aeruginosa (11,4), S. aureus (8,5), K. pneumoniae (7,4), P. mirabilis (4,1). Эпидемиологический анализ с использованием риск-ориентированного подхода показал влияние конкретных факторов на формирование эпидемического процесса и развитие основных нозологических форм ИСМП у пациентов отделений хирургического и реанимационного профиля стационаров РСО-А (табл. 1).
Результаты целенаправленного эпидемиологического наблюдения (ЭН) за течением и исходами ИСМП в хирургических и реанимационных отделениях РСО-А в заявленные периоды времени (24 календарных месяца 2012–2013 годов и аналогичный период 2018–2019 годов) показали причинно-следственную связь между суммарным воздействием ряда эндогенных и экзогенных факторов риска и частотой развития ИСМП.
Из эндогенных факторов риска наиболее значимым явилось физическое состояние пациента. Большинство пациентов отделений хирургии и реанимации при оценке физического состояния по шкале АSA относились к группам Р3, Р4 и Р5. У 47,4 и 52,3 % пациентов с ИСМП (соответственно периодам ЭН) наблюдались тяжелые острые и хронические системные заболевания, 24,7 и 27,4 % (соответственно периодам ЭН) имели инвалидизирующие тяжелые системные заболевания, 12,3 и 14,1 % (соответственно периодам ЭН) поступали в стационары в крайне тяжелых и терминальных состояниях, требующих незамедлительных оперативных и/или реанимационных вмешательств. Такие состояния пациентов, предусматривающие ограничение физической активности, наличие декомпенсированных функций органов и систем, а также ряд неконтролируемых состояний, требуют применения различных медицинских устройств, таких как трахеостомические, нефростомические, послеоперационные дренажные, катетеры центральных вен и мочевыводящих путей, аппараты длительной респираторной поддержки и искусственной вентиляции легких (ИВЛ). Наличие данных устройств более 3 дней рассматривалось как экзогенный фактор риска развития ИСМП.
Исследование показало, что в первый период ЭН (2012–2013 гг.) вышеуказанные экзогенных факторы риска имели эпидемическую значимость в 77,9 % случаев ИСМП. Во второй период наблюдения (2018–2019 гг.) эпидемическая значимость была значительно выше и составила 88,5 % случаев (табл. 2).
По итогам проведенного сравнительного анализа было определено, что в РСО-А в период с 2015 по 2019 г. показатели заболеваемости, установленные на основе результатов организованного микробиологического мониторинга, были выше в среднем в 2,5 раза (в разные годы – от 1,8 до 3,2) данных официальной регистрации на основе рутинной системы надзора. Выделенные в ходе микробиологических исследований из проб биоматериала от пациентов с основными нозологическими формами ведущие возбудители проявляли различные уровни чувствительности к АМП.
11,1 % штаммов P. aeruginosa проявляли чувствительность ко всем АМП. Резистентными к 1 и более АМП были 88,9 % штаммов, причем 16,3 % – ко всем тестируемым препаратам. К цефалоспоринам 3-го поколения резистентны были 88,9 % штаммов, к цефоперазону/сульбактаму – 84,6 %, амикацину – 84,2 %, ципрофлоксацину – 66,9 %. К препарату выбора меропенему устойчивыми были 61,2 % штаммов, чувствительными оставались 38,8 %.
В популяции Staphylococcus spp. 15,8 % штаммов были чувствительны к АМП, устойчивость к 1 и более АМП проявили 84,2 %. Препараты пенициллинового ряда обладали наименьшей активностью – 70,9 % штаммов были резистентны к бензилпенициллину, ампициллину и амоксициллину. Метициллин-резистентность выявлена у 15,2 % штаммов. Фенотипирование по профилям резистентности показало, что 20 % штаммов сочетали устойчивость к пенициллинам с чувствительностью к другим АМП. 64,5 % резистентных штаммов проявляли комбинированную устойчивость к пенициллинам и АМП других групп. 16,5 % штаммов из этой группы были резистентны к 4 и более группам АМП.
Среди E. coli около трети изученных штаммов (35,1 %) оставались чувствительными к АМП, а две трети штаммов (64,9 %) проявляли резистентность к 1 или более препаратам. Полусинтетические пенициллины обладали наименьшей активностью в отношении E. coli. Доля штаммов, устойчивых к полусинтетическим пенициллинам, составила 64,9 %, ингибиторзащищенным пенициллинам – 17,4 %, цефалоспоринам 3–4-го поколения – 27,5 %, карбапенемам – 4,9 %. Устойчивость штаммов E. coli к цефалоспоринам 3-го поколения была вызвана продукцией β-лактамаз широкого спектра действия, а устойчивость к карбапенемам – продукцией карбапенемаз. По анализу фенотипов резистентности штаммов E. coli показал, что большинство штаммов были устойчивы только к полусинтетическим пенициллинам и оставались чувствительными к другим группам АМП. В то же время 6,2 % штаммов характеризовались множественной устойчивостью к АМП разных групп.
Штаммы K. pneumoniae в 41,6 % сохранили чувствительность к противомикробным препаратам, в 58,4 % характеризовались резистентностью к 1 АМП и более. 23,1 % устойчивых к цефалоспоринам 3-го поколения штаммов K. pneumoniae продуцировали β-лактамазы расширенного спектра, а 9,0 % устойчивых к карбапенемам штаммов продуцировали карбапенемазы. Анализ фенотипов резистентности K. pneumoniae показал, что среди устойчивых штаммов более 40,0 % были резистентны к 3 или более группам АМП. К одной или двум группам препаратов были устойчивы не более 10,0 %.
Молекулярно-генетические методы исследования выявили, что штаммы E. coli, устойчивые к ампициллину, продуцируют β-лактамазу широкого спектра ТЕМ-1.
Установлено, что устойчивость к цефалоспоринам 3–4-го поколения у 9 штаммов E. coli и K. pneumoniae была обусловлена продукцией β-лактамаз расширенного спектра, относящихся к генетической группе СТХ-М-1 (табл. 3).
Полимеразно-цепная реакция в режиме реального времени не выявила у штаммов P. aeruginosa наиболее распространенные гены, кодирующие продукцию карбапенемаз (металло-β-лактамаз генетических групп VIM, IMP и NDM).
Штаммы E. coli и K. pneumoniae характеризовались внутривидовой гетерогенностью по спектру резистентности к антимикробным препаратам и PFGE-профилям (табл. 4).
Таблица 1. Основные факторы риска ИСМП в отделениях хирургического и реанимационного профиля стационаров Республики Северная Осетия – Алания
Table 1. The main risk factors of nosocomial infections in hospital surgery departments and intensive care units in the Republic of North Ossetia–Alania

Таблица 2. Эпидемическая значимость применения различных медицинских устройств в развитии ИСМП
Table 2. Contribution of various medical devices to the development of nosocomial infections

Таблица 3. β-лактамазы штаммов энтеробактерий
Table 3. β-lactamases of Enterobacteriaceae strains
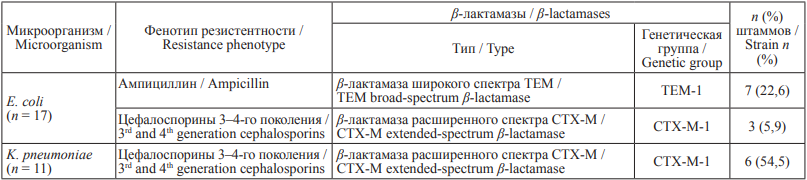
Таблица 4. Внутривидовая гетерогенность энтеробактерий – возбудителей ИСМП
Table 4. Intraspecific heterogeneity of Enterobacteriaceae inducing nosocomial infections

Обсуждение. В многопрофильных стационарах Республики Северная Осетия – Алания показатель заболеваемости ИСМП (0,74 на 1000 госпитализированных пациентов) не имеет статистически значимых отличий от среднего показателя по Российской Федерации, однако выше данных по отдельно взятым регионам (показатель заболеваемости по РФ – 0,7–0,82, в Республике Тыва – 0,01, Республике Алтай – 0,06, Забайкальском крае – 0,08, Свердловской области – 0,16 на 1000 госпитализированных пациентов) [15].
Изучение распределения заболеваемости по профилю отделений показало, что отделениями риска по частоте развития ИСМП являются хирургические и реанимационные (РСО-А – 44,2 %, РФ – 41,9 %2, Оренбургская область – 42,4 %), что вызывает настороженность и требует более организованного риск-ориентированного подхода к вопросам профилактики и надзора [4][16–18]. Высокая частота заболеваемости ИОХВ (РСО-А – 44,8 %, РФ – 23,6 %2) указывает на необходимость совершенствования противоэпидемического режима в стационарах хирургического профиля и организации эпидемиологического наблюдения за исходами хирургических вмешательств с использованием стандартного определения случая.
Высокая частота постинъекционного инфицирования (РСО-А – 17,5 %, в РФ – 6,7 %2) является следствием активного и повсеместного применения инвазивных методов лечения, требующих постоянных инъекционных и инфузионных вмешательств, с необходимостью обеспечения внутривенного доступа путем постановки катетеров центральных сосудов сроком более 3 дней. Немалую роль играет соблюдение правил обработки рук медицинского персонала [2][9].
Частота развития ИНДП в РСО-А составила 28,6 % от числа основных нозологических форм, что ниже данных по стране (РФ – 31,1 %, Оренбургская область – 34,5 %). Практически все случаи инфицирования дыхательных путей связаны с длительной респираторной поддержкой, установкой трахеостомических устройств и подключением к аппаратам ИВЛ, о чем свидетельствуют и данные других исследователей [2][16][19].
Частота возникновения ИМП составила 9,5 %, что выше данных по РФ (5,9 %). 89 % случаев и были связаны с постановкой нефростомических устройств, мочевыводящих катетеров в течение 3 и более дней [2][18].
Результаты двух целенаправленных эпидемиологических наблюдений за исходами ИСМП наглядно показывает линейную зависимость частоты возникновения от комплексного воздействия эндогенных и экзогенных факторов риска. Основную группу риска составили пациенты, которым устанавливались различные медицинские устройства (трахеостомические, нефростомические, дренажные, аппараты искусственной вентиляции легких, катетеры центральных сосудов и мочевыводящих путей в течение 3 и более дней) в силу тяжести состояния пациента (оценка Р3-Р5 по шкале ASA). Тесный контакт органов и тканей с инородными телами в совокупности с необоснованной антимикробной терапией повышает вероятность адгезии и размножения госпитальных штаммов, что увеличивает риск неблагоприятных исходов [1][4][15][17][18].
Разница в показателях инцидентности, выявленных при организованном микробиологическом мониторинге, и данных официальной рутинной регистрации в среднем в 2,5 раза указывает на необходимость использования данных микробиологического мониторинга для полноценной профилактики ИСМП [9][15][20].
Анализ данных микробиологического мониторинга возбудителей, выделенных из проб биоматериала от пациентов в отделениях хирургического и реанимационного профиля, показал, что основными этиологическими агентами являлись штаммы микроорганизмов, проявляющие свойства поли- и мультирезистентности к препаратам выбора [19][21–23].
Часть выделенных штаммов относилась к патогенам группы ESКAPE, имеющим определенные механизмы резистентности к АМП, как генетического, так и негенетического характера и способным передавать их в популяции микроорганизмов, циркулирующих в многопрофильных стационарах [5][7][10][24][25].
Молекулярно-генетические методы исследования, ориентированные на детекцию у штаммов P. aeruginosa карбапенемаз, доказали отсутствие генетической природы проявления резистентности к препаратам карбапенемового ряда и подтвердили данные других авторов о значении природных механизмов эффлюкс-помп и особенностей проницаемости пориновых каналов [5][10].
Выявлена продукция β-лактамаз расширенного спектра ТЕМ-1 и генетической группы СТХ-М-1 у штаммов E. coli и K. pneumoniae, наиболее распространенных в стационарах Российской Федерации и стран Европы [10].
Внутривидовая гетерогенность штаммов возбудителей семейства Enterobacteriaceae по спектру резистентности к АМП и PFGE-профилям свидетельствует об отсутствии моноклональности штаммов, что на сегодняшний день является хорошим прогностическим признаком [10][26][27].
В Государственной коллекции патогенных микроорганизмов и клеточных культур депонированы 6 штаммов микроорганизмов из группы ESКAPE, выделенных в ходе данного исследования. Методом полногеномного секвенирования впервые получены данные их нуклеотидных последовательностей. По результатам данного исследования разработаны и зарегистрированы базы данных, включающие показатели заболеваемости в Республике Северная Осетия – Алания по возрастным группам, профилю отделений, отдельным нозологическим формам за все годы наблюдения и данные чувствительности к антимикробным препаратам и детекции механизмов резистентности ведущих возбудителей [20][28]. Эти внедрения могут быть использованы для перспективных научных исследований проблемы инфекций, связанных с оказанием медицинской помощи [26][27][29].
Заключение. Показатель инцидентности инфекций, связанных с оказанием медицинской помощи, в стационарах Республике Северная Осетия – Алания существенно не отличаются от средних показателей по России в целом, но выше данных по отдельным регионам.
Отделениями риска по частоте развития инфекций, связанных с оказанием медицинской помощи, являются отделения хирургического и реанимационного профиля. Среди всех нозологических форм преобладают инфекции области хирургического вмешательства, катетер-ассоциированные инфекции кровотока, инфекции нижних дыхательных путей и инфекции мочевыводящих путей.
У пациентов отделений хирургического и реанимационного профиля в Республике Северная Осетия – Алания важными прогностическими параметрами развития инфекций, связанных с оказанием медицинской помощи, являются: возраст, отношение к группам риска по шкале АSA Р ≥ 3, длительные (более 4 часов) и высокотравматичные оперативные вмешательства, наличие специальных медицинских устройств или длительная респираторная поддержка (более 3 дней).
Организация эффективных мер профилактики инфекций, связанных с оказанием медицинской помощи, в отделениях хирургического и реанимационного профиля требует риск-ориентированного подхода с учетом данных углубленного микробиологического мониторинга.
Ведущими этиологическими агентами в отделениях хирургического и реанимационного профиля являются представители рода Staphylococcus, возбудителей семейства Enterobacteriaceae и P. aeruginosa, на которые в хирургических отделениях приходится 90,1 %, в реанимации – 78,2 %.
Среди штаммов ведущих возбудителей выявлены высокие уровни резистентности к АМП 73,9 %.
Выявлена резистентность к препаратам выбора у ведущих этиологических агентов:
- 61,2 % штаммов P. aeruginosa были резистентны к карбапенемам;
- 27,5 % штаммов возбудителей семейства Enterobacteriaceae были резистентны к цефалоспоринам 3–4-го поколения.
- 15,6 % штаммов Staphylococcus spp. были метициллин-резистентными.
За счет продукции β-лактамаз расширенного спектра генетической группы СТХ-М1 выявлен высокий уровень резистентности штаммов K. pneumoniae и E. coli к цефалоспоринам 3–4-го поколения (54,5 и 22,6 % соответственно).
Об отсутствии моноклональности штаммов возбудителей семейства Enterobacteriaceae свидетельствует внутривидовая гетерогенность по спектрам резистентности к АМП и PFGE-профилям. Это является хорошим прогностическим критерием.
1. Standard operating procedure for PulseNet PFGE of Escherichia coli O157:H7, Escherichia coli Non-O157 (STEC), Salmonella serotypes, Shigella sonnei and Shigella flexneri. Accessed January 12, 2022. https://pulsenetinternational.org/assets/PulseNet/uploads/pfge/PNL05_Ec-SalShigPFGEprotocol.pdf.
2. О состоянии санитарно-эпидемиологического благополучия населения в Российской Федерации в 2021 году. Государственный доклад. М.: Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека, 2022. 340 с.
Список литературы
1. Тутельян А. В. От внутрибольничных инфекций до инфекций, связанных с оказанием медицинской помощи: научное развитие проблемы / А. В. Тутельян, В. Г. Акимкин, Г. Г. Марьин // Эпидемиология и инфекционные болезни. Актуальные вопросы. – 2019. – Т. 9. – № 1. – С. 14–22. doi: 10.18565/epidem.2019.9.1.14-22
2. Брусина Е. Б. Инфекции, связанные с оказанием медицинской помощи: современная доктрина профилактики. Часть 2. Основные положения / Е. Б. Брусина [и др.] // Эпидемиология и Вакцинопрофилактика. – 2018. – Т. 17. – № 6 (103). – С. 4–10. doi: 10.31631/2073-3046-2018-17-4-10
3. Mehta R., Mavalankar D. V., Ramani K. V., Sharma S., Hussein J. Infection control in delivery care units, Gujarat state, India: a needs assessment. BMC Pregnancy Childbirth. 2011; 11: 37. doi: 10.1186/1471-2393-11-37
4. Яровой С. К. Антибактериальная профилактика при развитии инфекций в области хирургического вмешательства: взгляд эпидемиолога / С. К. Яровой [и др.] // Эпидемиология и инфекционные болезни. Актуальные вопросы. – 2020. – Т. 10. – № 1. – С. 21–29. doi: 10.18565/epidem.2020.10.1.21-9
5. Складан Г. Е. Карбапенем-резистентные возбудители инфекционных процессов различной локализации в отделениях МКНЦ им. А. С. Логинова / Г. Е. Складан [и др.] // Внутрибольничные инфекции в медицинских учреждениях различного профиля, риски, профилактика, лечение осложнений: материалы ХVII научно-практической конференции/ – Москва, 2019. – С. 47–48.
6. Сергевнин В. И. Групповая заболеваемость гнойно-септическими инфекциями клебсиеллезной этиологии пациентов кардиохирургического стационара / В. И. Сергевнин [и др.] // Эпидемиология и Вакцинопрофилактика. – 2020. – Т. 19. – № 1. – С. 90–98. doi: 10.31631/2073-3046-2020-19-1-90-98
7. Скачкова Т. С. Мониторинг метициллинрезистентных штаммов стафилококка в многопрофильном стационаре Москвы с помощью молекулярно-биологических методов / Т. С. Скачкова [и др.] // Эпидемиология и Вакцинопрофилактика. – 2021. – Т. 20. – № 1. – С. 44–50. doi: 10.31631/2073-3046-2021-20-1-44-50
8. Сергевнин В. И. Частота выявления и антибиотикорезистентность возбудителей гнойно-септических инфекций / В. И. Сергевнин, Л. Г. Кудрявцева, О. Г. Пегушина // Эпидемиология и Вакцинопрофилактика. – 2022. – Т. 21. – № 1. – С. 74–80. doi: 10.31631/2073-3046-2022-21-1-74-80
9. Захватова А. С. Микробиологический мониторинг антимикробной резистентности потенциальных возбудителей инфекций кровотока / А. С. Захватова [и др.] // Инфекция и иммунитет. – 2022. – Т. 12. – № 1. – C. 185–192. doi: 10.15789/2220-7619-ARM-1552
10. Дятлов И. А. О механизме защиты бактериальной клетки, который может быть использован для борьбы c антибиотикорезистентностью / И. А. Дятлов // Бактериология. – 2021. – Т. 6. – № 1. – С. 5–7. URL: https://elibrary.ru/item.asp?id=46452094
11. Brouqui P., Boudjema S., Soto Aladro A., et al. New approaches to prevent healthcare-associated infection. Clin Infect Dis. 2017; 65 (suppl_1): S50-S54. doi: 10.1093/cid/cix433
12. Nabhan A. F., Allam N. E., Hamed Abdel-Aziz Salama M. Routes of administration of antibiotic prophylaxis for preventing infection after caesarean section. Cochrane Database Syst Rev. 2016; 2016 (6): CD011876. doi: 10.1002/14651858.CD011876.pub2
13. Theuretzbacher U., Gottwalt S., Beyer P., et al. Analysis of the clinical antibacterial and antituberculosis pipeline. Lancet Infect Dis. 2019; 19 (2): e40-e50. doi: 10.1016/S1473-3099(18)30513-9
14. Durmaz R., Otlu B., Koksal F., et al. The optimization of a rapid pulsed-field gel electrophoresis protocol for the typing of Acinetobacter baumannii, Escherichia coli and Klebsiella spp. Jpn J Infect Dis. 2009; 62 (5): 372-7.
15. Смирнова С. С. Анализ выявления и регистрации инфекций, связанных с оказанием медицинской помощи в Уральском и Сибирском федеральных округах в 2020 году: информационный бюллетень / С. С. Смирнова [и др.] – Екатеринбург: ЮНИКА, 2021. – 56 с.
16. Денисюк Н. Б. Эпидемиологические особенности инфекций, связанных с оказанием медицинской помощи, в Оренбургской области / Н. Б. Денисюк // Эпидемиология и Инфекционные болезни. Актуальные вопросы. – 2021. – Т. 11. – № 1. – С. 37–42. doi: 10.18565/epidem.2021.11.1.37-42
17. Иванова М. В. Эпидемиологические особенности инфекций, связанных с оказанием медицинской помощи в родовспомогательных учреждениях Российской Федерации в 2007–2017 гг. / М. В. Иванова, А. Я. Миндлина // Журнал инфектологии. – 2019. – Т. 11. – № 3. – С. 90–101. doi: 10.22625/2072-6732-2019-11-3-90-101
18. Акимкин В. Г. Актуальные направления научных исследований в области инфекций, связанных с оказанием медицинской помощи, на современном этапе / В. Г. Акимкин, А. В. Тутельян // Здоровье населения и среда обитания. – 2018. – № 4 (301). – С. 46–50. doi: 10.35627/2219-5238/2018-301-4-46-50
19. Шайхразиева Н. Д. Этиологическая структура и антибиотикорезистентность госпитальных штаммов микроорганизмов в отделении анестезиологии и реанимации / Н. Д. Шайхразиева [и др.] // Медицинский альманах. – 2019. – № 1 (58). – С. 32–34. URL: https://cyberleninka.ru/article/n/etiologicheskaya-struktura-i-antibiotikorezistentnost-gospitalnyh-shtammov-mikroorganizmov-v-otdelenii-anesteziologii-i-reanimatsii
20. Березняк Е. А. Создание баз данных для систематизации результатов мониторинга антибиотикорезистентности / Е. А. Березняк [и др.] // Здоровье населения и среда обитания. –2020. – № 4 (325). – С. 59–63. doi: 10.35627/2219-5238/2020-325-4-59-63
21. Омарова С. М. Мониторинг антибиотикорезистентных стафилококков, возбудителей внутрибольничного инфицирования пациентов отделения челюстно-лицевой хирургии / С. М. Омарова, С. Ф. Алиева, А. С. Османов // Международный научно-исследовательский журнал. – 2017. – № 2-2 (56). – С. 30–33. doi: 10.23670/IRJ.2017.56.022
22. Гординская Н. А. Антибиотикорезистентность как фактор вирулентности условно-патогенных микроорганизмов / Н. А. Гординская, Е. В. Борискина, Д. В. Кряжев // Здоровье населения и среда обитания. – 2021. – № 4 (337). – С. 50–56. URL: https://zniso.fcgie.ru/jour/article/view/502?locale=ru_RU
23. Allegranzi B., Bagheri Nejad S., Combescure C., et al. Burden of endemic health-care-associated infection in developing countries: systematic review and meta-analysis. Lancet. 2011; 377 (9761): 228-241. doi: 10.1016/S0140-6736(10)61458-4
24. Присакарь В. И. Внутрибольничные инфекции, вызванные метициллинрезистентными стафилококками (MRS) / В. И. Присакарь, Д. В. Буга, В. И. Сава // Журнал МедиАль. – 2018. – № 2 (22). – С. 8–11.
25. Батчаев Х. Х. Циркуляция ванкомицин-резистентных энтерококков в лечебно-профилактических организациях Карачаево-Черкесской Республики / Х. Х. Батчаев [и др.] // Здоровье населения и среда обитания. – 2020. – № 2 (323). – С. 51–55. doi: 10.35627/2219-5238/2020-323-2-51-55
26. Munir M. U., Ahmed A., Usman M., Salman S. Recent advances in nanotechnology-aided materials in combating microbial resistance and functioning as antibiotics substitutes. Int J Nanomedicine. 2020; 15: 7329-7358. doi: 10.2147/IJN.S265934
27. Natan M., Banin E. From Nano to Micro: using nanotechnology to combat microorganisms and their multidrug resistance. FEMS Microbiol Rev. 2017; 41 (3): 302-322. doi: 10.1093/femsre/fux003
28. Андрюков Б. Г. Нанотехнологии в свете современных антибактериальных стратегий (обзор) / Б. Г. Андрюков // Здоровье населения и среда обитания. – 2021. – № 5 (338). С. 67–77. doi: 10.35627/2219-5238/2021-338-5-67-77
29. MacFadden D. R., Fisman D., Andre J., et al. A platform for monitoring regional antimicrobial resistance, using online data sources: ResistanceOpen. J Infect Dis. 2016; 214 (suppl_4): S393-S398. doi: 10.1093/infdis/jiw343
Об авторах
Н. Р. ХабаловаРоссия
Надина Руслановна Хабалова, аспирант, врач-эпидемиолог, врач-бактериолог
ФБУН «Санкт-Петербургский научно-исследовательский институт эпидемиологии и микробиологии им. Пастера»
197101
ул. Мира, д. 14
Санкт-Петербург
ФБУЗ «Центр гигиены и эпидемиологии в Республике Северная Осетия – Алания»
362021
ул. Николаева, д. 26а
Владикавказ
Л. В. Лялина
Россия
Людмила Владимировна Лялина, д. м. н., профессор, заведующая лабораторией
ФБУН «Санкт-Петербургский научно-исследовательский институт эпидемиологии и микробиологии им. Пастера»
лаборатория эпидемиологии инфекционных и неинфекционных заболеваний
197101
ул. Мира, д. 14
ФГБОУ ВО «Северо-Западный государственный медицинский университет имени И. И. Мечникова»
кафедра эпидемиологии, паразитологии и дезинфектологии
191015
ул. Кирочная, д. 41
Санкт-Петербург
Л. А. Кафтырева
Россия
Лидия Алексеевна Кафтырева, д. м. н., профессор, заведующая лабораторией, руководитель отдела
ФБУН «Санкт-Петербургский научно-исследовательский институт эпидемиологии и микробиологии им. Пастера»
лаборатория кишечных инфекций
отдел микробиологии
197101
ул. Мира, д. 14
ФГБОУ ВО «Северо-Западный государственный медицинский университет имени И. И. Мечникова»
кафедра медицинской микробиологии
191015
ул. Кирочная, д. 41
Санкт-Петербург
Рецензия
Для цитирования:
Хабалова Н.Р., Лялина Л.В., Кафтырева Л.А. Результаты эпидемиологического и микробиологического мониторинга инфекций, связанных с оказанием медицинской помощи, в Республике Северная Осетия – Алания. Здоровье населения и среда обитания – ЗНиСО. 2022;(7):57-65. https://doi.org/10.35627/2219-5238/2022-30-7-57-65
For citation:
Khabalova N.R., Lyalina L.V., Kaftyreva L.A. Results of Epidemiological and Microbiological Monitoring of Healthcare- Associated Infections in the Republic of North Ossetia–Alania. Public Health and Life Environment – PH&LE. 2022;(7):57-65. (In Russ.) https://doi.org/10.35627/2219-5238/2022-30-7-57-65









.png)



























